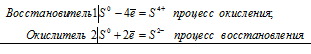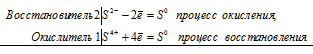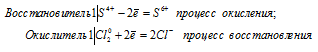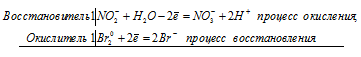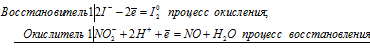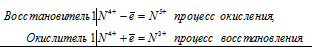Задание 370
Почему атомы большинства р-элементов способны к реакциям диспропорционирования (самоокисления-самовосстановления)? На основании электронных уравнений напишите уравнение реакции серы в концентрированном растворе щелочи. Один из продуктов содержит серу в степени окисления +4.:
Решение:
Атомы р-элементов имеют конфигурацию внешнего электронного слоя ns 2 np (1-6) . Большинство из них способны к диспропорционированию, потому что атомы многих из них содержат на внешнем электронном слое такое количество электронов, что могут их отдавать или же присоединять, т. е. одновременно уменьшать и увеличивать свою степень окисления. Например, сера содержит на внешнем электронном слое шесть электронов два s-электрона и четыре р-электрона. Благодаря наличию свободных d-орбиталей степень окисления серы меняется от -2 до +6. Сера может одновременно менять свою степень окисления от 0 до -2 и от 0 до +6.
Уравнение реакции серы в концентрированном растворе щелочи:
3S 0 = S 4+ + 2S 2-
Задание 371
Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций Н2SO3: а) с сероводородом; б) с хлором.
Решение:
Поскольку в Н2SO3 атом серы находится в своей промежуточной степени окисления +4, то возможны процессы восстановления и окисления, т. е. сера в сернистой кислоте может присоединять электроны, понижая свою степень окисления, а также отдавать электроны, повышая свою степень окисления. Например, легко протекает реакция H2SO3 с сероводородом и с хлором:
а) реакция сернистой кислоты с сероводородом:
2S 2- + S 4+ = 3S 0
б) реакция сернистой кислоты с хлором
Cl2 0 + S 4+ = S 6+ + 2Cl —
З адание 373
Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций НNO2: а) с бромной водой; б) с HI.
Решение:
Поскольку в НNO2 азот находится в своей промежуточной степени окисления +3, то азотистая кислота в окислительно-восстановительных реакциях может быть как восстановителем, так и окислителем. Сильные окислители переводят NO 2- в NO3 — . Сильные восстановители обычно восстанавливают НNO2 до NO. Азотистая кислота способна также к реакциям самоокисления-самовосстановления, которых азот как уменьшает, так и увеличивает свою степень окисления.
Уравнения реакций НNO2 с бромной водой и с HI:
а) реакция азотистой кислоты НNO2 с бромной водой
б) реакция НNO2 с HI:
NО 2- + 2I — +4H + = NО + I2 0 + 2H2O
Задание 374
Почему диоксид азота способен к реакциям самоокисления-самовосстановления (диспропорционирования)? На основании электронных уравнений напишите уравнение реакции растворения NO2 в гидроксиде натрия.
Решение:
Поскольку в NO2 азот находится в своей промежуточной степени окисления +4, то диоксид азота может вступать в реакции самоокисления-самовосстановления, в которых атом азота одновременно уменьшает и увеличивает свою степень окисления.
Уравнение реакции растворения NO2 в гидроксиде натрия:
Задание 377
Почему фосфористая кислота способна к реакциям самоокисления — самовосстановления диспропорционирования)? На основании электронных уравнений составьте уравнение процесса разложения Н3РО3, учитывая, что при этом фосфор приобретает низшую и высшую степени окисления.
Решение:
Поскольку в молекуле Н3РО3 атом фосфора находится в своей промежуточной степени окисления +3, то фосфористая кислота диспропорционирует, т. е. атомы фосфора в реакции самоокисления-самовосстановления одновременно могут, как увеличивать свою степень окисления, так и уменьшать её. Так при нагревании Н3РО3 диспропорционирует с образованием Н3РО4 и РН3:
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Реакция, уравнение которой 3N2 + H2 2NH3 + Q , относят к реакциям: 1) обратимым, экзотермическим 3) обратимым,
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Ваш ответ
Видео:117. Реакция диспропорционирования (дисмутации).Скачать

решение вопроса
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Похожие вопросы
- Все категории
- экономические 43,410
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,042
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
- Соединения
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Реакция нейтрализации — реакция обмена между основанием и кислотой, в ходе которой получаются соль и вода:
Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав исходных веществ. ОВР подразделяются на:
- Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
Внутримолекулярные — атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
Диспропорционирование — один и тот же атом является и окислителем, и восстановителем
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив эту информацию таким образом, вы не будете путаться.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном. При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение. В результате необратимых реакций:
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются воспламенением или взрывом (натрий с водой).
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
Большинство реакций нейтрализации относятся к экзотермическим:
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
📽️ Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Химия, 9 класс, тема "Окислительно-восстановительные реакции" (учитель Швецова Елена Евгеньевна)Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Решение цепочек превращений по химииСкачать

89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Диссоциация электролитов в водных растворах. Видеоурок 39. Химия 9 классСкачать

Окислительно-восстановительные реакции. 3 часть. 9 класс.Скачать

Зависимость скорости реакции от концентрации реагентовСкачать

Проклятая химическая реакция 😜 #shortsСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания | Как составлять молекулярные и ионные уравненияСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать