Пропанол-2, изопропиловый спирт CH3CH2CH2OH – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение пропанола-2
- Водородные связи и физические свойства спиртов
- Изомерия пропанола-2
- Структурная изомерия
- Химические свойства пропанола-2
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- СН3–CHOK –CH 3 + H2O → СН3–CHOH–CH3 + KOH
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление спиртов
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование пропанола-2
- Получение пропанола-1
- 1. Щелочной гидролиз галогеналканов
- 2. Гидрирование карбонильных соединений
- 3. Гидратация алкенов
- Изопропиловый спирт: температура кипения, описание вещества, применение
- Изопропиловый спирт – что это такое?
- Физические свойства
- Основные характеристики изопропилового спирта
- Химические свойства
- Получение
- Применение
- Применение изопропанола в химической и автомобильной промышленности
- Применение изопропанола в других видах хозяйственной деятельности
- Токсичность
- Изопропиловый спирт
- Изопропиловый спирт
- Введение
- Изопропиловый спирт
- 1. Открытие
- 2. Физические свойства
- 3. Получение
- 3.1. Получение из углеводов
- 3.2. Гидратация пропилена серной кислотой в жидкой фазе
- 3.3. Гидратация пропилена в газовой фазе на катализаторах
- 3.4. Лабораторные методы
- 3.5. Очистка полученного спирта
- 4. Химические свойства
- 5. Применение
- 6. Токсикология
- См.. также
- Примечания
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Строение пропанола-2
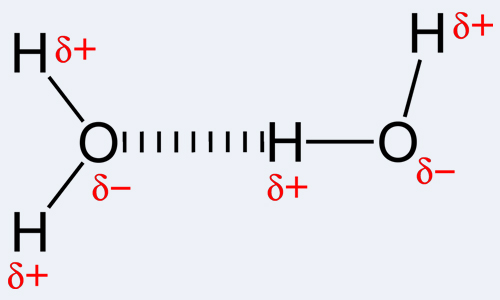
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения пропанола +92 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому пропанол-2 очень хорошо растворим в воде. Молекулы пропанола-2 в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Пропанол-2 смешивается с водой в любых соотношениях.
Видео:"ПОЛЕЗНАЯ ХИМИЯ": ИЗОПРОПИЛОВЫЙ СПИРТСкачать

Изомерия пропанола-2
Видео:Несколько лайфхаков со спиртом. Химия – просто.Скачать

Структурная изомерия
Для пропанола-2 характерна структурная изомерия – изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С3Н8О пропиловый спирт СН3–CH2–CH2–OH и метилэтиловый эфир CH3–O–CH2–CH3 |
| Пропиловый спирт | Метилэтиловый эфир |
| СН3–CH2–CH2–OH | CH3–O–CH2–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
 |  |
Видео:Абсолютный спирт. Химия – ПростоСкачать

Химические свойства пропанола-2
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства пропанола-2
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому пропанол-2 не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Пропанол-2 взаимодействует с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, пропанол-2 взаимодействует с калием с образованием изопропилата калия и водорода . |
2СН3–CH OH –CH3 + 2K → 2СН3–CHOK –CH 3 + H 2
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, изопропилат калия разлагается водой: |
СН3–CHOK –CH 3 + H2O → СН3–CHOH–CH3 + KOH
Видео:Горение изопропилового спиртаСкачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, пропанол-2 реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии пропанола-2 с аммиаком образуется изопропиламин. |
2.3. Этерификация (образование сложных эфиров)
Cпирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, изопропанол реагирует с уксусной кислотой с образованием изопропилацетата (изопропилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии пропанола-2 с азотной кислотой образуется изопропилнитрат. |
Видео:Химия. Растворимость спиртов в воде, горение спиртов, качественные реакцииСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из пропанола-2 под действием концентрированной серной кислоты при высокой температуре образуется пропилен: |
3.2. Межмолекулярная дегидратация
При низкой температуре происходит межмолекулярная дегидратация: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации пропанола-2 при низкой температуре образуется диизопропиловый эфир: |
Видео:Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Вторичные спирты окисляются в кетоны: в торичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Вторичные спирты окисляются до кетонов.
| Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
| Например, при окислении пропанола-2 образуется ацетон |
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) вторичные спирты также окисляются до кетонов.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
| Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания пропанола-2: |
Видео:Получение этилового спирта по наукеСкачать

5. Дегидрирование пропанола-2
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании первичных спиртов образуются альдегиды.
| Например, при дегидрировании пропанола-2 образуется ацетон. |
Видео:65. Что такое реакция гидратации и реакция дегидратацииСкачать

Получение пропанола-1
Видео:25. Схема реакции и химическое уравнениеСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании 2-хлорпропана с водным раствором гидроксида натрия образуется пропанол-2 |
СН3–CHCl –CH 3 + NaOH → СН3–CHOH–CH3 + NaCl
Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

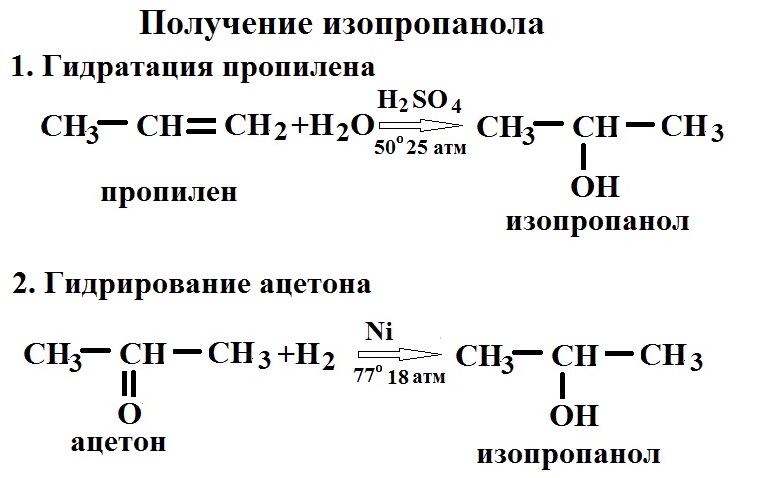
2. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам протекает при нагревании в присутствии катализатора. При гидрировании кетонов образуются вторичные спирты.
| Например: при гидрировании ацетона образуется изопропанол |
Видео:Составление уравнений реакций горения. 11 класс.Скачать

3. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Видео:🐳Дистилляция и ректификация. 10 класс. Химия. Промышленное получение этилового спирта.Скачать

Изопропиловый спирт: температура кипения, описание вещества, применение
Изопропиловый спирт (пропанол-2, изопропанол, i-propanol, isopropyl alcohol) – химическое соединение, получившее широкое распространение благодаря растворяющей способности, дезинфицирующим и консервирующим свойствам. Этот спирт используют во многих видах промышленности, а также автомобилисты и медики.
Видео:Получение изопропилового спирта из омывающей жидкостиСкачать

Изопропиловый спирт – что это такое?
Изопропиловый спирт – вторичный одноатомный спирт. Химическая формула изопропанола СН3 – СН (ОН) – СН3. Изопропанол можно рассматривать как производное насыщенного углеводорода пропана СН3 – СН2 – СН3, в молекуле которого один атом водорода замещен на спиртовую — гидроксильную группу (-ОН). Поскольку гидроксильная группа в молекуле одна, то спирт называют одноатомным. Как видно из химической формулы изопропилового спирта, углерод, связанный с гидроксильной группой, соединен с двумя группами СН3. Поэтому спирт называют вторичным.
Структурная формула изопропилового спирта, а также формулы некоторых других одноатомных спиртов приведены на рисунке.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Физические свойства
Многие свойства изопропанола, температура кипения например, обусловлены наличием спиртовой группы (-ОН). Эта группа обладает высокой полярностью. В результате чего группа –ОН одной молекулы изопропанола образует связь с группой –ОН другой молекулы изопропанола. Таким образом, молекулы ассоциируются, то есть соединяются между собой. Такую связь называют водородной. Она слабая, но имеет большое значение в природе.
Благодаря водородным связям вода H2O при обычных условиях — жидкость, а не газ, как, например, похожее по строению вещество H2S сероводород. Именно наличие водородных связей приводит к тому, что твердая фаза воды – лед — имеет меньшую плотность в природе, чем жидкая фаза, в результате чего лед не тонет.
Образование водородных связей объясняет высокую температуру кипения изопропилового спирта и других низкомолекулярных спиртов в сравнении с соединениями схожего строения. Например, температура кипения пропана -42 °С, то есть пропан при любых температурах выше -42°С находится в газообразном состоянии. Температура кипения изопропилового спирта намного выше и составляет 82,4 °С. Это означает, что изопропанол при обычной температуре находится в жидком состоянии.
Если сравнить температуру кипения изопропилового спирта и метилового, то у первого она несколько выше: 82 градуса против 65. Это означает, что при обычных условиях изопропиловый спирт меньше испаряется, чем метиловый.
Температура плавления и температура кипения изопропилового спирта и некоторых других соединений представлены в таблице.
| Вещество | Температура кипения, о С | Температура плавления, о С |
| Метанол | 65 | -98 |
| Этанол | 78 | -117 |
| Пропанол | 97 | -127 |
| Изопропанол | 82 | -88 |
| Пропан | -42 | -190 |
Образование водородных связей между спиртовыми группами изопропанола и молекулами воды обуславливает растворимость этого спирта в воде. Растворимость зависит от количества углеродных атомов в цепи, чем их меньше, тем лучше растворяется спирт. Поэтому среди спиртов наибольшей растворимостью в воде обладает метанол, который можно смешать с водой в любом соотношении. Этанол растворяется в воде чуть хуже метанола, а изопропанол — хуже этанола.
Видео:Химия 10 класс (Урок№6 - Одноатомные предельные спирты.)Скачать

Основные характеристики изопропилового спирта
Растворяется в ацетоне, в бензоле хорошо растворяется, смешивается с водой, эфиром, этанолом.
Плотность 0,7851 г/см 3 (20 °С).
Нижний предел взрываемости — 2,5% (по объему).
Температура плавления -89,5 °С.
Температура кипения +82,4°С.
Зависимость температуры кипения изопропилового спирта от давления представлена в таблице.
| Давление паров, мм рт.ст. | Температура кипения, о С |
| 1 | -26,1 |
| 10 | 2,4 |
| 40 | 23,8 |
| 100 | 39,5 |
| 400 | 67,8 |
| 1020,7 | 90 |
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Химические свойства
Изопропиловый спирт представляет собой бесцветную жидкость. Обладает характерным запахом, не похожим на запах этилового спирта. Не проводит электрический ток.
Вступает в многочисленные химические реакции, что используется для промышленных синтезов. Большая часть произведенного изопропилового спирта идет на производство ацетона. Для получения ацетона изопропанол необходимо окислить сильным окислителем – смесью K2Cr2O7 + H2SO4 или KMnO4 + H2SO4.
Видео:Синтез АЦЕТОНА из ИЗОПРОПИЛОВОГО спирта. Качественная реакция на АЦЕТОНСкачать
Получение
В России в 2017 году произведено около 40 тыс. тонн изопропилового спирта, почти на 20% меньше, чем в 2016 году. Объем производства достаточно мал — за этот же период метанола произведено почти 4 млн тонн.
Производят изопропиловый спирт в России два предприятия: ЗАО «Завод синтетического спирта» в городе Орске Оренбургской области и ООО «Синтез Ацетон» в городе Дзержинске Нижегородской области.
В Орске производят изопропанол методом сернокислотной гидратации пропилена или пропан-пропиленовой фракции, полученной из газов термического или каталитического крекинга. Получают два вида изопропанола, отличающихся степенью очистки: технический (87%) и абсолютизированный (99,95%). В Дзержинске изопропанол получают гидрированием ацетона.
Побочным продуктом при получении изопропилового спирта гидратацией пропилена является диизопропиловый спирт, который представляет особую ценность как вещество, имеющее высокое октановое число, равное 98.
Видео:7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать

Применение
Изопропиловый спирт – отличный растворитель, поэтому имеет широкую сферу применения. Его используют в основном в химической промышленности, а также в нефтеперерабатывающей, лесохимической, мебельной, медицинской, пищевой, парфюмерной отраслях промышленности, в полиграфии, домашнем хозяйстве. Направления применения:
- растворитель,
- консервант,
- обезвоживающее средство,
- экстрагент примесей,
- стабилизатор,
- антиобледенитель.
Видео:Опыты по химии. Получение этилена и опыты с нимСкачать

Применение изопропанола в химической и автомобильной промышленности
Применение в химической промышленности следующее:
- сырье для производства ацетона,
- производство пластмасс – полиэтилена низкого давления и полипропилена,
- синтез изопропилацетата,
- производство инсектицидов,
- растворитель при производстве этилцеллюлозы, ацетилцеллюлозы, нитроцеллюлозы в лакокрасочной промышленности,
- безопасная транспортировка нитроцеллюлозы (в нее добавляют 30% изопропанола),
- экстрагент в тонкой химической технологии.
- применение в нефтеперерабатывающей промышленности:
- растворитель карбамида, применяемого для депарафинизации дизельного топлива,
- добавка к маслам, усиливающая их антикоррозионные свойства и понижающая температуру застывания,
- «удаление» воды из бензиновых баков.
Вода попадает в топливные магистрали и баки нефтебаз путем конденсации из влажного воздуха. При низких температурах она замерзает и может образовать ледяную пробку. При добавлении абсолютированного изопропанола вода в нем растворяется и не замерзает.
В автомобильной промышленности:
- «удаление» воды из бензобаков путем ее растворения,
- как компонент топлива для повышения октанового числа и уменьшения токсичных выбросов,
- антиобледенитель ветрового стекла,
- антифриз для радиаторов,
- удаление тормозной жидкости с гидравлических тормозных систем.
Применение изопропанола в других видах хозяйственной деятельности
Применение в мебельной и лесохимической промышленности:
- экстракция смол из древесины в смеси с другими растворителями,
- снятие старого лакового покрытия, растворитель французской полировки, клеев, масел,
- связующее вещество в полиролях и очистителях.
В полиграфии изопропанол применяют для увлажнения в печатных процессах. В электронике — в качестве растворителя для очистки контактных разъемов, магнитных лент, головок дисков, лазерных линз, для удаления термопасты, очистки клавиатуры, ЖК-мониторов, стеклянных экранов. Нельзя применять его только для очистки винила, так как изопропанол вступает с ним в реакцию.
Применение в медицинской промышленности и медицине:
- входит в состав антисептических растворов, пропитывающих жидкостей для салфеток,
- обеззараживающее средство для протирания места инъекции,
- 75% водный раствор используют как дезинфицирующее средство для рук,
- дезинфицирующие тампоны,
- осушитель для профилактики отита,
- консервирующее средство для сохранения генетического материала и анализов (менее токсичен, чем формальдегид).
Изопропанол имеет преимущества перед этанолом: более выраженное антисептическое действие и низкую цену. Поэтому в тех случаях, когда раньше применяли этанол, сейчас используют изопропанол.
В косметической и парфюмерной промышленностях изопропанол применяют в производстве:
- косметических средств,
- средств личной гигиены,
- духов, одеколонов, лаков.
В пищевой промышленности изопропанол используют при производстве замороженных продуктов в качестве хладоносителя.
В домашнем хозяйстве:
- для очищения различных поверхностей, кроме резиновых и виниловых,
- для удаления пятен с тканей, древесины,
- для удаления клея от наклеек (на бумажные изопропанол не действует).
Токсичность
Изопропанол применяется в медицине в качестве местного антисептика. При местном использовании быстро испаряется и не оказывает негативного влияния.
При вдыхании паров раздражает дыхательные пути, может вызвать головную боль. Высокая концентрация изопропанола в воздухе тормозит работу ЦНС, приводит к потере сознания. Поэтому работать с изопропанолом можно только в хорошо проветриваемом помещении.
Внутрь изопропанол не применяется, поскольку он токсичен. Попадая в печень, превращается в ядовитое вещество — ацетон, поражающий печень, почки и головной мозг. 200 мл изопропанола являются смертельной дозой.
Изопропиловый спирт
Изопропиловый спирт
- 1 Открытие 2 Физические свойства 3 Получение
- 3.1 Получение из углеводов 3.2 Гидратация пропилена серной кислотой в жидкой фазе
- 3.2.1 Метод концентрированной кислоты 3.2.2 Метод разбавленной кислоты
3.3 Гидратация пропилена в газовой фазе на катализаторах 3.4 Лабораторные методы 3.5 Очистка полученного спирта
4 Химические свойства 5 Применение 6 Токсикология
Введение
Изопропиловый спирт
Изопропиловый спирт (2-пропанол, пропан-2-ол, изопропанол, диметилкарбинол) CH 3 CH (OH) CH 3 — самый вторичный одноатомный спирт алифатического ряда. Относится к веществам 3-го класса опасности (умеренно опасные вещества) по степени воздействия на организм, имеет наркотическое действие. ПДК для паров изопропанола в воздухе составляет 10 мг / м?. Отравление изопропиловым спиртом наступает вследствие вдыхания паров, содержащих концентрацию, превышающую ПДК, кумулятивных свойств не имеет [2]. Потребление даже в небольших дозах вызывает отравление. Широко используется как растворитель в промышленности и технический спирт в средствах для чистки стекла, оргтехники и др..
Товарный изопропанол содержит от 91 до 99,5% спирта. Технические условия для этого продукта не установлено, из-за чего препарат, который поступает на продажу, по составу может соответствовать даже азеотропной смеси с водой. Степень чистоты спирта может колебаться в широких пределах в зависимости от способа его получения и использованной сырья.
1. Открытие
Изопропиловый спирт открыл 1955 года М. Бертло при обработке пропилена концентрированной серной кислотой и разложении продукта реакции водой [3].
2. Физические свойства
Давление паров изопропанола
Изопропиловый спирт растворим в воде, этаноле, эфиром и хлороформе. Растворяет этилцеллюлозу, поливинилбутирал, много масел, алкалоиды, резины и природные смолы [4]. Нерастворимый в растворах солей. В отличие от этанола или метанола, изопропиловый спирт можно выделить из водного раствора добавлением неорганической соли, в частности хлорида или сульфата натрия [5].
Изопропиловый спирт с водой образует азеотроп с точкой кипения 80,37 ? C и долей спирта 87,7% масс. (91% об.). Водно-спиртовая смесь способна снижать температуры плавления [5].
Со снижением температуры растет вязкость изопропанола. При температуре ниже -70 ? C изопропиловый спирт по вязкости напоминает кленовый сироп.
3. Получение
3.1. Получение из углеводов
В небольших количествах изопропиловый спирт, рядом с бутанолом, получают при брожении углеводов [6] [7] [8]
3.2. Гидратация пропилена серной кислотой в жидкой фазе
Основной способ получения изопропанола в промышленности — через косвенную гидратацию пропилена серной кислотой (CH 3 CHCH 2 + H 2 O).
Сырьем обычно служит пропан — пропиленовая смесь газов крекинга или пропиленовая смесь газов пиролиза нефти. При этом процессе возможны следующие химические реакции взаимодействия пропилена с серной кислотой и водой :
Изопропилсульфат реагируя с пропиленом, дает диизопропилсульфат:
Диизопропилсульфат при реакции с водой снова образует изопропилсульфат и изопропиловый спирт
Кроме того, изопропиловый спирт реагирует с диизопропилсульфатом с образованием диизопропиловый эфир и изопропилсульфату:
Пространственное изображение молекулы изопропанола
Многочисленные исследования гидратации пропилена серной кислотой привели к возникновению двух различных методов:
метода концентрированной кислоты; метода разбавленной кислоты.
3.2.1. Метод концентрированной кислоты
Газы стабилизации с крекинг — установок с содержанием пропилена 20-24% сначала отмывают в скрубберах от сероводорода [9] [10]. Затем удаляют выше углеводороды фракционной перегонкой и концентрируют пропилен до минимум 50%. Абсорбцию пропилена можно существенно улучшить с помощью абсорбционного масла, большей частью газойля. Абсорбционное масло облегчает переработку низькоконцентрованого пропилена. Кроме того, оно значительно снижает склонность к полимеризации при использовании высококонцентрированного пропилена.
Абсорбция проводится противотоком в экстракционной колонне с 8 тарелками под давлением 8-10 кгс / см? в 92%-ной серной кислоте при 20 ? С. На каждой тарелке имеется слой абсорбционного масла. После экстракции давление серной кислоты снижают, в отстойнике отделяется экстракционное масло и снова подается в колонну. Экстракт содержит около 1,1-1,3 моль С 3 Н 6 / моль H 2 SO 4. Расход кислоты составляет
12 кг на 10 л 100%-ного изопропилового спирта, расход пропилена — около 39 м? (теоретически — 32 м?).
Температура на отдельных тарелках экстракционной колонны не должна превышать 20 ? С, иначе возможны значительные потери пропилена через полимеризацию.
С отстойника экстракт поступает в освинцованной реакционный аппарат с турбомишалкою, где разбавляется водой до получения 40%-ного раствора, в течение примерно 1 ч при 50 ? С. После 4-часового пребывания в аппарате без перемешивания спирт и образован диизопропиловый эфир экстрагируются водяным паром. Пары спирта и эфира промываются 1% раствором едкого натра. После разведения водой до концентрации 15% конденсат выдерживают несколько дней для отделения полимера. При ректификации сначала выделяют
2% легко кипящих компонентов, во второй колонне изопропиловый спирт концентрируют до 91,3%-ной азеотропной смеси, которая кипит при 80,4 ? С. Выход изопропилового спирта составляет 85-90% по отношению к исходному пропилена.
Для получения безводного изопропилового спирта азеотропную смесь обезвоживают бензолом или диизопропиловый эфиром, реже — диэтиловым эфиром. Главный продукт, который находится в сборнике разделен на 2 слоя, частично возвращается в верхнюю часть колонны (верхний слой из изопропилового спирта и бензола), частично подается в колонну для концентрации (нижний слой из водного изопропилового спирта) для регенерации остатков изопропилового спирта и бензола. Безводный изопропиловый спирт (> 99%) отгоняется снизу колонны.
Все детали аппаратов, которые контактируют с разбавленной серной кислотой изготавливаются или с свинца, или меди. После промывания 1% раствором едкого натра сталь — наиболее подходящий материал для изготовления емкостей, труб и колонн.
3.2.2. Метод разбавленной кислоты
Схематическое изображение молекулы изопропанола
По методу разбавленной кислоты пропилен абсорбируется под давлением 25 кгс / см? при 65 ? С в 70%-ной серной кислоте. При этом диизопропилсульфат не образуется, а изопропиловый спирт получают сразу без дальнейшего разведения водой [11] [12].
В абсорбционной безтарильчату колонну, заполненную 70%-ной серной кислотой, нагнетается предварительно компримированного крекинг — газ, содержащий пропилен. Серная кислота поглощает 1 моль С 3 Н 6 на моль H 2 SO 4. Крекинг-газ с начальным содержанием пропилена около 20-25% абсорбируется до остаточного содержания 5-6%.
Остаточный газ экстрагируется в колонне с колпачковыми тарелками свежей 70%-ной серной кислотой, которая выходит из колонны для омыления, до остаточного содержания пропилена 1%. Затем серная кислота с 0,2% пропилена проходит через безтарильчату колонну. В отгонным колонне и колонне для омыления к смеси серной кислоты и изопропилсульфату прилагается вода до получения 60%-ного раствора, а изопропилсульфат омилюеться. 85%-ный изопропиловый спирт отгоняется. С низа колонны выводится 70%-ная серная кислота, которую можно сразу применять для следующего цикла.
3.3. Гидратация пропилена в газовой фазе на катализаторах
Классический метод получения изопропилового спирта в жидкой фазе имеет некоторые недостатки. Так, потери кислоты довольно значительные, а затраты на ее регенерацию существенны. Кроме того, большие трудности вызывает коррозия оборудования. Поэтому было осуществлено многочисленные опыты по прямого присоединения воды в олефинов на неподвижном слое катализатора. В результате был разработан метод гидратации этилена с применением фосфорной кислоты на цеолите (кизельгур).
Реакция непосредственного преобразования олефинов в спирт является равновесной, протекания реакции способствуют низкая температура, высокий давление и высокое соотношение пара: олефины.
Из многих возможных катализаторов реакции прямой гидратации олефинов для промышленного применения рекомендуется только два [ ]
фосфорная кислота на носителе; оксид вольфрама с промотором.
3.4. Лабораторные методы
Изопропиловый спирт можно получить каталитической гидратацией пропилена при наличии серной кислоты. Максимальный выход спирта (67%) было достигнуто использованием 99%-ной серной кислоты при 15 ? С. При 100 ? С и использовании 85%-ной кислоты плохо поглощаются даже небольшие количества пропилена [13].
Гидратация пропилена также возможна при наличии оксида вольфрама. В этом методе наблюдается высокий выход спирта и образуется меньшее количество полимеров, чем в предыдущем. В тех случаях, когда катализаторы таблетированные при давлении 10 4 кг / см?, конверсия при 250 ? С составляла 16%. Если же таблетирования проводили при давлении 5 ? 10 3 кг / см?, то конверсия при этой же температуре составляла лишь 10% [14].
3.5. Очистка полученного спирта
Очищают изопропиловый спирт, полученный из таких олефинов, как пропилен, обрабатывая его сначала водным раствором едкого натра, а затем подвергая многократной перегонке. Перед последней перегонкой спирт стабилизируют и избавляют от постороннего запаха, добавляя небольшое количество хлористой меди (0,5% или меньше) [15].
Безводный изопропиловый спирт получают, насыщая водную смесь аммиаком и диоксидом углерода. При этом образуются два слоя. Слой, содержащий большее количество воды, перегоняют, получая аммиак, диоксид углерода и азеотропную смесь. Слой с меньшим содержанием воды также подвергают фракционной перегонке с получением азеотроп и безводного спирта [16]
Товарный продукт очищают, осушая его над магниевой лентой и подвергая фракционной перегонке в колонке Дафтона высотой 180 см. Чистейшая фракция кипит при 82,33 — 82,39 ? С [17].
Еще один метод очистки изопропилового спирта заключается в его осушки сначала над хлористым кальцием, а затем — над оксидом бария. После этого его трижды подвергают тщательной фракционной перегонке [18].
«Абсолютный» изопропиловый спирт можно получить перегонкой в ??эффективной колонке над свежегашеной известью. Фракцию, кипящую при 82-82,4 ? С, собирают и встряхивают в течение 2 дней с безводным сульфатом меди, после чего перегоняют несколько раз до достижения постоянной температуры кипения. Полученный таким способом спирт содержит меньше 0,10% воды [19].
Еще один способ получения чистого изопропанола заключается в его сушке над магнием и перегонке над сульфаниловая кислота [20].
Существует и быстрый метод получения безводного изопропилового спирта. Товарный 91%-ный спирт встряхивают с водным раствором едкого натра (взятым в количестве 10% от массы спирта), после чего отделяют от водного раствора, снова встряхивают с большим количеством раствора едкого натра, декантують и перегоняют. Если смешать полученный таким образом продукт с 8 объемами сероуглерода, ксилола или петролейного эфира, то при этом не будет наблюдаться даже незначительного помутнения [21].
Водный раствор изопропилового спирта можно сконцентрировать встряхиванием с хлористым натрием. Верхний слой содержит около 87% пропанола-2 и 2-3% хлористого натрия. Перегонка дает 91%-на азеотропную смесь.
4. Химические свойства
Изопропиловый спирт окисляется до соответствующего кетонов — ацетона. Окислительным агентом в этом процессе может выступать хромовая кислота.
Также ацетон с изопропанола можно получить дегидрогенизации на нагретом медном катализаторе :
Изопропиловый спирт используется одновременно и как растворитель, и как реагент в реакции Меервейна-Пондорфа-Верлея и других процессах, связанных с перемещением водорода. С помощью трехбромистым с изопропанола можно получить 2-бромопропан, а в результате процесса дегидратации при нагревании при наличии серной кислоты, образуется пропилен.

Как и большинство спиртов, изопропиловый спирт взаимодействует с активными металлами (в частности, натрием), образуя алкоголяты.
Реакция с алюминием (инициирована незначительным количеством ртути) применяется для приготовления катализатора — алкоголята алюминия [22].
Из типичных для спиртов реакций, можно привести взаимодействия изопропилового спирта с:
- амидами металлов
- нитрил металлов
- реактивами Гриньяра
- галогеноводнямы (Х: F, Cl, Br, I)