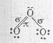Задача 837.
Описать электронное строение молекулы O3, сравнить химическую активность озона и молекулярного кислорода O2. Как получить озон из молекулярного кислорода?
Решение:
Электронное строение трёхатомной молекулы озона можно представить схемой:
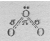
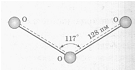
Установлено, что все связи центрального атома кислорода с двумя другими атомами кислорода одинаковы (равноценны) как по длине, так и по энергии. Значит σ- связь, образованная негибридизированными р-орбиталями, является трёхцентровой ковалентной, т.е. электронная — пара делокализована и принадлежит в равной степени всем трём атомам кислорода. Молекула О3 построена в форме равнобедренного треугольника, угол при вершине треугольника 117 0 , что указывает на то, что, центральный атом кислорода находится в состоянии sp 2 – гибридизации. Гибридная sp 2 – орбиталь, содержащая один электрон в центральном атоме, перекрывается с негибридной рх – орбиталью одного из крайних атомов кислорода, образуя σ — связь. Не участвующая в гибридизации рz – орбиталь центрального атома перекрывается с рz – орбиталью другого атома кислорода, образуя σ — связь. Наконец, выступая в качестве донора электронной пары центральный атом кислорода, образует с другим атомом кислорода σ — связь по донорно-акцепторному механизму. Структуру молекулы О3 можно представить схемой:
Рис.3. Структура молекулы О3
Озон как и кислород является сильнейшим окислителем. Он окисляет все металлы, кроме золота и платины. Озон переводит низшие оксиды в высшие, а сульфаты металлов – в их сульфиты. В ходе этих реакций молекула озона теряет один атом кислорода, переходит в молекулу кислорода.
Из раствора иодида калия озон выделяет йод (качественная реакция на О3):
Таким образом, озон более сильный окислитель, чем кислород.
Озон можно получить из молекулярного кислорода действием на последний тихих электрических разрядов:
В природе озон образуется под действием электрических разрядов.
Задача 838.
Может ли при комнатной температуре протекать реакция взаимодействия кислорода: а) с водородом; б) с азотом? Ответ мотивировать, используя табличные данные стандартных значений энергии Гиббса образования веществ, участвующих в процессах.
Решение:
Уравнение реакции взаимодействия водорода с кислородом имеет вид:
Реакция протекает с большим выделением теплоты. Энергия Гиббса образования Н2О имеет отрицательное значение (-228,8 кДж/моль),
ΔG 0 0 С реакция протекает со скоростью в несколько дней, а при 500 0 С кислород и водород полностью прореагируют за несколько часов, при 700 0 С происходит быстрый подъём температуры и реакция заканчивается взрывом. Поэтому, чтобы вызвать взрыв смеси водорода с кислородом, нужно подогреть её хотя бы в одном месте до 700 0 С.
б) При обычных условиях кислород и азот не реагируют друг с другом. Объяснить это можно тем, что энергия Гиббса всех оксидов азота имеет положительное значение, ΔG 0 > 0. Из табличных данных следует, что энтальпия образования всех оксидов азота тоже положительна, т. е. данные реакции являются эндотермическими. Малая скорость взаимодействия кислорода с азотом объясняется высокой энергией активации этих процессов. Молекулы кислорода и азота очень прочны, поэтому чтобы сделать кинетическую энергию сталкивающихся молекул большой необходимо очень сильно повысить температуру системы. И только при достаточно высокой температуре некоторые соударения молекул кислорода и азота становятся эффективными и приводят к образованию активных центров. Так кислород и азот взаимодействуют при температуре электрической дуги (3000 – 4000 0 С):
N2 + O2 
Это эндотермическая реакция, поэтому наблюдается тенденция к уменьшению внутренней энергии, что способствует протеканию данного процесса в обратном направлении, а тенденция к увеличению вероятности состояния вызывает её частичное протекание в прямом направлении. Поэтому, чтобы система N2 + O2 = 2NO достигла наиболее вероятного состояния, необходима высокая температура. Поэтому все оксиды азота получают косвенным путём.
Задача 839.
После озонирования при постоянной температуре некоторого объема кислорода установлено, что объем газа, приведенный к исходному давлению, уменьшился на 500 мл. Какой объем озона образовался? Какое количество теплоты поглотилось при его образовании, если для озона ΔН 0 298о = 144,2 кДж/моль?
Решение:
Уравнение реакции:
Из уравнения реакции следует, что из 3 моль кислорода образуется 2 моль озона, т.е. объём системы уменьшается на 1 моль. Можно записать соотношение, показывающее зависимость от образовавшегося объёма озона и уменьшением объёма системы, получим:
2 : 1 = х : 0,5; х = (2 . 0,5)/1 = 1л.
Находим ΔН 0 реакции:
ΔН 0 х.р. = 2 ΔН 0 (O3) — 3 ΔН 0 (O2) = (2 . 144,2) – 3 . 0 = 288,4 кДж.
Количество теплоты рассчитаем из пропорции:
2 : 22,4 : 288,4 = 1 : х; х = (288,4 . 1)/ (2 . 22,4) = 6,44 кДж.
Ответ: 1л О3; 6,44 кДж.
- Напишите уравнение реакции получения озона из кислорода. Ответ дайте в виде суммы коэффициентов в уравнении реакции.
- Ваш ответ
- решение вопроса
- Похожие вопросы
- Озон (получение применение)
- Что такое озон
- Физические свойства, получение озона
- Озон что это
- Открытие озона
- Химические свойства озона
- Реакции озона с другими веществами
- Озон применение для чего нужен
- Что мы узнали о озоне?
- Похожие страницы:
- Leave a Comment
- 📽️ Видео
Видео:Водород и кислород. 1 часть. 8 класс.Скачать

Напишите уравнение реакции получения озона из кислорода. Ответ дайте в виде суммы коэффициентов в уравнении реакции.
Видео:Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Ваш ответ
Видео:Озон. Аллотропия. 8 класс.Скачать

решение вопроса
Видео:8 класс Практическая работа Получение кислорода и изучение его свойствСкачать

Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,211
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Озон. Вред. Свойства. Озоновые дыры. Химия – ПростоСкачать

Озон (получение применение)
Озон — аллотропное состояние кислорода состоящий из трёхатомных молекул О3, на цвет голубоватый, образуется в атмосфере при электрических разрядах, в лабораторных условиях может быть получен пропусканием т ихих электрических разрядов на кислород.
Основное применение в органическом синтезе других веществ, а также рассматривается как вариант использования жидкого озона для окисления топлива в космических ракетах.
Видео:Кислород. 8 класс.Скачать

Что такое озон
Это аллотропное состояние кислорода, образование озона наблюдается во всех химических процессах, в результате которого выделяется атомарный кислород.
В лабораторных условиях озон можно получить не только пропусканием разрядов через кислород, но действием быстрых электронов и протонов, рентгеновских и ультрафиолетовых лучей.
При пропускании электрических искр через кислород или воздух появляется характерный запах, знакомый каждому, кто имел дело с электростатической машиной или индукционной катушкой. Причиной этого запаха является образование нового газообразного вещества — озона.
Так как озон может быть получен из совершенно чистого сухого кислорода при действии электрических искр, то отсюда следует, что озон состоит только и кислорода и представляет собой особое видоизменение этого элемента.
Видео:Получение озона в лабораторных условияхСкачать

Физические свойства, получение озона

Таким образом, кислород в свободном состоянии может существовать в виде двух аллотропических видоизменений: обыкновенного кислорода О2 и озона.
Для получения озона пользуются действием тихих электрических разрядов на кислород. Приборы, служащие для этой цели,, носят название озонаторов. На рис. 2 изображен озонатор состоящий в основном из двух стеклянных трубок, вставленных одна в другую.
Кислород медленно просасывается между трубками. Во внутреннюю трубку наливают разбавленный раствор серной кислоты, и весь прибор помещают в стакан с тем же раствором. В растворы погружают провода от индукционной катушки.
Таким образом, растворы являются электродами и в тоже время служат для охлаждения газа. При работе катушки в пространстве между стенками трубок происходит тихий электрический разряд. Выходящий из прибора кислород содержит несколько процентов озона. Чем ниже температура, тем больше получается озона.
Видео:Химия 8 класс (Урок№12 - Озон. Аллотропия кислорода. Состав воздуха. Горение.)Скачать

Озон что это
Озон можно отделить от кислорода сильным охлаждением, причем озон сгущается в синюю жидкость, кипящую при —112°. Жидкий озон легко взрывается.
Растворимость озона в воде значительно больше, чем растворимость кислорода: 100 объемов воды при 0° растворяют 49 объемов озона.
При обыкновенной температуре озон довольно устойчив, но. при нагревании легко разлагается, снова превращаясь в кислород. Распад озона сопровождается выделением тепла и увеличением объема в полтора раза, так как из каждых двух молекул озона получаются три молекулы кислорода:
В химическом отношении озон отличается от кислорода более сильной окислительной способностью: при действии озона блестящая серебряная пластинка быстро чернеет, покрываясь слоем перекиси серебра Ag2O2, сернистые соединения металлов окисляются в соли серной кислоты.
Бумага, смоченная скипидаром, воспламеняется; многие красящие вещества обесцвечиваются. При этом молекула озона теряет один атом кислорода и озон переходит в обыкновенный кислород.
Из раствора йодистого калия озон выделяет иод:
Если поместить в воздух, содержащий озон, бумажку, смоченную раствором йодистого калия и крахмальным клейстером, то она тотчас же синеет. Этой реакцией пользуются для открытия озона.
Как сильный окислитель, озон убивает бактерии и потому применяется для обеззараживания воды и для дезинфекции воздуха.
Озон постоянно образуется в небольших количествах при электрических разрядах в атмосфере. Образование озона может происходить также при различных процессах окисления, например при окислении влажного фосфора, скипидара, смолистых веществ и т. п.
Последним обстоятельством объясняется присутствие озона в воздухе хвойных лесов; этот воздух является особенно полезным для здоровья, так как не содержит бактерий.
Видео:Химия | КислородСкачать

Открытие озона
Озон был обнаружен в 1785 физиком из Голландии Мартином ван Марумом, благодаря проведению серии экспериментов, которые проводились в области воздействия электрических разрядов на кислород. В этих результатах ученый пытался исследовать странное на то время явление так называемое «электрическая материя».
В 1850 г. параллельно основной работе, он выяснил, что озон может реагировать с органическими веществами проявляя себя как окислитель.
Благодаря своим дезинфицирующим свойства был применен в 1898 году в Франции. В небольшом на то время городке Бон Вояж был построен завод для дезинфекции воды реки Вазюби.
На территории России завод по озонированию был запущен в Санкт-Петербурге в 1911 году.
Большое применение озона получил в годы Первой мировой войны как антисептическое средство.
В настоящее время с появлением надежных энергосберегающих генераторов озона возросло применение для очистки воды, что хорошо применяется на территории США и по всей Европе.
Видео:Водород. 8 класс.Скачать

Химические свойства озона
Образование озона проходит по обратимой реакции:
3O2 + 68kcal/mol(285kJ/mol) → 2О3
Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут превращается в O2 с выделением тепла.
Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер.
Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
В присутствии небольших количеств азотной кислоты озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (−78 °С) практически не разлагается.
Озон — очень сильный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины и иридия) до их высших степеней окисления (после некоторого поверхностного окисления довольно хорошо противостоят действию озона Ni, Cu, Sn). Озон окисляет многие неметаллы. Продуктом реакции в основном является кислород.
Озон повышает степень окисления оксидов:
Эта реакция сопровождается хемилюминесценцией. Диоксид азота может быть окислен до азотного ангидрида:
Не реагирует с молекулярным азотом при комнатной температуре, но при 295°С озон вступает с ним в реакцию:
Озон реагирует с углеродом при нормальной температуре с образованием диоксида углерода:
Озон не реагирует с аммониевыми солями, но реагирует с аммиаком с образованием нитрата аммония:
Озон реагирует с водородом с образованием воды и кислорода:
Озон реагирует с сульфидами с образованием сульфатов:
С помощью озона можно получить серную кислоту как из элементарной серы, так и из диоксида серы и сероводорода:
В газовой фазе озон взаимодействует с сероводородом с образованием диоксида серы:
В водном растворе проходят две конкурирующие реакции с сероводородом, одна с образованием элементарной серы, другая с образованием серной кислоты:
Все три атома кислорода в озоне могут реагировать по отдельности в реакции хлорида олова с соляной кислотой и озоном:
Обработкой озоном раствора иода в холодной безводной хлорной кислоте может быть получен перхлорат иода(III):
Твёрдый перхлорат нитрония может быть получен реакцией газообразных NO2, ClO2 и O3:
Озон может участвовать в реакциях горения, при этом температуры горения выше, чем с двухатомным кислородом:
Озон может вступать в химические реакции и при низких температурах. При 77 K (−196 °C, температура кипения жидкого азота), атомарный водород взаимодействует с озоном с образованием гидропероксидного радикала с димеризацией последнего:
Озон может образовывать неорганические озониды, содержащие анион O3 − . Эти соединения взрывоопасны и могут храниться только при низких температурах. Известны озониды всех щелочных металлов (кроме франция). KO3, RbO3 и CsO3 могут быть получены из соответствующих супероксидов:
Озонид калия может быть получен и другим путём из гидроксида калия[13]:
NaO3 и LiO3 могут быть получены действием CsO3 в жидком аммиаке NH3 на ионообменные смолы, содержащие ионы Na + или Li + :
Обработка озоном раствора кальция в аммиаке приводит к образованию озонида аммония, а не кальция:
Озон может быть использован для удаления железа и марганца из воды с образованием осадка (соответственно гидроксида железа(III) и диоксигидрата марганца), который может быть отделён фильтрованием:
В кислых средах окисление марганца может идти до перманганата.
Озон превращает токсичные цианиды в менее опасные цианаты:
Озон может полностью разлагать мочевину:
Взаимодействие озона с органическими соединениями с активированным или третичным атомом углерода при низких температурах приводит к соответствующим гидротриоксидам.
Реакция озона с непредельными соединениями с образованием органических озонидов находит применение в анализе органических веществ.
Реакции озона с другими веществами
Озон реагирует в водном растворе с сероводородом образуя серную кислоту
и элементарной серы
Реагирует с углеродом при нормальных условиях
Видео:Химия. 8 класс. Кислород и озон /30.12.2020/Скачать

Озон применение для чего нужен
Давно рассматривается применение озона в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике. Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть 719 ккал/кг).
Больше будет, соответственно, и удельный импульс. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 и 1,14 г/см³ соответственно), а его температура кипения выше (−112 °C и −183 °C соответственно), поэтому в этом отношении преимущество в качестве окислителя в ракетной технике больше у жидкого озона.
Однако препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·10 7 дин/см² (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона).
Преимуществом подобной смеси также является больший удельный импульс для водородных двигателей, по сравнению с озон-водородными. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191.
Также разгонные вакуумные двигатели вышли по УИ на близкие к предельным параметры, и для повышения удельного импульса необходимо найти возможность перейти на новые виды топлива.
Жидкий озон при низких температурах (в жидком азоте) также иногда применяется в органическом синтезе для мягкого разрыва двойной углерод-углеродной связи.
Видео:Свойства кислорода. 8 класс.Скачать

Что мы узнали о озоне?
Как пахнет озон?
Запах — резкий, специфический «металлический» (по Менделееву — «запах раков»). При больших концентрациях напоминает запах хлора. Запах ощутим даже при разбавлении 1:100000.
Как образуется озон?
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
Какая плотность озона?
Сколько атомов кислорода содержится в молекуле озона?
В молекуле озона — три атома кислорода, а в молекуле кислорода — два атома кислорода.
Вы читаете, статья на тему Озон
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
📽️ Видео
Занятие 11 | Воздух. Кислород и озон. Методы собирания газов | Курс химии | 7 классСкачать

Получение озона и его определениеСкачать

Кислород и озон сравнительная характеристикаСкачать

Кислород химический элемент и простое вещество Получение кислородаСкачать

94. Превращение кислорода в озонСкачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химия, 8 класс, Кислород, ОзонСкачать