Рассмотрим некоторые способы получения серебра, а также остановимся на его физических и химических свойствах. Этот металл привлекал человека еще в далекие античные времена. Своему наименованию серебро обязано санскритскому слову «аргента», что переводится как «светлый». От слова «аргента» пошло и латинское «аргентум».
- Интересные факты о происхождении
- Серебро на Руси
- Характеристика свойств
- Области применения
- Электролиз растворов солей
- Химизм процесса
- Получение в лаборатории
- Добыча и открытие
- Заключение
- Хлорид Серебра (свойства реакции применение FAQ)
- Что такое хлорид серебра (AgCl)
- Получение в лабораторных условиях
- Реакции хлорида серебра
- Минерал хлорид серебра
- Применение хлорида серебра
- Что мы узнали о хлориде серебра?
- Похожие страницы:
- Leave a Comment
- Хлорид серебра I
- Содержание
- Молекулярная и кристаллическая структура
- Физические свойства
- Получение
- Химические свойства
- Применение
- Безопасность
Видео:Серебро в ОСАДКЕ. Творожок ХЛОРИДА СЕРЕБРА 🥰 #химия #experiment #chem #chemolife #amazing #сереброСкачать

Интересные факты о происхождении
Существует множество версий о происхождении этого загадочного металла. Все они связаны с Древним миром. К примеру, в Древней Индии серебро ассоциировали с Луной и Серпом – древнейшим орудием земледельца. Отблеск этого благородного металла подобен свету Луны, поэтому в алхимический период серебро обозначали символом Луны.
Видео:Получение серебра - реакция серебряного зеркала! (химия)Скачать

Серебро на Руси
В древней Руси мерой стоимости различных предметов являлись бруски серебра. В тех случаях, когда какой-то предмет торговли стоил меньше всего бруска, от него отрубали часть, соответствующую указываемой стоимости вещи. Эти части назывались «рублями», Именно от них пошло название принятой в России денежной единицы — рубль.
Еще за 2500 лет до нашей эры египетские воины применяли серебро для лечения боевых ран. Они накладывали на них тонкие пластины серебра, и раны быстро заживали. В русской православной церкви святую воду для прихожан выдерживали только в серебряных сосудах. С середины прошлого века появились такие отрасли промышленности, как фотография, электротехника, радиоэлектроника, что привело к резкому росту спроса на серебро, его изъятию из денежного оборота.
Высокая электропроводность, хорошая пластичность, невысокая температура плавления, небольшая химическая активность серебра заинтересовала и радиотехников.
Видео:Серебро из хлорида серебраСкачать

Характеристика свойств
Все способы получения серебра основываются на его свойствах. Это металл белого цвета, практически не меняющийся под действием кислорода воздуха при комнатной температуре. Из-за присутствия в воздухе сероводорода, он со временем покрывается темным налетом сульфида серебра Ag2S. Удаляют данное соединение с поверхности серебряного изделия механически, применяя чистящие пасты либо тонкий зубной порошок.
Серебро довольно устойчиво к воде. Соляная, а также разбавленная серная кислота и царская водка на него не действуют, так как на поверхности металла образуется защитная пленка его хлорида AgCl.
Получение нитрата серебра основывается на способности металла вступать в реакцию с азотной кислотой. В зависимости от ее концентрации в продуктах реакции помимо серебра могут находиться оксиды азота (2 или 4).
Получение оксида серебра осуществляется путем добавления раствора щелочи к нитрату серебра. Получаемое соединение имеет темно-коричневый цвет.
Видео:Восстановление хлорида серебра алюминием и цинком Дешевый методСкачать

Области применения
Благодаря физическим и механическим свойствам именно серебром покрывают радиодетали для повышения электрической проводимости и коррозионной устойчивости. Металлическое серебро используется при изготовлении серебряных электродов для различных видов современных аккумуляторов. Вопросами электролитического серебрения и никелирования достаточно долго занимались специалисты в области гальванотехники: А. Ф. и П.Ф. Симоненко, А. П. Сапожников и др. И.М. Федоровский перенес вопрос, касающийся антикоррозийной стойкости покрытий, из лаборатории в промышленное производство. Соединения серебра (AgBr, AgCl, AgI) применяются для производства кино- и фотоматериалов.
Видео:Как добыть чистое серебро?Скачать

Электролиз растворов солей
Рассмотрим получение серебра электролизом его солей. Собирается электрическая схема, в которой в качестве источника тока выступает гальванический сухой элемент. Максимальный ток в цепи не должен превышать 0,01 А. При применении сухой батарейки (4,5 В) ток ограничивается с помощью добавки проводника с сопротивлением не больше 1000 Ом.
Ванной для процесса серебрения может служить любой стеклянный сосуд. Анодом ванны выступает пластинка металла, имеющего толщину 1 мм и площадь чуть побольше, чем у самой детали. Серебро выбирают для анодного покрытия. В качестве рабочего раствора (электролита) для получения серебра выступает раствор ляписа. До опускания в ванну для серебрения необходимо обезжирить и отполировать деталь, затем протереть ее зубной пастой.
После удаления жира она промывается проточной водой. Судить о полном обезжиривании можно по равномерному смачиванию всей поверхности детали водой. При промывке пользуются пинцетом, чтобы на детали не оставались жировые следы от пальцев. Сразу после промывки деталь фиксируется на проволоке и помещается в ванну. Время получения серебра при серебряном аноде составляет 30 — 40 минут.
Если в качестве анода выбирается нержавеющая сталь, в таком случае скорость процесса меняется. Получение серебра из нитрата будет составлять 30 минут.
Вынутую из ванны деталь качественно промывают, обсушивают, начищают до блеска. При образовании темного осадка серебра ток снижается, для этого подключается дополнительное сопротивление. Это позволяет повысить качество получения серебра электрохимическим способом. Для равномерности покрытия в процессе электролиза деталь периодически поворачивается. Можно отложить металл на латунь, сталь, бронзу.
Видео:Восстановление хлорида серебра до 999 металла. Convert silver chloride to 999 metal.Скачать

Химизм процесса
С какими процессами связано получение серебра? Реакции основываются на расположении металла после водорода в ряде стандартных электродных потенциалов. На катоде будет происходить восстановление катионов серебра из его нитрата в чистый металл. На аноде осуществляется окисление воды, сопровождающееся образованием газообразного кислорода, поскольку ляпис образован кислородсодержащей кислотой. Суммарное уравнение электролиза имеет следующий вид:
4Ag NO3 + 2Н2О электролиз 4Ag + О2 + 4HNO3
Видео:Как получить хлорид серебраСкачать

Получение в лаборатории
Рабочим раствором (электролитом) может стать отработанный фиксаж, в котором присутствуют катионы серебра. Галогениды этого металла образуют с тиосульфатом ряд комплексных солей. При электролизе на катоде выделяется серебро – металл. Получение его подобным способом сопровождается и выделением серы, что приводит к появлению на его поверхности тонкого черного слоя сульфида серебра.
Видео:Получение НИТРАТА СЕРЕБРАСкачать

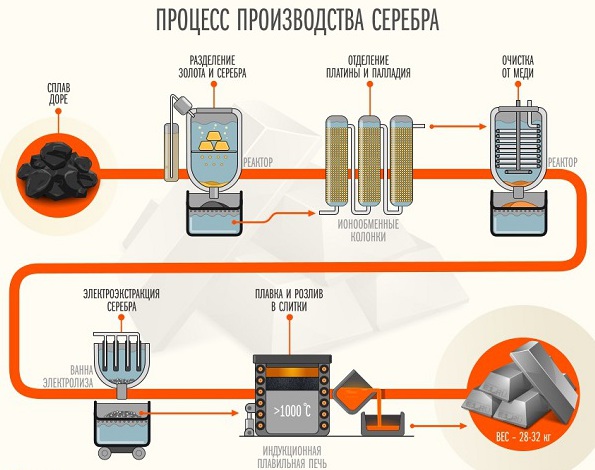
Добыча и открытие
Первые упоминания о добыче серебра связаны с месторождениями, которые были обнаружены финикиянами на Кипре, в Сардинии, Испании, Армении. Металл присутствовал в них в соединении с серой, хлором, мышьяком. Удавалось обнаруживать и самородное серебро внушительных размеров. К примеру, крупнейшим самородком серебра является образец, вес которого составлял тринадцать с половиной тонн. При очистке природных самородков расплавленным свинцом получался тусклый металл. В Древней Греции его именовали Электроном, предугадывая его отличные электропроводные свойства.
В настоящее время электролизом получают плотный слой металлического серебра. В качестве электролита применяют не только нитрат, но и цианиды. Отделение от меди серебра осуществляют выполняя электролиз из холодного раствора, в составе которого около одного процента серной кислоты, 2-3% персульфата калия. Порядка 20 мг металла можно отделить от меди за 20 минут, используя напряжение около 2 В.
В процессе электролиза в растворе должен оставаться избыток персульфата калия. Также среди вариантов разделения этих металлов можно рассмотреть электролиз кипящей уксуснокислой смеси. В настоящее время используются методики, предполагающие применение комплексантов. В растворе, который содержит ион этилендиаминтетрауксусной кислоты (ЭДТА) при кислой среде, серебро осаждается за 25 минут. Его отделяют от пластины путем электролитического осаждения на протяжении 2,5-3 часов.
От висмута и алюминия серебро отделяют путем проведения электролиза азотнокислого раствора при условиях, аналогичных разделению его смеси с медью.
Видео:780 грамм серебра 999. Аффинаж серебра при помощи щелочи.Скачать

Заключение
Отметим, что получение ацетиленида серебра является качественной реакцией в органической химии на присутствие в смеси ацетилена и других алкинов, в которых тройная связь располагается в первом положении. В промышленных масштабах серебро используется в электротехнической и металлургической промышленности. Оно является побочным продуктом при переработке комплексных сульфидов металлов, в составе которых есть аргенит (сульфид серебра).
В процессе пирометаллургической переработки полиметаллических сульфидов цинка, меди серебро извлекается вместе с основными металлами в качестве серебросодержащих соединений. Для того чтобы проводить обогащение чистым серебром серебросодержащего свинца, используют процесс Паркеса либо Паттисона. Второй способ основывается на охлаждении расплавленного свинца, в котором есть серебро. У металлов разные температуры плавления, поэтому они будут поочередно осаждаться и выделяться из раствора. Оставшуюся жидкость Патиссон предложил подвергать окислению в струе воздуха. Процесс сопровождался образованием оксида двухвалентного свинца, который удаляли, а серебро, остававшееся в расплавленном виде, очищали от примесей.
Еще в Древней Греции применялся метод получения серебра путем купелирования.
Данная технология применяется и в настоящее время в промышленности. Метод основывается на способности расплавленного свинца окисляться кислородом, содержащимся в атмосфере.
Видео:Получение нитрата серебра (химия)Скачать

Хлорид Серебра (свойства реакции применение FAQ)
Хлорид серебра это химическое вещество состоящее из серебра и хлора, сложное вещество, в природе встречается в виде минералов хлораргирит (chlorargyrit) фото, синоним — роговая серебряная обманка.
Основное применение хлорида серебра в производстве некоторых органических веществ, лекарственных препаратов, светочувствительных компонентов и т.д.
Видео:Восстановление хлорида серебраСкачать

Что такое хлорид серебра (AgCl)
Это белый порошок который на свету темнеет становясь серым , при нагревании плавится становясь жёлто — коричневым , при дальнейшем нагревании кипит без разложения.
Не растворим в воде и не образует кристаллогидратов. С концентрированными гидратом аммиака , образуя комплексное соединение.

Температура кипения — 1554°C
Состояние — Твёрдое
Молярная масса — 143,32г/моль
Плотность -5,56
Твёрдость -2,5
Видео:Реакции ионов серебра с 15ю анионами и растворимость осадков/ Reactions of 15 anions with silver(+)Скачать

Получение в лабораторных условиях
Реакцией всех растворимых солей серебра с соляной кислотой :
Реакцией растворимых солей с солями хлоридов :
Нагреванием сульфида серебра с хлоридом натрия в кислороде при нагревании 600°C :
Видео:Хлорид серебра, избежать потери. Как можно повторно использовать реагенты.Скачать

Реакции хлорида серебра
Хлорид серебра обладает слабыми свойствами фотолиза и медленно разлагается на свету на простые вещества серебро и хлор :
При температуре выше 450°C в присутствии щелочей разлагается получением простого вещества серебра , хлорида щелочного металла и кислорода :
4AgCl + 4КОН = 4КСl + 4Ag + O2 + 2Н2O
Нагревание до температуры свыше 850°C приводит к получению свободного вещества серебра , хлорида натрия , углекислого газа и кислорода :

4AgCl + 2BaO = 2BaCl2 + 4Ag + O2
Реакция с перекисью водорода , гидроксида калия ( разб . ) даёт свободное вещество серебро , хлорид калия и кислород :
С сульфидом натрия натрия при нагревании , получается сульфид серебра и хлорид натрия :
Фтор будучи более сильным галогеном чем хлор вытесняет его , образуя фторид серебра и хлор :

Соединение аммиакат серебра с ацетиленом дает стабильный ацетиленид серебра, который считается инициирующим взрывчатым веществом и работа с ним очень опасна так как ацетиленид легко детонирует от трения, удара и нагрева:
Единственный способ утилизации его реакция с серной кислотой.
Подобно ( нашатырному спирту ) реагирует с карбонатом аммония образуя комплексного соединения и углекислого газа :
Реакция с тиосульфатом натрия ( конц .) даёт комплексное соединение бис(тиосульфато)аргентат(I) и хлорид натрия :
Хлорид серебра реагирует солями цианидов ( конц .) образуя комплексные соединения и хлорид калия :
AgCl + 2KCN = K[Ag(CN)2] + KCl
Реакция с (тиоцианидом, роданидом, сульфоцианидом) калия даёт сложное комплексное соединение при комнатной температуре и хлорид калия :
Видео:Взаимодействие хлорида бария и нитрата серебра.Скачать

Минерал хлорид серебра
Это минерал хлораргирит химический состав: Ag — 75,3%, Сl — 24,7%. В качестве примесей иногда присутствует Hg (Br, Cl).
В свежих образцах бесцветный, прибывание на свету окрашивает его вначале фиолетово-серый, а потом даже черный цвет.
Образуется в зоне окисления серебросодержащих месторождений, где ассоциирует с минералами серебра, меди, кальцитом, баритом и др.
Используется как руда в получении серебра и иногда как сопутствующие с ним вещества ртуть и бром.
Видео:разные способы восстановления после хлорида серебраСкачать

Применение хлорида серебра
- В фотографической промышленности для получения светочувствительных компонентов.
- В производстве некоторых косметических средств на основе ионов серебра , борющихся с проблемной кожей в основном у молодёжи.
- Хлорид серебра используется в производстве лекарственных препараторов .
- В гомеопатии используется как материал с антибактериальными свойствами .
- Использование в производстве материала для линз в ИК — спектроскопии .
- Как промежуточный продукт в производстве серебра из руд содержащих сульфид серебра Ag2S .
- Применяется в производстве серебро органических соединений, например ацетиленид серебра и т.д.
Видео:самый простой и быстрый метод аффинажа тех. серебра! Метод Соды! Как очистить техническое серебро.Скачать

Что мы узнали о хлориде серебра?
- Что такое хлорид серебра
Это химическое соединение в состав которого входит серебро и хлор.
Какого цвета осадок хлорида серебра
Хлорид серебра (I) в расплавленном виде, имеет желто–коричневый цвет. Расплав хлорида серебра (I) после остывания, образует полупрозрачную массу, которая в обиходной речи, иногда называется как — «роговое серебро».
Как из AgCl получить серебро
Для этого нужно прореагировать его с перекисью водорода в присутствии гидроксида калия.
Есть минерал в состав которого входит хлорид серебра
Это минерал называется хлораргирит, в его химическую формулу могут входить и другие химические элементы такие как ртуть и бром
Статья на тему хлорид серебра
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Видео:ПОЛУЧЕНИЕ СЕРЕБРА. Выпадение Серебра С Помощью Окислительно-Восстановительной РеакцииСкачать

Хлорид серебра I
| Хлорид серебра I | ||
|---|---|---|
| ||
| Систематическое наименование | Хлорид серебра I | |
| Традиционные названия | Хлорид серебра | |
| Хим. формула | AgCl | |
| Рац. формула | AgCl | |
| Состояние | твёрдое | |
| Молярная масса | 143,32 г/моль | |
| Плотность | 5,56 | |
| Твёрдость | 2,5 | |
| Температура | ||
| • плавления | 455 | |
| • кипения | 1554 °C | |
| Мол. теплоёмк. | 50,79 Дж/(моль·К) | |
| Энтальпия | ||
| • образования | −127 кДж/моль | |
| Удельная теплота испарения | 1,28⋅10 6 | |
| Удельная теплота плавления | 9,2⋅10 4 | |
| Давление пара | 1 Па , 10 Па , 100 Па , 1 кПа , 10 кПа и 100 кПа | |
| Растворимость | ||
| • в воде | 1,91⋅10 −5 г/100 мл | |
| • в этаноле | 1,5·10 −5 г/л | |
| • в метаноле | 6·10 −5 г/л | |
| • в ацетоне | 1,3·10 −5 г/л | |
| • в пиридине | 19,5 г/л | |
| Показатель преломления | 2,071 | |
| Дипольный момент | 6,08 ± 0,06 Д | |
| Рег. номер CAS | 7783-90-6 | |
| PubChem | 24561 | |
| Рег. номер EINECS | 232-033-3 | |
| SMILES | ||
| RTECS | VW3563000 | |
| ChEBI | 30341 | |
| ChemSpider | 22967 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Хлорид серебра I (хлористое серебро) — AgCl, неорганическое бинарное соединение серебра с хлором, серебряная соль хлороводородной (соляной) кислоты. В нормальных условиях представляет собой белый порошок или бесцветные кристаллы. Встречается в природе в виде минерала хлораргирита.
Видео:АФФИНАЖ СЕРЕБРА НОВЫМ МЕТОДОМ! Минуя ХЛОРИД СЕРЕБРА.. АЛЮМИНИЙ, МЕДЬ и ПРОЧЕЕ..!Скачать

Содержание
- 1 Молекулярная и кристаллическая структура
- 2 Физические свойства
- 3 Получение
- 4 Химические свойства
- 5 Применение
- 6 Безопасность
Видео:Взаимодействие нитрата серебра и хлорида натрия. Химический опытСкачать

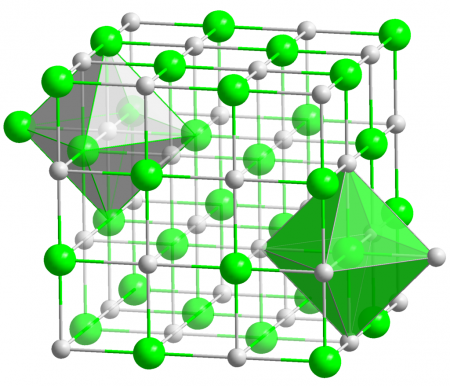
Молекулярная и кристаллическая структура
Хлорид серебра имеет следующий элементный состав: Ag (75,26 %), Cl (24,74 %). Атом серебра в молекуле находится в состоянии sp 3 d 2 -гибридизации. Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм.
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6.
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера.
Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77⋅10 −10 . С повышением температуры растворимость соединения повышается: при 100 °C ПР = 2,81⋅10 −8 . Нерастворим в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
- стандартная энтальпия образования, ΔH°298: −127 кДж/моль;
- стандартная энтропия, S°298: 96 Дж/(моль·K);
- стандартная энергия Гиббса, ΔG°298: −110 кДж/моль.
- стандартная мольная теплоемкость, Cp°298: 50,79 Дж/(моль·K);
- энтальпия плавления, ΔHпл: 13,2 кДж/моль;
- энтальпия кипения, ΔHкип: 184 кДж/моль.
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением:
log10 P = 4,95155 − 8775,980/T−62,718
Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):
Химические свойства
- Разлагается при комнатной температуре под действием света:
2 AgCl = 2 Ag + Cl2
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
AgCl + 2 NH3 ⋅ H2O = [Ag(NH3)2]Cl + 2 H2O AgCl + 2 Na2SO3S = Na3[Ag(SO3S)2] + NaCl AgCl + 2 KCN = K[Ag(CN)2] + KCl
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра:
4 AgCl + 2 BaO → >324oC 2 BaCl2 + 4 Ag + O2 2 AgCl + Zn = ZnCl2 + 2 Ag ↓ 2 AgCl + 2 KOH + H2O2 = 2 KCl + 2 Ag ↓ + O2 ↑ + 2 H2O Окислительные свойства хлорида серебра используется для извлечения металла из серебросодержащих отходов: 4 AgCl + 2 Na2CO3 → 850−900oC 4 NaCl + 4 Ag + 2 CO2 + O2 4 AgCl + CH2O + 6 NaOH = 4 Ag ↓ + Na2CO3 + 4 NaCl + 4 H2O
- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
AgCl + Cl − = [AgCl2] −
- Медленно реагирует с концентрированной серной кислотой при кипячении:
2 AgCl + H2SO4 = Ag2SO4 + 2 HCl ↑
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах:
2 AgCl + Ba(NO3)2 → NH 3 BaCl2 ↓ + 2 AgNO3
Применение
- Светочувствительный компонент фотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl − ;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии;
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды:
Ag2S + 2 NaCl + 2 O2 → 600∘C 2 AgCl + Na2SO4
- Реагент для получения сереброорганических соединений:
AgCl + R−MgBr = R−Ag + MgBrCl
- Входит в состав антимикробных композиций на основе ионов серебра.
Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.