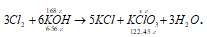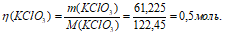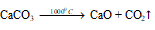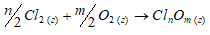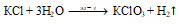Хлорид калия KCl — соль щелочного металла калия и хлороводородной кислоты. Белое вещество, плавится и кипит без разложения. Умеренно растворяется в воде.
Относительная молекулярная масса Mr = 74,55; относительная плотность для тв. и ж. состояния d = 1, 984; tпл = 770º C; tкип = 1430º C;
- Способ получения
- Качественная реакция
- Химические свойства
- Лабораторный и промышленный способы получения хлората калия. Получение хлорной извести
- Получение калия: способы, реакция, формулы, виды калия и его химические свойства
- Общая характеристика
- Применение
- Получение металла
- Получение исходных веществ
- Получение производных
- Нитрат калия
- Сульфат калия
- Карбонат калия
- Перманганат калия
- Гидроксид калия
- 📺 Видео
Видео:Самый *ПРОСТОЙ* способ ПОЛУЧИТЬ ГИДРОКСИД КАЛИЯСкачать

Способ получения
1. Хлорид калия можно получить путем взаимодействия калия и разбавленной хлороводородной кислоты, образуются хлорид калия и газ водород:
2K + 2HCl = 2KCl + H2↑.
2. При комнатной температуре, в результате взаимодействия калия и хлора, образуется хлорид калия:
2K + Cl2 = 2KCl
3. Концентрированный раствор гидроксида калия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид калия, газ аммиак и вода:
4. Разбавленная хлороводородная кислота реагирует с гидроксидом калия . Взаимодействие хлороводородной кислоты с гидроксидом калия приводит к образованию хлорида калия и воды:
KOH + HCl = KCl + H2O
5. В результате взаимодействия сульфата калия и хлорида бария образуется сульфат бария и хлорид калия:
6. Карбонат калия взаимодействует с разбавленной соляной кислотой , образуя хлорид калия, углекислый газ и воду:
Видео:Кристаллы из хлорида калияСкачать

Качественная реакция
Качественная реакция на хлорид калия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид калия образует нитрат калия и осадок хлорид серебра:
KCl + AgNO3 = KNO3 + AgCl↓
Видео:Получение хлорида калия (synthesis of potassium chloride) KClСкачать

Химические свойства
1. Хлорид калия вступает в реакцию со многими сложными веществами :
1.1. Хлорид калия взаимодействует с кислотами :
Хлорид калия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата калия и газа хлороводорода:
1.2. Хлорид калия способен вступать в реакцию с многими солями :
1.2.1. Твердый хлорид калия реагирует с концентрированной и горячей серной кислотой и твердым перманганатом калия . Взаимодействие хлорида калия с перманганатом калия и серной кислотой приводит к образованию сульфата марганца, сульфата калия, газа хлора и воды:
1.2.2. Хлорид калия взаимодействует с гидросульфатом калия при температуре 450–700º C . При этом образуются сульфат калия и хлороводородная кислота:
1.2.3. При взаимодействии концентрированного раствора хлорида калия и насыщенного перхлората натрия выделяются перхлорат калия и хлорид натрия:
KCl + NaClO4 = KClO4↓ + NaCl
Видео:Хлористый калий - калийная соль? Как получают?Скачать

Лабораторный и промышленный способы получения хлората калия. Получение хлорной извести
Задача 827.
Рассчитать, какое количество бертолетовой соли можно получить из 168 г гидроксида калия.
Решение:
М(КОН) = 56 г/моль, m(KOH) = 6 . 56 = 336 г;
М(KClO3) = 122,45 г/моль, m(KClO3) = 122,45 г.
Уравнение реакции имеет вид:
Находим массу бертолетовой соли из пропорции:
168 : 336 = х : 122,45; х = (168 . 122,45)/336 = 61,225 г.
Количество бертолетовой соли рассчитаем из уравнения:
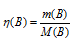
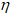
m(B) — масса вещества, г;
M(B) — молярная масса вещества (В), г/моль.
Ответ: m(KClO3) = 61,225 г; М(KClO3) = 0,5 моль.
Задача 828.
Как получить хлорную известь, исходя из карбоната кальция, хлорида натрия и воды? Написать уравнения процессов, которые необходимо для этого осуществить. Какие при этом получаются побочные продукты?
Решение:
Получение хлорной извести, исходя из карбоната кальция, хлорида натрия и воды.
а) При нагревании в 1000 0 С карбонат кальция разлагается на оксид кальция и углекислый газ:
б) Оксид кальция, растворяясь в воде, образует гидроксид кальция:
в) Электролизом водного раствора хлорида натрия можно получить хлор, который выделяется у анода:
у катода: 2Н2О + 2 
у анода: 2Cl — +2 
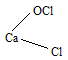
г) При действии хлора на гашеную известь получается так называемая белильная (или хлорная) известь и вода:
CaOCl2 соответствует структурная формула:
Хлорная известь применяется для отбелки растительных волокон (тканей, бумаги) и для дезинфекции.
Задача 829.
Обосновать невозможность получения оксидов хлора непосредственным взаимодействием хлора с кислородом.
Решение:
Хлор непосредственно не взаимодействует с кислородом. Это обусловлено небольшой энергией связи Cl—O и невозможностью использования высоких температур для осуществления реакций:
Для них 



2Cl2(г) + О2(г) → 2Cl2O; 
Из данного уравнения реакции видно, что процесс идёт с поглощением теплоты. Так как 

Исходя из уравнения:



При положительном значении дельта 






Задача 830.
Указать лабораторный и промышленный способы получения хлората калия.
Решение:
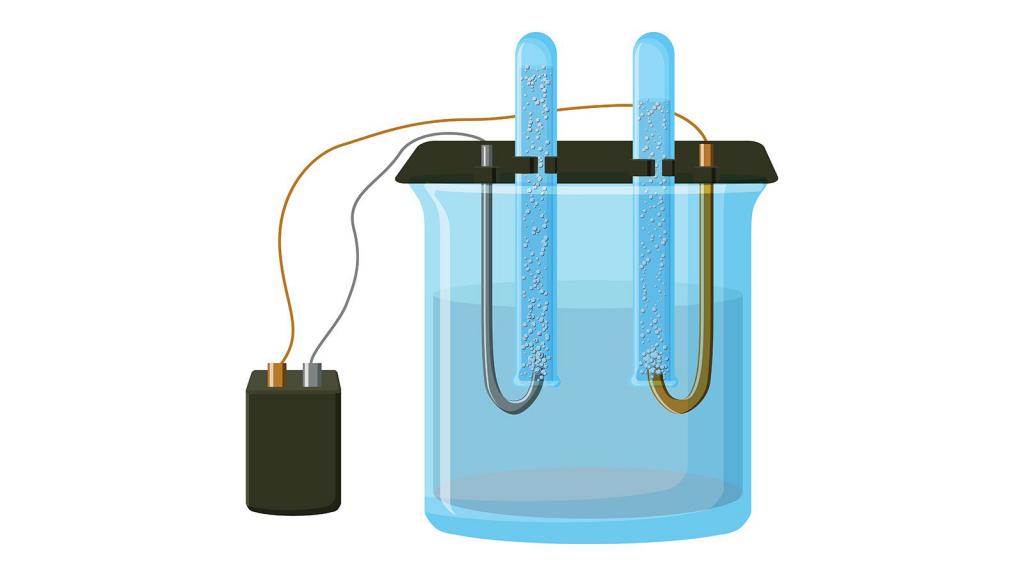
а) В лаборатории хлорат калия получают электролизом горячего раствора КCl:
При охлаждении раствора хлорат калия выпадает в осадок, так как мало растворим в холодной воде.
б) В промышленности хлорат калия получают пропусканием хлора в горячий раствор гидроксида калия:
3Cl2 + 6KOH 
Поскольку хлорат калия (или бертолетовая соль) мало растворим в холодной воде, то при охлаждении раствора он выпадает в осадок.
Видео:Калий хлористыйСкачать

Получение калия: способы, реакция, формулы, виды калия и его химические свойства
Калий (К) – это пятый по распространенности в природе металл. Он расположен в 1 группе периодической системы химических элементов (ПСХЭ), поэтому относится к щелочным металлам и при смешивании с водой образует растворимые гидроксиды. В виде простого вещества элемент имеет серебристо-белый цвет, иногда с фиолетовым оттенком. По характеристикам он мягкий и низкоплавкий. Получение калия возможно из его гидрида, гидроксида, хлорида, хромата или дихромата.
Видео:Получение хлората калия, бертолетовой соли из отбеливателя (химия)Скачать

Общая характеристика
При превращении калия в пар сине-зеленого цвета он разлагается на атомы К, к которым примешивается небольшое количество молекул К2. Растворить металл можно в жидком аммиаке с получением стандартного темно-синего раствора либо в расплаве едкого кали.
Калий имеет высокую реакционную способность, обладает сильными восстановительными свойствами (его внешняя электронная оболочка находится на большом удалении от ядра, а в таблице электроотрицательности он занимает вторую позицию после цезия), реагирует не только с разбавленными кислотами, неметаллами, нитритом водорода и дигидросульфидом, но и с кислородом воздуха и водой. В последнем случае выделяющийся водород быстро воспламеняется.
Со ртутью элемент превращается в сплав – амальгаму. С натрием, таллием, оловом, свинцом и висмутом у калия образуются интерметаллиды, обладающие высокой твердостью и химической стойкостью. Химическое соединение нескольких металлов плавится при более высокой температуре, чем каждый из образующих его компонентов, но имеет меньшую пластичность по сравнению с ними.
Однако есть вещества, с которыми элемент практически не вступает в реакцию, например, к таким относится азот. Это одна из отличительных особенностей калия от других щелочных металлов, в первую очередь, лития и натрия. Кроме того, он не сплавляется с литием, магнием, цинком, кадмием, алюминием и галлием.
Калий хорошо сохраняется под слоем бензина и керосина. Определить его можно по окрашиванию пламени горелки в фиолетовый цвет.
Видео:Синтез хлората калия или бертолетовой солиСкачать

Применение
Калий играет важную биологическую роль в организме человека и развитии растений. Кроме того, он широко используется в повседневной жизни. Так, в комплексе с азотом и фосфором он является незаменимым удобрением для культурных растений, позволяющим повысить их урожайность, вегетативную массу и устойчивость к вредителям.
Сплав металла с натрием применяется для передачи тепловой энергии в замкнутых системах, а если к этому соединению добавить цезий, получится состав с рекордно низкой температурой плавления (минус 78 градусов Цельсия).
Для того чтобы использовать все эти полезные и важные соединения, нужно знать реакции получения калия из его соединений.
Видео:Перекристаллизация, или очистка хлорида калия! [ChemistryToday]Скачать
![Перекристаллизация, или очистка хлорида калия! [ChemistryToday]](https://i.ytimg.com/vi/naxeGRmhnSI/0.jpg)
Получение металла
Неорганическое соединение белого цвета, гидрид калия, образуется из расплавленного металла, но оно нестабильно и при температуре в 400 градусов Цельсия в вакууме распадается на составляющие по следующей реакции:
Гидроксид калия образуется из соответствующего хлорида. Он широко применяется в производстве жидких мыл и для получения калия и его соединений. Для этого нужно провести электролиз, то есть пропустить через раствор ток. В результате на аноде образуется кислород, а на катоде калий:
Из хлорида можно получать не только гидроксид, но и металл в чистом виде. Для этого также потребуется реакция электролиза раствора:
В отличие от предыдущего способа получения калия, в этом можно использовать исходное вещество не только в жидком состоянии, но и в виде расплава, но в этом случае происходят две параллельные реакции:
Катод, на котором будет образовываться калий, должен быть ртутным.
Видео:🔥 ПОЛУЧЕНИЕ КАЛИЯ И НАТРИЯ В ДОМАШНИХ УСЛОВИЯХ своими рукамиСкачать

Получение исходных веществ
Иногда применяются хромат или дихромат калия. Напрямую металл из них не получить, но можно преобразовать их в гидроксиды или хлориды, которые впоследствии подвергнуть электролизу по приведенным выше реакциям. Получение гидроксида калия из хромата происходит так:
- 2K2CrO4 + 2Н2О + 3Н2S = 2Cr(ОН)3 + 3S + 4КОН.
Чтобы процесс прошел успешно, сера и гидроксид хрома выпали в осадок, нужно брать горячую воду. Подобную реакцию можно также провести с помощью дихромата. Она протекает аналогичным образом, различие наблюдается только в значениях стехиометрических коэффициентов:
При нагревании дихромата до 500 градусов Цельсия гидроксид можно получить другим способом:
Есть и другие способы получения гидроксида. Например, с помощью реакции между поташом и насыщенным раствором гашеной извести.
Для получения хлорида калия из хромата реакции проводятся таким образом:
Соляная кислота берется в разбавленном виде. Получение калия хлора сопровождается выделением дихромата и воды.
Превратить дихромат в хлорид немного более сложно, для этого понадобится этиловый спирт и кипячение:
Получение калия хлора также возможно из поташа при взаимодействии с разбавленной соляной кислотой и из сульфата при реакциях с галогенидом бария.
Гидроксид и хлорид легко преобразуются друг в друга с помощью электролиза или при добавлении соответствующего галогенида.
Видео:Взаимодействие хлорида железа III с роданидом калияСкачать

Получение производных
Получение солей калия играет не менее важную роль, чем образование чистого металла. Несмотря на высокую стоимость, они используются в гальванотехнике, так как обеспечивают интенсивную работу электролитов при повышенной плотности тока. Это достигается за счет высокой растворимости.
Видео:Решаем два варианта Добротина за 2 часаСкачать

Нитрат калия
Большое значение имеет получение нитрата калия (KNO3). Эта белая соль, называемая индийской селитрой, практически не токсична для живых организмов. Применяется и в мирных целях в качестве удобрения, и в военных как компонент взрывчатых и горючих веществ. Кроме того, получение нитрата калия нужно для обесцвечивания и улучшения прочностных характеристик хрустальных стекол, что широко используется в вакуумной электропромышленности и оптическом стекловарении. В металлургии полезны ее окислительные свойства в отношении никелевых и иных руд. А в пищевой промышленности соль выступает в качестве консерванта.
Для получения раствора нитрата калия можно воспользоваться следующими веществами:
- надпероксидом металла при добавлении к нему оксида азота (IV) и нагревании до 70 градусов Цельсия;
- гидроксидом и разбавленной азотной кислотой;
- гидроксидом в холодном состоянии и смесью оксидов азота (II) и (IV);
- горячим гидроксидом, оксидом азота (IV) и кислородом;
- горячим разбавленным нитритом калия и кислородом (реакция требует времени);
- нитритом калия и горячей перекисью водорода в разбавленной серной кислоте в качестве катализатора (кислоту можно заменить бромом, но он вступит в реакцию с образованием бромоводорода).
Полученное соединение плавится без разложения, устойчиво на воздухе, растворяется в воде без гидролиза, обладает сильными окислительными свойствами, восстанавливается только атомным водородом.
Видео:Удобрение хлористый калий: плюсы и минусы. Как и когда вносить.Скачать

Сульфат калия
Соль, известная еще с XIV века, получила название сульфата калия (K2SO4) лишь в XVII. Она присутствует в водах соленых озер и месторождениях неметаллических минеральных ресурсов, но возможно получение сульфата калия в процессе синтеза следующих веществ:
- надпероксида калия и серы при 130-140 градусах Цельсия (вместо серы можно использовать ее оксид (IV), тогда будет достаточно температуры в 100 градусов);
- гидроксида калия и разбавленной серной кислоты;
- гидросульфата калия (разложением при 240 градусах);
- гидросульфата калия и концентрированного каустического поташа или хлорида этого же металла;
- хлорида калия и концентрированной серной кислоты при кипячении;
- сульфида калия и кислорода при температуре выше 500 градусов;
- разложением дисульфата калия при температуре выше 440 градусов и использовании оксида серы (IV) и кислорода в качестве катализаторов.
Другое название получаемого вещества – арканит. Оно имеет белый цвет, устойчиво к температурному воздействию, но легко растворяется в воде без кристаллогидратов. Для него характерно участие в обменных реакциях, восстановление водородом и углеродом.
На практике оно активно используется в сельском хозяйстве как бесхлорное удобрение для бедных калием почв. Особенно важен арканит для культур, чувствительных к хлору или потребляющих много серы. Урожай, выращенный с его применением, содержит большее количество сахара и витаминов, чем тот, который не удобрялся. Также удобрение используют для цветов, выращиваемых и на открытом воздухе, и в тепличных условиях.
Другое применение арканита – компонент при производстве стекла, квасцов, металлургических плавней. Он выступает и в качестве пищевой добавки, но само по себе вещество сложно назвать безопасным: оно раздражает глаза, кожу, желудочно-кишечный тракт, дыхательные пути и приводит к отравлению при длительном контакте с различными частями тела и организма.
Видео:Получил ХЛОРАТ калия из поваренной солиСкачать

Карбонат калия
Поташ или углекислый калий (К2СО3) был известен еще в древности и сохранял важное промышленное значение вплоть до ХХ века. Получение карбоната калия происходило путем выщелачивания из растительной золы и последующей очисткой продукта. В основном производство локализовалось в лесистой местности Европы, России и Северной Америки.
Сейчас известно больше реакций, в результате которых получается карбонат. Обычно используются следующие вещества:
- надпероксид калия и графит при небольшом нагревании до 30 градусов (вместо графита может быть использован угарный газ с нагреванием до 50 градусов);
- концентрированный гидроксид калия и углекислый газ;
- разложение гидрокарбоната калия при температуре от 100 до 400 градусов;
- гидрокарбонат и концентрированный гидроксид калия;
- сульфат калия, гидроксид кальция и угарный газ при температуре 200 градусов и под давлением, с последующим синтезом получившегося продукта К(НСОО) с кислородом при 700 градусах.
Получаемое белое вещество плавится без разложения, в воде сильно гидролизуется по аниону, создает сильнощелочную среду, реагирует с кислотами, неметаллами и их оксидами, а также вступает в реакции обмена.
Вещество малотоксичное и используется для производства жидкого мыла, пигментов, стекла, соединений калия. Применяется в крашении, выращивании сельскохозяйственных культур, проявлении фотографий. Кроме того, является популярной добавкой, уменьшающей температуру замерзания бетона, поглотителем сероводорода, обезвоживающим агентом, пищевой добавкой.
Видео:Получение Нитрат калия. KNO3. Калиевая силитра. Удобрение.Скачать

Перманганат калия
Красно-фиолетовая, почти черная марганцовка известна всем, так как ее можно увидеть практически в каждом доме. Хотя в последнее время существуют небольшие ограничения на покупку вещества из-за того, что его признали прекурсором. Получение перманганата калия (KMnO4) возможно несколькими способами, например, взаимодействием сульфата марганца (II) с водой и кислородом из дитионата калия. По прошествии некоторого времени при наличии нитрата серебра в качестве катализатора из этой смеси получится перманганат и сульфат калия, а также серная кислота.
Еще больше способов предполагает использование манганата калия, к нему можно добавлять следующие вещества:
- воду (реакция требует затрат времени);
- разбавленную соляную кислоту;
- углекислый газ;
- хлор.
Кроме того, манганат можно подвергать электролизу с образованием перманганата на аноде (на катоде будет водород).
Применение у получившегося вещества широкое. Благодаря окисляющей способности оно обеспечивает антисептическое действие. В медицине оно применяется для полоскания горла при воспалительных заболеваниях его слизистой, промывания ран, обработки ожогов и инфицированных ран, лечения язв, а также как рвотное средство при отравлениях алкалоидами.
Противопоказанием является гиперчувствительность, но передозировка может привести к летальному исходу даже у здорового человека, смертельная доза для среднего человека составляет всего 20-30 г.
При использовании перманганата нужно соблюдать меры предосторожности, так, вещество воспламеняется при смешивании с органическими и легковоспламеняющимися соединениями, активными металлами и неметаллами. При дополнительном нагревании возможен взрыв.
Видео:Получение гидроксида калия электролизомСкачать

Гидроксид калия
Помимо солей, большое значение имеет гидроксид калия. Это вещество относится к щелочам, то есть веществам, растворы и расплавы которых могут проводить электрический ток.
Тривиальное название этого соединения — каустический поташ. Выглядит оно как белое гигроскопичное вещество. К его свойствам относятся плавление и кипение без разложения, хорошая растворимость в воде с образованием сильнощелочной среды, нейтрализация кислотами, реакционная способность в отношении металлов и неметаллов, их оксидов и гидроксидов. Из воздуха гидроксид калия активно поглощает воду и углекислый газ.
Как получение калия возможно из щелочи, так и гидроксид можно получить из металла. Для этого требуется лишь добавить к нему воду в чистом виде или в сочетании с кислородом. Кроме того, можно получать щелочь из карбоната и насыщенного гидроксида кальция либо электролизом хлорида. Последний способ активно используется в промышленном производстве.
Вещество опасно, может прижечь кожу или слизистые, разрушает все материалы органического происхождения. Работать с ним можно, только надежно защитив кожные покровы перчатками, а глаза очками.
Несмотря на опасность, щелочь имеет широкое применение в фотографии, нефтепереработке, пищевом, бумажном и металлургическом производстве, а также как щелочной элемент питания, нейтрализатор кислот, катализатор, газоочиститель, регулятор водородного показателя, электролит, компонент моющих средств, буровых растворов, красителей, удобрений, калийных органических и неорганических веществ, пестицидов, фармацевтических препаратов для лечения бородавок, мыла, синтетического каучука.
Таким образом, получение калия и соединений на его основе, в первую очередь, солей и гидроксида, имеет большое значение для промышленности и широкое применение в быту. Главное, помнить о технике безопасности при работе с этим щелочным металлом и осторожно применять материалы, в которых он используется. Благодаря этому можно будет избежать тех его свойств, которые являются опасными.
📺 Видео
Цианистый Калий. Самый известный ЯД и как пахнет синильная кислота.Скачать

Калий и Калийные удобренияСкачать

Качественная реакция на ион трехвалентного железаСкачать

Равновесие в растворе роданида железаСкачать

Хлорат калия (Электролиз)Скачать