Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение метанола
- Водородные связи и физические свойства метанола
- Изомерия метанола
- Химические свойства метанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.2. Межмолекулярная дегидратация
- 4. Окисление метанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение метанола
- 5. Дегидрирование спиртов
- Получение метанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Промышленное получение метанола из «синтез-газа»
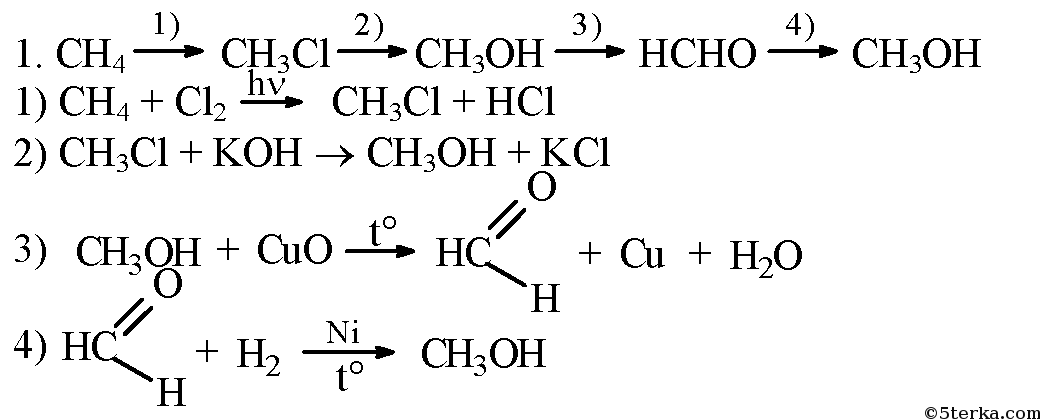
- 3. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: метан → хлорметан метанол → формальдегид → метанол.
- 3. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: метан → хлорметан метанол → формальдегид → метанол.
- Химические свойства и способы получения муравьиного альдегида
- Реакции присоединения
- Реакции окисления
- Реакции полимеризации
- Получение формальдегида:
- Промышленные методы получения формальдегида
- Лабораторные способы получения формальдегида
- 🎥 Видео
Видео:Как получить ФОРМАЛЬДЕГИД из УРОТРОПИНА?Скачать

Строение метанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5 о С).
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Метанол смешивается с водой в любых соотношениях.
Видео:Получение метанолаСкачать

Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Видео:Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
| Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, метанол взаимодействует с калием с образованием метилата калия и водорода . |
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, метилат калия разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
Видео:метанолСкачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, метанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии метанола с аммиаком образуется метиламин. |
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, метанол взаимодействует с азотной кислотой : |
Видео:7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140 о С образуется диметиловый эфир: |
Видео:Перегонка метанолаСкачать

4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
Видео:Метанол - Мировая революция (Док. фильм) / RUSСкачать

5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
Видео:Изопропанол или метанол в омывайке?Скачать

Получение метанола
Видео:Получение МЕТАНОЛАСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
Видео:Несколько лайфхаков со спиртом. Химия – просто.Скачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
Видео:ВСЯ ТЕОРИЯ ПО АЛЬДЕГИДАМ ДЛЯ ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании формальдегида образуется метанол |
CH2=O + H2 → CH3-OH
Видео:Метанол убивает. Запомните, как именно он разрушает организм. #нашпотребнадзорСкачать

4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
Видео:Можно ли отличить опасный для здоровья метанол от этилового спиртаСкачать

3. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: метан → хлорметан метанол → формальдегид → метанол.
Видео:Моделирование установки получения формальдегида в AspenHysys V10Скачать

3. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: метан → хлорметан метанол → формальдегид → метанол.

задача №3
к главе «Тема VII(VI). Альдегиды, кетоны и карбоновые кислоты. Работа 6. Итоговая по темам V, VI (VI, VII). Вариант 2».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Видео:Способы получения предельных одноатомных спиртовСкачать

Химические свойства и способы получения муравьиного альдегида
Задача 4.
Опишите химические свойства муравьиного альдегида. Приведите промышленные и лабораторные способы получения этого соединения.
Решение:
Атом углерода в карбонильной группе находится в состоянии sp 2 -гибридизации и образует 3 сигма-связи (две связи С-Н и одну связь С-О). Сигма-связь образована р-электронами атомов углерода и кислорода. Двойная связь С = О является сочетанием пи- и сигма-связей. Электронная плотность смещена в сторону атома кислорода.
В молекулах альдегидов имеется несколько реакционных центров: электрофильный центр (карбонильный атом углерода), участвующий в реакциях нуклеофильного присоединения; основный центр – атом кислорода с неподеленными электронными парами; Н-С(О)-Н кислотный центр, отвечающий за реакции конденсации; связь С-Н, разрывающаяся в реакциях окисления.
Реакции присоединения
1. Присоединение водорода (восстановление):
Н-CH=O + H2 (t,Ni) → Н-CH2-OH (метиловый спирт);
2. Присоединение аммиака:
3. Присоединение бисульфита натрия:
4. Присоединение циановодородной кислоты (синильной):
Н-CH=O + H-CN → H-CH(CN)-OH;
5. Присоединение гидразина с образованием гидразона:
6. Присоединение аминов с образованием N-замещенного имина:
7. Присоединение тиола с образованием дитиоацеталя (в кислой среде):
8. Присоединение воды с образованием гем-диола:
Н-CH=O + Н-ОН → Н-CH(OH)-OH.
При действии щелочи на формалин получаются метиловый спирт и муравьиная кислота:
2Н-CH=O + Н-ОН → СН3-ОН + Н-СООН.
В присутствии щелочей в водном растворе может идти и другая реакция: формальдегид конденсируется, причем в числе прочих продуктов получается один из простейших сахаров, или гексоз:
6Н-CH=O → C6H12O6 (Реакция Бутлерова: 2Н-CH → O + RbOH = -CH=O);
9. Присоединение спирта с образованием полуацеталя:
10. При взаимодействии формальдегида с ацетальдегидом в газовой фазе в присутствии катализаторов (окись алюминия, ацетат свинца на силикагеле и др.) образуется акролеин:
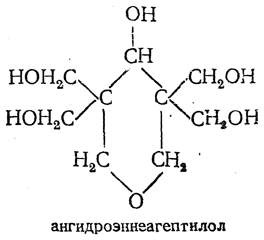
В водном растворе при большом избытке формальдегида под влиянием гидроокиси кальция конденсация с ацетальдегидом приводит к пентаэритриту:
Высшие алифатические альдегиды дают в этих условиях окси-или диоксиальдегиды (в зависимости от числа H-водородных атомов):
Формальдегид при взаимодействии с ацетоном образует ангидроэннеагептилол:
Реакции окисления
1. Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4, K2Cr2O7, [Ag(NH3)2]OH, Cu(OH)2. Все реакции идут при нагревании:
Реакции полимеризации
1. Реакция с фенолом с образованием фенолформальдегидных смол:
Получение формальдегида:
Промышленные методы получения формальдегида
1. Окисление метанола.
Реакция проводится в присутствии серебряного катализатороа и при нагревании (около 650—720 °C) или при 400 °C в присутствиии железо-никилиевых катализаторов:
2. Реакция дегидрирования метанола.
Процесс проводится на цинк-медных катализаторах при 600 °C:
3. Окисление метана.
Реакцию проводят при температуре 450 °C и давлении 1—2 МПа на катализаторе AlPO4.
Лабораторные способы получения формальдегида
1. Восстановление метанола:
Реакцию проводят, опуская раскаленную медную проволоку в пробирку с метанолом, образуется резкий запах альдегида. Если процесс окисления повторить несколько раз, то можно получить значительную концентрацию формальдегида.
2. Реакция метанола с перманганатом калия:
Смесь слабого раствора марганцовки и метанола нагревают до кипения. Появляется запах формальдегида, а фиолетовая окраска перманганата исчезает.
3. Реакция метанола с бихроматом калия:
В насыщенный раствор бихромата калия К2Сг2О7 добавляют такой же объем концентрированной серной кислоты. Затем по каплям вводят метанол. Очень осторожно подогревают смесь (отверстие пробирки направляют в сторону!). Реакция идет с выделением тепла. Желтая окраска хромовой смеси исчезает, и появляется зеленая окраска сульфата хрома.
🎥 Видео
🔥 Как отличить метиловый спирт от этилового🤠Скачать

Все темы из задания №25 | Химия ЕГЭ 2023 | УмскулСкачать

Как получить этиловый спирт?Скачать

САМЫЙ ПОЛНЫЙ РАЗБОР ВАРИАНТА №1 из сборника Добротина | Химия ЕГЭ УМСКУЛСкачать

Как отличить метиловый спирт от этилового? 3 проверенных метода.Скачать