Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

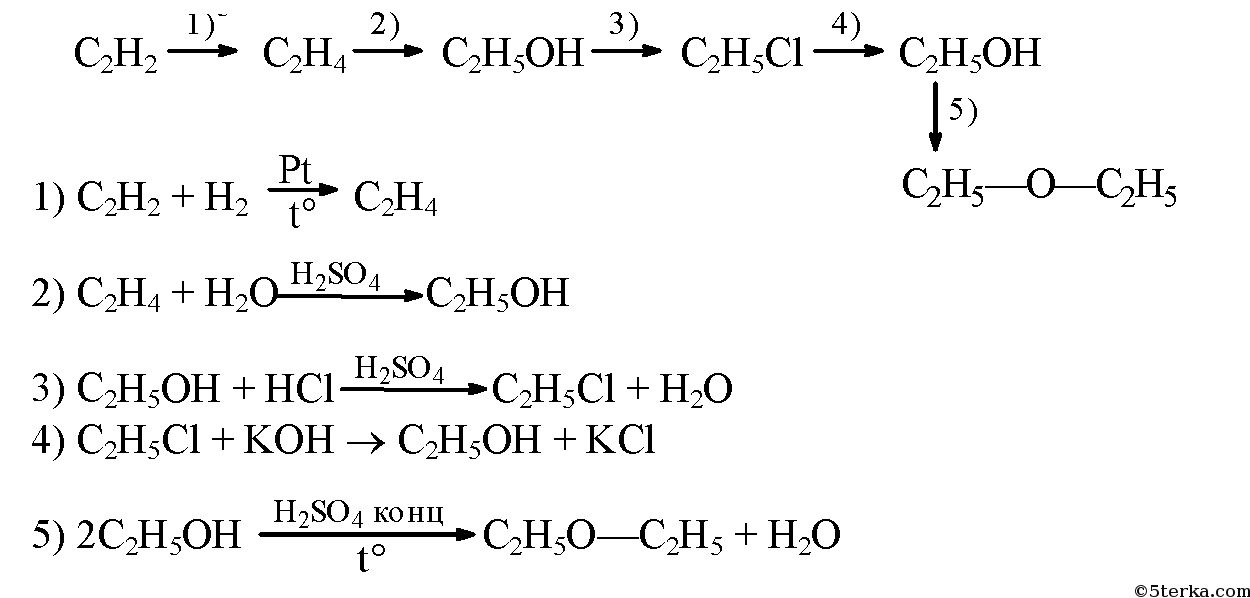
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: ацетилен → этилен → этанол —хлорэтан → этанол → диэтиловый эфир.

задача №3
к главе «Тема VI. Спирты и фенолы. Работа 1 Предельные одноатомные спирты. Вариант 4».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Видео:Этилен и ацетилен, как представители ненасыщенных углеводородов. Химия 9 классСкачать

ПОЛУЧЕНИЕ ЭТИЛЕНА И АЦЕТИЛЕНА
И ИЗУЧЕНИЕ ИХ СВОЙСТВ
Теоретическая часть
Алкенами называются ненасыщенные углеводороды, молекулы которых содержат одну двойную связь. Простейшим представителем алкенов является этилен СН2=СН2.
Этилен — бесцветный газ, почти без запаха, немного легче воздуха, плохо растворим в воде.
1. Этилен в лаборатории получают при нагревании смеси этилового спирта с концентрированной серной кислотой:
2. Углеводороды ряда этилена можно получить также дегидрированием предельных углеводородов:
3. На производстве этилен получают из природного газа и при процессах пиролиза нефти.
4. Углеводороды ряда этилена можно получить при взаимодействии дигалогенопроизводных предельных углеводородов с металлами:
5. При действии спиртовых растворов щелочей на галогенопроизводные отщепляется галогеноводород и образуется углеводород с двойной связью:
Химические свойства этилена и его гомологов в основном определяются наличием в их молекулах двойной связи. Для них характерны реакции присоединения, окисления и полимеризации.
1. Реакции присоединения.
o Этилен и его гомологи взаимодействуют с галогенами. Так, например, они обесцвечивают бромную воду:
H2C = CH2 + Br2 → CН2Br — CH2Br
o Аналогично происходит присоединение водорода (гидрирование этилена и его гомологов):
o В присутствии серной или ортофосфорной кислоты и других катализаторов этилен присоединяет воду (реакция гидратации). Этой реакцией пользуются для получения этилового спирта в промышленности:
o Этилен и его гомологи присоединяют также галогеноводороды. Пропилен и последующие углеводороды ряда этилена реагируют с галогеноводородами согласно правилу В.В.Марковникова.
Водород присоединяется к наиболее, а атом галогена — к наименее гидрированному атому углерода:
H2C = CH2 + НBr → CН3 – CH2Br
2. Реакции окисления.
o Этилен и его гомологи способны гореть на воздухе. С воздухом этилен и его газообразные гомологи образуют взрывчатые смеси:
o Этилен и его гомологи легко окисляются, например кислородом перманганата калия; при этом раствор последнего обесцвечивается:
3. Реакции полимеризации.
При повышенной температуре, давлении и в присутствии катализаторов молекулы этилена соединяются друг с другом вследствие развала двойной связи:

Процесс соединения многих одинаковых молекул в более крупные называется реакцией полимеризации.
Алкинами называются ненасыщенные углеводороды, молекулы которых содержат одну тройную связь. Простейшим представителем алкинов является этин (ацетилен) СН≡СН.
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше — в органических растворителях. Плохо растворимы в воде.
Способы получения алкинов.
1. Пиролиз метана.
2. Карбидный способ.
а) СаО + 3С → СаС2 + СО
3. Дегидрогалогенирование дигалойдных углеводородов спиртовыми растворами щелочей.
СН3 – СН(Вr) – СН2Br + 2КОН → СН3 – С ≡ СН + 2КВr + 2Н2О
4. Каталитическое дегидрирование этиленовых углеводородов.
1. Реакции присоединения.
a. Ацетилен и его гомологи взаимодействуют с галогенами. Так, например, они обесцвечивают бромную воду:
HC ≡ CH + 2Br2 → CНBr2 — CHBr2
b. Аналогично происходит присоединение водорода (гидрирование этина и его гомологов):
c. Этин и его гомологи присоединяют также галогеноводороды. Пропин и последующие углеводороды ряда этина реагируют с галогеноводородами согласно правилу В.В.Марковникова.
Водород присоединяется к наиболее, а атом галогена — к наименее гидрированному атому углерода:
C2H2 + 2НBr → C2H4Br2
2. Реакции окисления.
a. Этин и его гомологи способны гореть на воздухе. С воздухом этин и его газообразные гомологи горят бледно-голубым пламенем:
b. Этилен и его гомологи легко окисляются, например кислородом перманганата калия; при этом раствор последнего обесцвечивается:
Экспериментальная часть
ЦЕЛЬ РАБОТЫ: получить и изучить свойства этилена и ацетилена.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками, пробка с газоотводной трубкой, спиртовка, держатель для пробирок, этиловый спирт, концентрированная серная кислота, бромная вода, раствор перманганата калия, карбид кальция.
ОПЫТ 1. ПОЛУЧЕНИЕ ЭТИЛЕНА И ЕГО ГОРЕНИЕ.
В пробирку налейте 2-3 мл этилового спирта и осторожно добавьте 6-9 мл концентрированной серной кислоты и несколько крупинок песка. Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте. Подожгите выделяющийся газ.
Какой газ выделяется при нагревании смеси этилового спирта с серной кислотой? Почему этилен горит более светящимся пламенем, чем метан? Напишите уравнение реакции.
ОПЫТ 2. ВЗАИМОДЕЙСТВИЕ ЭТИЛЕНА С БРОМНОЙ ВОДОЙ.
В другую пробирку налейте 2-3 мл бромной воды. Не прекращая нагревания пробирки со смесью спирта и серной кислоты, опустите конец газоотводной трубки в пробирку с бромной водой и пропустите через нее выделяющийся газ.
Что происходит при пропускании газа через бромную воду? Напишите уравнение реакции.
ОПЫТ 3. ОТНОШЕНИЕ ЭТИЛЕНА К ОКИСЛИТЕЛЯМ.
В третью пробирку налейте 2-3 мл разбавленного раствора перманганата калия. Не прекращая нагревания пробирки со смесью спирта и серной кислоты, опустите конец газоотводной трубки в пробирку с раствором перманганата калия и пропустите через нее выделяющийся газ.
Что происходит при пропускании газа через раствор перманганата калия? Напишите уравнение реакции.
ОПЫТ 4. ПОЛУЧЕНИЕ АЦЕТИЛЕНА И ЕГО ГОРЕНИЕ.
В пробирку поместите маленький кусочек карбида кальция и добавьте 2 капли воды. Закройте пробирку пробкой с газоотводной трубкой. Подожгите выделяющийся газ.
Какой газ выделяется? Почему ацетилен горит более светящимся пламенем, чем метан? Напишите уравнение реакции.
ОПЫТ 5. ВЗАИМОДЕЙСТВИЕ АЦЕТИЛЕНА С БРОМНОЙ ВОДОЙ.
В другую пробирку налейте 2-3 мл бромной воды. В пробирку с карбидом кальция добавьте еще 2 капли воды и закройте ее пробкой с газоотводной трубкой. Опустите конец газоотводной трубки в пробирку с бромной водой и пропустите через нее выделяющийся газ.
Что происходит при пропускании газа через бромную воду? Напишите уравнение реакции.
ОПЫТ 6. ОТНОШЕНИЕ АЦЕТИЛЕНА К ОКИСЛИТЕЛЯМ.
В третью пробирку налейте 2-3 мл разбавленного раствора перманганата калия. В пробирку с карбидом кальция добавьте еще 2 капли воды и закройте ее пробкой с газоотводной трубкой. Опустите конец газоотводной трубки в пробирку с бромной водой и пропустите через нее выделяющийся газ.
Что происходит при пропускании газа через раствор перманганата калия? Напишите уравнение реакции.
Задания.
1. Какие углеводороды называются непредельными?
2. Какие углеводороды называются алкенами и алкинами?
4. Какие типы химических реакций характерны для непредельных углеводородов? Приведите примеры.
5. Какие реакции являются качественными реакциями на непредельные углеводороды?
ЛАБОРАТОРНАЯ РАБОТА № 12
СПИРТЫ
Теоретическая часть
Одноатомные спирты – это производные углеводородов, в которых один атом водорода замещен на гидрокси- группу. Общая формула спиртов – CnH2n+1OH.
Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от одного до одиннадцати атомов углерода, — жидкости. Высшие спирты (начиная с С12Н25ОН) при комнатной температуре — твёрдые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, например октанол уже не смешивается с водой.
1. Самый общий способ получения спиртов, имеющий промышленное значение, — гидратация алкенов. Реакция идет при пропускании алкена с парами воды над фосфорнокислым катализатором:
Из этилена получается этиловый спирт, из пропена — изопропиловый. Присоединение воды идет по правилу Марковникова, поэтому из первичных спиртов по данной реакции можно получить только этиловый спирт.
2. Другой общий способ получения спиртов — гидролиз алкилгалогенидов под действием водных растворов щелочей:
R—Br + NaOH → R—OH + NaBr.
По этой реакции можно получать первичные, вторичные и третичные спирты.
3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичный спирты, при восстановлении кетонов — вторичные:
Реакцию проводят, пропуская смесь паров альдегида или кетона и водорода над никелевым катализатором.
5. Этанол получают при спиртовом брожении глюкозы:
Химические свойства спиртов определяются присутствием в их молекулах гидроксильной группы ОН. Связи С-О и О-Н сильно полярны и способны к разрыву. Различают два основных типа реакций спиртов с участием функциональной группы -ОН:
1) Реакции с разрывом связи О-Н: а) взаимодействие спиртов с щелочными и щелочноземельными металлами с образованием алкоголятов; б) реакции спиртов с органическими и минеральными кислотами с образованием сложных эфиров; в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Скорость реакций, при которых разрывается связь О-Н, уменьшается в ряду: первичные спирты > вторичные > третичные.
2) Реакции сопровождающиеся разрывом связи С-О: а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация): б) замещение группы -ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов. Скорость реакций, при которых разрывается связь С-О, уменьшается в ряду: третичные спирты > вторичные > первичные.
Спирты являются амфотерными соединениями.
Реакции с разрывом связи О-Н.
1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами:
но не реагируют с щелочами. С увеличением длины углеводородного радикала скорость этой реакции замедляется.
В присутствии следов влаги соли спиртов (алкоголяты) разлагаются до исходных спиртов:
Это доказывает, что спирты — более слабые кислоты, чем вода.
2. При действии на спирты минеральных и органических кислот образуются сложные эфиры. Образование сложных эфиров протекает по механизму нуклеофильного присоединения-отщепления:
Отличительной особенностью первой из этих реакций является то, что атом водорода отщепляется от спирта, а группа ОН — от кислоты. (Установлено экспериментально методом «меченых атомов» ).
3. Спирты окисляются под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:
Вторичные спирты окисляются в кетоны. Третичные спирты могут окисляться только с разрывом С-С связей.
Реакции с разрывом связи С-О.
1) Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами. При сильном нагревании происходит внутримолекулярная дегидратация с образованием алкенов:
При более слабом нагревании происходит межмолекулярная дегидратация с образованием простых эфиров:
Видео:Опыты по химии. Получение этилена и опыты с нимСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎥 Видео57. Тримеризация ацетилена получение бензола из ацетиленаСкачать  Взаимодействие этилена с бромной водойСкачать  10 класс - Химия - Алкины. Ацетилен. Состав и строение. ПолучениеСкачать  Реакция этилена с раствором перманганата калияСкачать  Решение задач на термохимические уравнения. 8 класс.Скачать  Получение и изучение свойств этилена. Опыт 2Скачать  Химия с нуля — Химические свойства АлкеновСкачать  Необычное окисление ацетилена #органическаяхимия #ацетиленСкачать  Получение этилена из этилового спиртаСкачать  Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  ЕТИЛЕН І АЦЕТИЛЕНСкачать  Ацетиленовые углеводородыСкачать  Практическая работа "Получение этилена и опыты с ним" 10 классСкачать  53. Химические свойства алкинов на примере ацетиленаСкачать  Алкины. 10 класс.Скачать  Видео №3. Как составить изомерыСкачать  Химия 10 класс (Урок№3 - Непредельные углеводороды – алкены.)Скачать  |