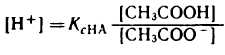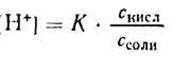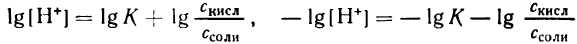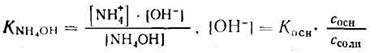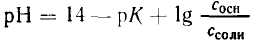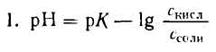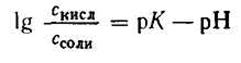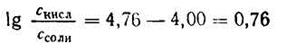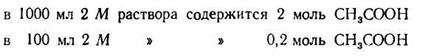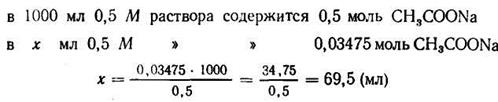1) Аналитическое выражение для расчета рН буферного раствора, например, ацетатного буфера можно получить из уравнения для константы диссоциации (к реакциям диссоциации применим закон действующих масс).
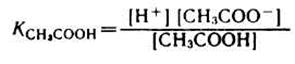
разрешив его относительно концентрации ионов водорода [H + ] можно написать:
Уксусная кислотаприсутствует в растворе в смеси с CH3COONa в виде неионизированных молекул. Поэтому концентрацию молекул можно принять равной общей молярной концентрации кислоты в растворе, т. е. [СН3СООН] = Скисл. Концентрацию анионов уксусной кислоты можно принять равной концентрации соли, т. е. [СН3СОО — ] = Ссоли, так как CH3COONa— сильный электролит, диссоциирующий в растворе на 100%. Приняв эти упрощения, получим:
2. Логарифмируя полученное уравнение и заменяя знаки логарифмов на обратные, получаем:
но – Ig [Н + ] есть рН, а – Ig К есть рК — силовой показатель кислоты.
С учетом этого получим:
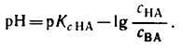
Если при приготовлении буферной системы взять одинаковые концентрации кислоты и соли, то концентрация ионов водорода в таком растворе будет равна константе ионизации кислоты, так как отношение Скис/Ссоли = 1 и [Н + ]=К1, т.е. [Н + ]=К, поэтому рН=рК.
Аналогично для систем NH4OH + NH4C1получают выражения:
1. Запишем уравнение константы ионизации NH4OH и найдем [ОН — ]:
2. Отсюда находим:
Зная, что рН + рОН = 14, получим:
Задача 1. Сколько 0,5 М раствора CH3COONa нужно прибавить к 100 мл 2М раствора СН3СООН, чтобы получить буферный раствор с рН=4?
Откуда
Подставляем числовые данные и получаем:
Число Ig 0,76 = 5,754. Следовательно, отношение концентрации кислоты к концентрации соли должно быть равно 5,754 : 1.
2. Находим концентрацию кислоты в буферной системе:
3. Зная концентрацию кислоты, находим концентрацию солив буферной системе; она должна быть равна 0,2:5,754= 0,03475 (моль).
4. Находим количество 0,5 М раствора ацетата натрия, содержащего 0,03475 моль:
Задача 2.Вычислить рН аммиачной буферной системы, содержащей по 0,5 М NH4ОН и NH4C1. Как изменится рН при добавлении к 1 л этой смеси 0,1 М НС1 и при добавлении к 1 л этой смеси 0,1 М NaOH и при разбавлении раствора водой в 10 раз, если рК (NH4ОН) =4,75?
Дата добавления: 2015-08-08 ; просмотров: 10275 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Буферные системы, ацидоз и алкалоз, ур-ие Гендерсона-Гассельбаха (Атриум и Учим химию)Скачать

Используя уравнение гендерсона гассельбаха вычислить рн буферной системы
а) Уравнение Гендерсона-Хассельбаха. Как уже обсуждалось ранее, концентрацию ионов Н+ принято выражать не в абсолютных величинах, а в единицах рН. Напомним, что значение рН представляет собой значение -lg ионов Н+.
Аналогичным способом может быть выражена константа диссоциации: рК = -log К.
Следовательно, концентрацию ионов Н+ в уравнении 4 можно выразить в единицах pH через отрицательный логарифм:
Чтобы не производить вычисления с отрицательным логарифмом, можно изменить его знак, поменяв местами числитель и знаменатель дроби согласно правилам логарифмирования. В результате получим:
Для бикарбонатной буферной системы рК равно 6,1, и уравнение выше может быть преобразовано следующим образом:
Последнее уравнение называют уравнением Гендерсона-Хасселъбаха. С его помощью можно рассчитать рН раствора при условии, если известны значения молярной концентрации HCO3 — и PCO2. Из этого уравнения становится очевидным, что увеличение содержания HCO3 — вызывает повышение рН, приводя к алкалозу.
Увеличение PCO2 снижает рН, смещая кислотно-щелочное равновесие в сторону ацидоза. Уравнение Гендерсона-Хассельбаха, дополнительно определяющее признаки нормального состояния рН и кислотно-щелочного равновесия во внеклеточной жидкости, позволяет понять механизмы физиологической регуляции содержания кислот и оснований во внеклеточной жидкости.
Как будет рассмотрено далее, концентрация бикарбонатов регулируется главным образом почками, тогда как PCO2 во внеклеточной жидкости зависит от вентиляции легких. Усиление легочной вентиляции способствует выведению CO2 из плазмы, при снижении показателей вентиляции легких значение PCO2 возрастает. Гомеостаз кислотно-щелочного состояния поддерживается согласованными действиями обеих систем: выделительной и дыхательной. Повреждение одного или обоих регулирующих механизмов приводит к нарушениям, вследствие которых содержание бикарбонатов или PCO2 во внеклеточной жидкости изменяется.
Нарушения, смещающие кислотно-щелочное равновесие путем изменения содержания бикарбонатов во внеклеточной жидкости, называют метаболическими, поэтому ацидоз, вызванный таким изменением, носит название метаболического ацидоза, а алкалоз, первичной причиной которого является увеличение концентрации ионов бикарбоната, называют метаболическим алкалозом. При увеличении PCO2 возникает дыхательный ацидоз, а при снижении — дыхательный алкалоз.
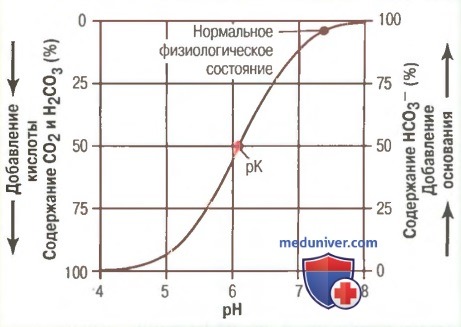
б) Кривая титрования бикарбонатной буферной системы. На рисунке выше показаны сдвиги рН во внеклеточной жидкости в ответ на изменения содержания HCO3 — и CO2 во внеклеточной жидкости. Когда концентрации двух этих компонентов равны, правая часть уравнения Гендерсона-Хасселъбаха становится логарифмом 1, который равен нулю, поэтому величина рН раствора такая же, как и рК (6,1) бикарбонатной буферной системы. При добавлении к ней основания часть растворенного CO2 преобразуется в HCO3 — , увеличивая значение соотношения HCO3 — к CO2 и, соответственно, рН, что становится очевидным из уравнения Гендерсона-Хассельбаха. Добавленная в раствор кислота связывается HCO3 — , который затем преобразуется в растворенный CO2, что уменьшает соотношение между HCO3 — к CO2 и рН внеклеточной жидкости.
в) Буферная емкость раствора определяется суммарной и относительной концентрацией компонентов буферной системы. Особенность расположения ряда точек, изображенных на кривой титрования рисунке, является вполне объяснимой. Во-первых, при условии, когда доля каждого компонента буферного раствора (HCO3 — и CO2) составляет по 50%, рН и рК равны. Во-вторых, буферная система наиболее эффективно действует в центральной части кривой, где рН приближен к рК системы. Это означает, что изменения рН, возникающие в результате добавления к раствору кислот или оснований, в этом диапазоне значений наименьшие. Деятельность буферной системы остается эффективной при отклонениях значений рН в любую сторону в пределах 1, что расширяет границы деятельности буфера от 5,1 до 7,1 единиц. Вне указанных границ буферная емкость быстро снижается. Когда весь CO2 преобразуется в HCO3 — или, наоборот, когда весь HCO3 — преобразуется в CO2, система полностью теряет емкость.
Абсолютная концентрация компонентов буферной системы также является важным показателем, определяющим буферную емкость. При низкой концентрации компонентов буферной системы добавленные даже в небольшом количестве кислоты и щелочи приводят к значительным изменениям рН.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Видео:Буферные растворы и уравнение Гендерсона-ГассельбахаСкачать

РН буферных растворов.
Для буферной системы I типа НА/A — концентрацию ионов Н + в растворе легко вычислить, исходя из константы диссоциации слабой кислоты (для простоты изложения вместо активностей ионов в выражении для 
 , , |
 . . |
В присутствии второго компонента буферного раствора – сильного электролита – равновесие диссоциации слабой кислоты НA, согласно принципу Ле-Шателье, смещено влево. Поэтому можно считать, что концентрация недиссоциированных молекул НA практически равна концентрации кислоты в буферном растворе, а концентрация ионов A — равна концентрации соли.
В таком случае можно записать:
 , , | (3) |
где С(кислоты) и С(соли) – молярные концентрации кислоты и соли.
Если равенство (3) прологарифмировать (взять отрицательный десятичный логарифм левой и правой частей уравнения), то получим:
 . . | (4) |
Так, рН фосфатной буферной системы состава NaH2PO4/Na2HPO4 можно рассчитать по уравнению:
 , , |
где 
В случаях, когда требуется получить буферный раствор с задан-ным значением pH, используют уравнение:
 , , | (5) |
где индексом «0» обозначены характеристики исходных растворов кислоты и соли, смешиванием которых получают требуемую буферную смесь.
Для буферной системы II типа В/ВН + , например аммонийной, гидроксидный и водородный показатели вычисляют по уравнениям:
 , , | (6) |
 , , | (6¢) |
где 
В общем виде уравнение для расчета pH буферных систем выглядит следующим образом:
 , , | (7) |
и называется уравнениемГендерсона-Гассельбаха.
Из уравнения Гендерсона-Гассельбаха следует, что:
1. Величина рН буферных растворов зависит от константы диссоциации кислоты или основания и от соотношения количеств компонентов, но практически не зависит от разбавления или концентрирования растворов. Действительно, в этих процессах концентрации компонентов буферного раствора изменяются пропорционально, поэтому их соотношение, которое определяет значение рН буферного раствора, остается неизменным.
Если концентрации компонентов буферных растворов превышают 0,1 моль/л, то в расчетах необходимо учитывать коэффициенты активности ионов системы.
2. Показатель константы диссоциации слабого электролита определяет область буферного действия раствора, т.е. тот интервал значений водородного показателя, в котором сохраняются буферные свойства системы. Поскольку буферное действие продолжается, пока не израсходовано 90% компонента (т.е. его концентрация не уменьшилась на порядок), то область (зона) буферного действия отличается от 


Амфолиты могут иметь несколько зон буферного действия, каждая из которых отвечает соответствующей константе 

Таким образом, максимально допустимое соотношение компонентов раствора, при котором он проявляет буферное действие, составляет 10:1.
Пример 1. Можно ли приготовить ацетатный буфер с рН = 6,5, если 
Решение.
Поскольку зона буферного действия определяется как 
Пример 2. Вычислить рН буферного раствора, в 100 мл которого содержится 1,2 г уксусной кислоты и 5,88 г ацетата калия, если для уксусной кислоты 
Решение.
Молярные концентрации кислоты и соли в буферном растворе равны:


Подставив эти значения в уравнение (7), получим:
Пример 3 Рассчитать рН буферной смеси, если для ее приготовления были взяты растворы муравьиной кислоты и формиата натрия одинаковой молярной концентрации в соотношении 7:3. 
Решение.
Так как молярные концентрации кислоты и соли равны, то при расчете pH по формуле (5) можно использовать только объемное соотношение компонентов:
Пример 4. Рассчитать значение pH буферного раствора, полученного при сливании 20 мл раствора аммиачной воды с С(NH3·H2O) = 0,02 моль/л и 10 мл раствора хлорида аммония с С(NH4Cl) = 0,01 моль/л. 
Решение.
В случае буферной системы II типа pH раствора рассчитывают по уравнению (6¢):

Подставив соответствующие значения, получим:

При разбавлении рН буферных растворов не изменяется. Следовательно, рН буферного раствора, разбавленного в 5 раз, будет равен 9,86.
Пример 5. Буферный раствор получен сливанием 100 мл раствора СН3СООН с С(СН3СООН) = 0,02 моль/л и 50 мл раствора CH3COONa с С(CH3COONa) = 0,01 моль/л. 
а) рН полученного буфера;
б) изменение рН буфера при добавлении 5 мл раствора HCl c C(HCl) = 0,01 моль/л.
в) буферную емкость раствора по щелочи.
Решение.
Для расчета рН полученного буфера воспользуемся формулой (5):
При добавлении кислоты протекает реакция:
СН3СОONa + HCl 
в результате которой изменяются количества компонентов буферной системы.
С учетом соотношения n(x) = C(x)×V(x) уравнение (7) может быть представлено в виде:

Так как количества прореагировавших и образовавшихся веществ равны, то изменение количеств кислоты и соли в буферном растворе составит одну и туже величину x:


В исходной буферной смеси количества компонентов составляют:


Найдем величину x:


Таким образом, разность значений рН составит 
Буферная емкость.
Прибавлять кислоту или щелочь, существенно не меняя рН буферного раствора, можно лишь в относительно небольших количествах, так как способность буферных растворов сохранять постоянство рН ограничена.
Величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей, называется буферной емкостью (В).Различают буферную емкость по кислоте ( 

Буферная емкость (В) измеряется количеством кислоты или щелочи (моль или ммоль эквивалента), добавление которого к 1 л буферного раствора изменяет рН на единицу.
На практике буферную емкость определяют титрованием. Для этого определенный объем буферного раствора титруют сильной кислотой или щелочью известной концентрации до достижения точки эквивалентности. Титрование проводят в присутствии кислотно-основных индикаторов, при правильном выборе которых фиксируют состояние, когда компонент буферной системы прореагирует полностью. По полученным результатам рассчитывают величину буферной емкости ( 

 | (8) |
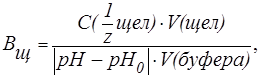 | (9) |
где С( 

V(к-ты ), V(щел) — объемы добавленных растворов кислоты или щелочи (л; мл);
V(буфера) — объем буферного раствора (л; мл);
pH0 и pH — значения рН буферного раствора до и после титрования кислотой или щелочью (изменение рН берется по абсолютной величине).
Буферную емкость выражают в [моль/л] или в [ммоль/л].
Буферная емкость зависит от ряда факторов:
1. Чем больше абсолютное содержание компонентов пары основание/сопряженная кислота, тем выше буферная емкость буферного раствора.
Буферная емкость зависит от соотношения количеств компонентов буферного раствора, а следовательно, и от рН буфера. Буферная емкость максимальна при равных количествах компонентов буферной системы и уменьшается с отклонением от этого соотношения.
3. При различном содержании компонентов буферные емкости раствора по кислоте и по щелочи отличаются. Так, в буферном растворе I типа чем больше содержание кислоты, тем больше буферная емкость по щелочи, а чем больше содержание соли, тем больше буферная емкость по кислоте. В буферном растворе II типа чем больше содержание соли, тем больше буферная емкость по щелочи, а чем больше содержание основания, тем больше буферная емкость по кислоте.
Пример 2. Для приготовления ацетатных буферных смесей растворы кислоты и соли одинаковой молярной концентрации были смешаны в следующих объемных соотношениях:
| Состав буферной системы | Объемные соотношения компонентов буферной системы | |
| раствор I | раствор II | раствор III |
| CH3COOH | ||
| CH3COONa |
Не прибегая к расчетам, определить, в каком из трёх буферных растворов будет наблюдаться:
а) наибольшее значение рН;
б) максимальная буферная емкость;
в) наибольшая буферная емкость по кислоте.
Решение.
В случае равных концентраций компонентов уравнение (5) принимает вид:

Так как 


Максимальной буферной емкостью характеризуется II раствор, так как в нем соотношение количеств компонентов составляет 1:1.
Буферная емкость по кислоте для ацетатного буфера определя-ется содержанием сопряженного основания, т.е. соли: чем оно больше, тем больше буферная емкость раствора по кислоте. Поэтому:
Таким образом, наибольшую емкость по кислоте будет иметь I раствор.
💡 Видео
Буферные растворы. 1 часть. 11 класс.Скачать

Уравнение Гендерсона-ХассельбахаСкачать

Уравнение Гендерсона-Хассельбаха в решении задачиСкачать

pH и буферные растворы | Медицинская химия | МедвузаСкачать

Буферные растворы. Практическая часть. 11 класс.Скачать

Буферные растворы и уравнение Хендерсона-Хассельбаха (видео 4) | Буферные растворы | ХимияСкачать

Буферные растворыСкачать

Буферные растворы. 2 часть. 11 класс.Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Буферные системыСкачать

Расчёты pH буферных растворов (видео 5) | Буферные растворы | ХимияСкачать

Буферная ёмкость (видео 7) | Буферные растворы | ХимияСкачать

Связь pH и pKa для буферных растворов (видео 6) | Буферные растворы | ХимияСкачать
3 5 Буферные растворыСкачать

Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Химия 3.Буферные растворыСкачать

Введение в буферные растворы (видео 1) | Буферные растворы | ХимияСкачать

Буферные системы. рНСкачать