задача №15
к главе «Глава 21 Химия элементов-металлов. §21.3 Алюминий. Алюминотермия».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Презентация к уроку «Алюминий и его соединения»
Продолжить формирование представлений о химическом элементе и простом веществе алюминии, нахождении его в природе; строении атома, физических и химических свойствах, применении алюминия и его сплавов. Совершенствовать умение записывать уравнения хи- мических реакций, характеризующих химические свойства алюминия, особенности его вза- имодействия со щелочами.Продолжить формирование представлений об амфотерности на примере оксида и гидроксида алюминия, применении соединений алюминия. Развивать и совершенствовать умения составлять уравнения в молекулярной, полной и сокращенной ионных формах. Совершенствовать экспериментальные умения на примере доказательства амфотерного характера гидроксида алюминия.
Просмотр содержимого документа
«Презентация к уроку «Алюминий и его соединения»»
Положение в Периодической системе
- Алюминий располагается в 3 периоде, в IIIА — группе.
- Порядковый номер элемента – 13
- Относительная атомная масса – 27
- Алюминий – металл, соединения которого обладают амфотерными свойствами.
Строение атома алюминия
- Заряд ядра атома алюминия +13
- В атоме 3 энергетических уровня
- Электронная оболочка атома алюминия содержит
- На внешнем электронном уровне 3 электрона (2 – спаренных s-электрона и 1 – неспаренный p-электрон)
Нахождение в природе
- По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов. Встречается только в составе соединений.
- Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. Название элемента образовано от лат. aluminis — квасцы .
AlCl 3 + 3K = 3KCl + Al
- В настоящее время алюминий получают электролизом оксида:
2Al 2 O 3 = 4Al + 3O 2 – 3352 кДж
- плотность (при 20°С) 2698,9 кг/м3;
- t пл 660,24°С;
- t кип около 2500°С;
Алюминий сочетает весьма ценный комплекс свойств: малую плотность, высокие теплопроводность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость, обладает высокой отражательной способностью, близкой к серебру (он отражает до 90% падающей световой энергии).

4Al + 3O 2 = 2Al 2 O 3
4 Al 0 — 3 ē → Al +3 окисление, восстановитель
3 O 2 0 + 4ē → 2O -2 восстановление, окислитель
2Al + 6H 2 O = 2Al(OH) 3 + 3H 2 ↑
4 Al 0 — 3 ē → Al +3 окисление, восстановитель
3 2H +1 + 2ē → H 2 0 восстановление, окислитель
2Al + 6HCl = 2AlCl 3 + 3H 2 ↑
2Al + 6H + + 6Cl — = 2Al 3+ + 6Cl — + 3H 2 ↑
2Al + 6H + = 2Al 3+ + 3H 2 ↑
2Al + 2H 2 O + 2NaOH = 2NaAlO 2 + 3H 2 ↑
2Al + 2H 2 O + 2Na + + 2OH — = 2Na + + 2AlO 2 — + 3H 2 ↑
2Al + 2H 2 O + 2OH — = 2AlO 2 — + 3H 2 ↑
- Вытесняет металлы из их оксидов
8Al + 3Fe 3 O 4 = 9Fe + 4Al 2 O 3
8 Al 0 — 3 ē → Al +3 – окисление, восстановитель
3 24 Fe +2 + 2ē → Fe 0 – восстановление, ок-ль
3 2Fe +3 + 6ē → 2Fe 0 – восстановление, ок-ль
Соединения алюминия. Оксид
- Очень твердый порошок белого цвета.
- Образуется:
а) при окислении или горении алюминия:
4Al + 3O 2 = 2Al 2 O 3
б) в реакции алюминотермии:
2Al + Fe 2 O 3 = 2Fe + Al 2 O 3
в) при термическом разложении гидроксида:
2Al(OH) 3 = Al 2 O 3 + H 2 O
Химические свойства оксида алюминия
Al 2 O 3 по характеру амфотерный оксид.
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 3H 2 O
Al 2 O 3 + 6H + + 3SO 4 2- = 2Al 3+ + 3SO 4 2- + 3H 2 O
Al 2 O 3 + 6H + = 2Al 3+ + 3H 2 O
Al 2 O 3 + 6NaOH = 2Na 3 AlO 3 + 3H 2 O
Al 2 O 3 + 6Na + + 6OH — = 6Na + + 2AlO 3 3- + 3H 2 O
Al 2 O 3 + 6OH — = 2AlO 3 3- + 3H 2 O
- Белый нерастворимый в воде порошок
- Проявляет амфотерные свойства.
- Взаимодействует:
Al(OH) 3 + 3HNO 3 = Al(NO 3 ) 3 + 3H 2 O
Al(OH) 3 + 3H + + 3NO 3 — = Al 3+ + 3NO 3 — + 3H 2 O
Al(OH) 3 + 3H + = Al 3+ + 3H 2 O
Al(OH) 3 + 3KOH = K 3 AlO 3 + 3H 2 O
Al(OH) 3 + 3K + + 3OH — = 3K + + AlO 3 3- + 3H 2 O
Al(OH) 3 + 3OH — = AlO 3 3- + 3H 2 O
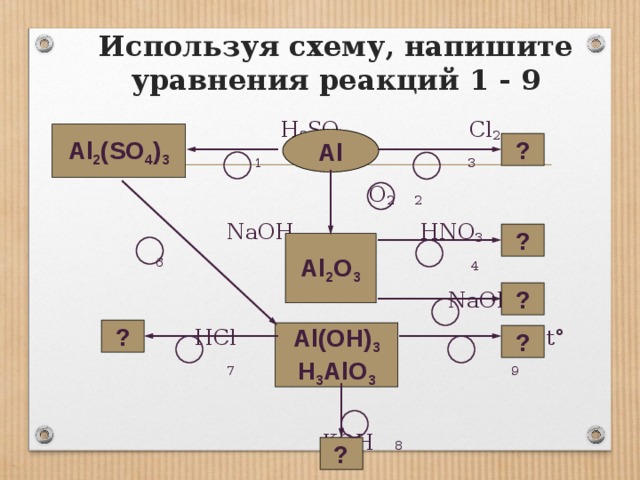
Используя схему, напишите уравнения реакций 1 — 9
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Презентация по химии на тему «Алюминий и его соединения» (9 класс)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Описание презентации по отдельным слайдам:
Презентация Патаховой С.М.. учителя химии и биологии МКОУ «Шангодинской СОШ» Гунибского района Алюминий и его соединения
Положение в Периодической системе Алюминий располагается в 3 периоде, в главной подгруппе 3 группы. Порядковый номер элемента – 13 Относительная атомная масса – 27 Алюминий – металл, соединения которого обладают амфотерными свойствами.
Строение атома алюминия Заряд ядра атома алюминия +13 В атоме 3 энергетических уровня Электронная оболочка атома алюминия содержит s- и p-электроны На внешнем электронном уровне 3 электрона (2 – спаренных s-электрона и 1 – неспаренный p-электрон)
Нахождение в природе По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов. Встречается только в составе соединений.
Получение алюминия Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. Название элемента образовано от лат. aluminis — квасцы. AlCl3 + 3K = 3KCl + Al В настоящее время алюминий получают электролизом оксида: эл.ток 2Al2O3 = 4Al + 3O2 – 3352 кДж
Физические свойства плотность (при 20°С) 2698,9 кг/м3; tпл 660,24°С; tкип около 2500°С; Алюминий сочетает весьма ценный комплекс свойств: малую плотность, высокие теплопровод-ность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость, обладает высокой отражательной способностью, близкой к серебру (он отражает до 90% падающей световой энергии). На воздухе алюминий покрывается тонкой, но очень прочной пленкой оксида Al2О3, защищающей металл от дальнейшего окисления и обусловливающей его высокие антикоррозионные свойства.
Химические свойства Окисляется на воздухе: 4Al + 3O2 = 2Al2O3 4 Al0 — 3ē → Al+3окисление, восстановитель 3 O20 + 4ē → 2O-2 восстановление, окислитель Вытесняет водород из воды 2Al + 6H2O = 2Al(OH)3 + 3H2↑ 4 Al0 — 3ē → Al+3окисление, восстановитель 3 2H+1 + 2ē → H20 восстановление, окислитель
Химические свойства Взаимодействует с кислотами: 2Al + 6HCl = 2AlCl3 + 3H2↑ 2Al + 6H+ + 6Cl- = 2Al3+ + 6Cl-+ 3H2↑ 2Al + 6H+ = 2Al3+ + 3H2↑ Взаимодействует со щелочами: 2Al + 2H2O + 2NaOH = 2NaAlO2 + 3H2↑ 2Al + 2H2O + 2Na+ + 2OH- = 2Na+ + 2AlO2- + 3H2↑ 2Al + 2H2O + 2OH- = 2AlO2- + 3H2↑
Химические свойства Вытесняет металлы из их оксидов (алюминотермия): 8Al + 3Fe3O4 = 9Fe + 4Al2O3 8 Al0 — 3ē → Al+3 – окисление, восстановитель 3 24 Fe+2 + 2ē → Fe0 – восстановление, ок-ль 3 2Fe+3 + 6ē → 2Fe0 – восстановление, ок-ль
Соединения алюминия. Оксид Очень твердый порошок белого цвета. Образуется: а) при окислении или горении алюминия: 4Al + 3O2 = 2Al2O3 б) в реакции алюминотермии: 2Al + Fe2O3 = 2Fe + Al2O3 в) при термическом разложении гидроксида: 2Al(OH)3 = Al2O3 + H2O
Химические свойства оксида алюминия Al2O3 по характеру амфотерный оксид. Взаимодействует: а) с кислотами: Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O Al2O3 + 6H+ + 3SO42- = 2Al3+ + 3SO42- + 3H2O Al2O3 + 6H+ = 2Al3+ + 3H2O б) со щелочами: Al2O3 + 6NaOH = 2Na3AlO3 + 3H2O Al2O3 + 6Na+ + 6OH- = 6Na+ + 2AlO33- + 3H2O Al2O3 + 6OH- = 2AlO33- + 3H2O
Гидроксид алюминия Белый нерастворимый в воде порошок Проявляет амфотерные свойства. Взаимодействует: а) с кислотами: Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O Al(OH)3 + 3H+ + 3NO3- = Al3+ + 3NO3- + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O б) со щелочами: Al(OH)3 + 3KOH = K3AlO3 + 3H2O Al(OH)3 + 3K+ + 3OH- = 3K+ + AlO33- + 3H2O Al(OH)3 + 3OH- = AlO33- + 3H2O
Используя схему, напишите уравнения реакций 1 — 9 H2SO4 Cl2 1 3 O2 2 NaOH HNO3 6 4 NaOH HCl 5 t° 7 9 KOH 8 Al Al2O3 Al2(SO4)3 ? ? ? ? ? Al(OH)3 H3AlO3 ?
Краткое описание документа:
Презентация Патаховой С.М.. учителя химии и биологии МКОУ «Шангодинской СОШ» Гунибского района Алюминий и его соединения Положение в Периодической системе Алюминий располагается в 3 периоде, в главной подгруппе 3 группы. Порядковый номер элемента – 13 Относительная атомная масса – 27 Алюминий – металл, соединения которого обладают амфотерными свойствами. Строение атома алюминия Заряд ядра атома алюминия +13 В атоме 3 энергетических уровня Электронная оболочка атома алюминия содержит s- и p-электроны На внешнем электронном уровне 3 электрона (2 – спаренных s-электрона и 1 – неспаренный p-электрон) Нахождение в природе По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов. Встречается только в составе соединений. Получение алюминия Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. Название элемента образовано от лат. aluminis — квасцы. AlCl3 + 3K = 3KCl + Al В настоящее время алюминий получают электролизом оксида: эл.ток 2Al2O3 = 4Al + 3O2 – 3352 кДж Физические свойства плотность (при 20°С) 2698,9 кг/м3; tпл 660,24°С; tкип около 2500°С; Алюминий сочетает весьма ценный комплекс свойств: малую плотность, высокие теплопровод-ность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость, обладает высокой отражательной способностью, близкой к серебру (он отражает до 90% падающей световой энергии). На воздухе алюминий покрывается тонкой, но очень прочной пленкой оксида Al2О3, защищающей металл от дальнейшего окисления и обусловливающей его высокие антикоррозионные свойства. Химические свойства Окисляется на воздухе: 4Al + 3O2 = 2Al2O3 4 Al0 — 3ē → Al+3 окисление, восстановитель 3 O20 + 4ē → 2O-2 восстановление, окислитель Вытесняет водород из воды 2Al + 6H2O = 2Al(OH)3 + 3H2↑ 4 Al0 — 3ē → Al+3 окисление, восстановитель 3 2H+1 + 2ē → H20 восстановление, окислитель Химические свойства Взаимодействует с кислотами: 2Al + 6HCl = 2AlCl3 + 3H2↑ 2Al + 6H+ + 6Cl- = 2Al3+ + 6Cl-+ 3H2↑ 2Al + 6H+ = 2Al3+ + 3H2↑ Взаимодействует со щелочами: 2Al + 2H2O + 2NaOH = 2NaAlO2 + 3H2↑ 2Al + 2H2O + 2Na+ + 2OH- = 2Na+ + 2AlO2- + 3H2↑ 2Al + 2H2O + 2OH- = 2AlO2- + 3H2↑ Химические свойства Вытесняет металлы из их оксидов (алюминотермия): 8Al + 3Fe3O4 = 9Fe + 4Al2O3 8 Al0 — 3ē → Al+3 – окисление, восстановитель 3 24 Fe+2 + 2ē → Fe0 – восстановление, ок-ль 3 2Fe+3 + 6ē → 2Fe0 – восстановление, ок-ль Соединения алюминия. Оксид Очень твердый порошок белого цвета. Образуется: а) при окислении или горении алюминия: 4Al + 3O2 = 2Al2O3 б) в реакции алюминотермии: 2Al + Fe2O3 = 2Fe + Al2O3 в) при термическом разложении гидроксида: 2Al(OH)3 = Al2O3 + H2O Химические свойства оксида алюминия Al2O3 по характеру амфотерный оксид. Взаимодействует: а) с кислотами: Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O Al2O3 + 6H+ + 3SO42- = 2Al3+ + 3SO42- + 3H2O Al2O3 + 6H+ = 2Al3+ + 3H2O б) со щелочами: Al2O3 + 6NaOH = 2Na3AlO3 + 3H2O Al2O3 + 6Na+ + 6OH- = 6Na+ + 2AlO33- + 3H2O Al2O3 + 6OH- = 2AlO33- + 3H2O Гидроксид алюминия Белый нерастворимый в воде порошок Проявляет амфотерные свойства. Взаимодействует: а) с кислотами: Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O Al(OH)3 + 3H+ + 3NO3- = Al3+ + 3NO3- + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O б) со щелочами: Al(OH)3 + 3KOH = K3AlO3 + 3H2O Al(OH)3 + 3K+ + 3OH- = 3K+ + AlO33- + 3H2O Al(OH)3 + 3OH- = AlO33- + 3H2O Используя схему, напишите уравнения реакций 1 — 9 H2SO4 Cl2 1 3 O2 2 NaOH HNO3 6 4 NaOH HCl 5 t° 7 9 KOH 8 Al Al2O3 Al2(SO4)3 ? ? ? ? ? Al(OH)3 H3AlO3 ?
«Мотивация здорового образа жизни. Организация секций»
🔥 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Составление уравнений реакций. 1 часть. 9 класс.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Решение упражнений по теме Алюминий и его соединенияСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Решение цепочек превращений по химииСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Реакции ионного обмена. 9 класс.Скачать

Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать