задача №15
к главе «Глава 21 Химия элементов-металлов. §21.3 Алюминий. Алюминотермия».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
- Презентация по химии «Аллюминий и его соединения»
- Описание презентации по отдельным слайдам:
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Материал подходит для УМК
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Презентация к уроку «Алюминий и его соединения»
- Просмотр содержимого документа «Презентация к уроку «Алюминий и его соединения»»
- 🔥 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Презентация по химии «Аллюминий и его соединения»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Описание презентации по отдельным слайдам:
9 класс Алюминий и его соединения
Положение в Периодической системе Алюминий располагается в 3 периоде, в главной подгруппе 3 группы. Порядковый номер элемента – 13 Относительная атомная масса – 27 Алюминий – металл, соединения которого обладают амфотерными свойствами.
Строение атома алюминия Заряд ядра атома алюминия +13 В атоме 3 энергетических уровня Электронная оболочка атома алюминия содержит s- и p-электроны На внешнем электронном уровне 3 электрона (2 – спаренных s-электрона и 1 – неспаренный p-электрон)
Нахождение в природе По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов. Встречается только в составе соединений.
Получение алюминия Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. Название элемента образовано от лат. aluminis — квасцы. AlCl3 + 3K = 3KCl + Al В настоящее время алюминий получают электролизом оксида: эл.ток 2Al2O3 = 4Al + 3O2 – 3352 кДж
Физические свойства плотность (при 20°С) 2698,9 кг/м3; tпл 660,24°С; tкип около 2500°С; Алюминий сочетает весьма ценный комплекс свойств: малую плотность, высокие теплопровод-ность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость, обладает высокой отражательной способностью, близкой к серебру (он отражает до 90% падающей световой энергии). На воздухе алюминий покрывается тонкой, но очень прочной пленкой оксида Al2О3, защищающей металл от дальнейшего окисления и обусловливающей его высокие антикоррозионные свойства.
Химические свойства Окисляется на воздухе: 4Al + 3O2 = 2Al2O3 4 Al0 — 3ē → Al+3окисление, восстановитель 3 O20 + 4ē → 2O-2 восстановление, окислитель Вытесняет водород из воды 2Al + 6H2O = 2Al(OH)3 + 3H2↑ 4 Al0 — 3ē → Al+3окисление, восстановитель 3 2H+1 + 2ē → H20 восстановление, окислитель
Химические свойства Взаимодействует с кислотами: 2Al + 6HCl = 2AlCl3 + 3H2↑ 2Al + 6H+ + 6Cl- = 2Al3+ + 6Cl-+ 3H2↑ 2Al + 6H+ = 2Al3+ + 3H2↑ Взаимодействует со щелочами: 2Al + 2H2O + 2NaOH = 2NaAlO2 + 3H2↑ 2Al + 2H2O + 2Na+ + 2OH- = 2Na+ + 2AlO2- + 3H2↑ 2Al + 2H2O + 2OH- = 2AlO2- + 3H2↑
Химические свойства Вытесняет металлы из их оксидов (алюминотермия): 8Al + 3Fe3O4 = 9Fe + 4Al2O3 8 Al0 — 3ē → Al+3 – окисление, восстановитель 3 24 Fe+2 + 2ē → Fe0 – восстановление, ок-ль 3 2Fe+3 + 6ē → 2Fe0 – восстановление, ок-ль
Соединения алюминия. Оксид Очень твердый порошок белого цвета. Образуется: а) при окислении или горении алюминия: 4Al + 3O2 = 2Al2O3 б) в реакции алюминотермии: 2Al + Fe2O3 = 2Fe + Al2O3 в) при термическом разложении гидроксида: 2Al(OH)3 = Al2O3 + H2O
Химические свойства оксида алюминия Al2O3 по характеру амфотерный оксид. Взаимодействует: а) с кислотами: Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O Al2O3 + 6H+ + 3SO42- = 2Al3+ + 3SO42- + 3H2O Al2O3 + 6H+ = 2Al3+ + 3H2O б) со щелочами: Al2O3 + 6NaOH = 2Na3AlO3 + 3H2O Al2O3 + 6Na+ + 6OH- = 6Na+ + 2AlO33- + 3H2O Al2O3 + 6OH- = 2AlO33- + 3H2O
Гидроксид алюминия Белый нерастворимый в воде порошок Проявляет амфотерные свойства. Взаимодействует: а) с кислотами: Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O Al(OH)3 + 3H+ + 3NO3- = Al3+ + 3NO3- + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O б) со щелочами: Al(OH)3 + 3KOH = K3AlO3 + 3H2O Al(OH)3 + 3K+ + 3OH- = 3K+ + AlO33- + 3H2O Al(OH)3 + 3OH- = AlO33- + 3H2O
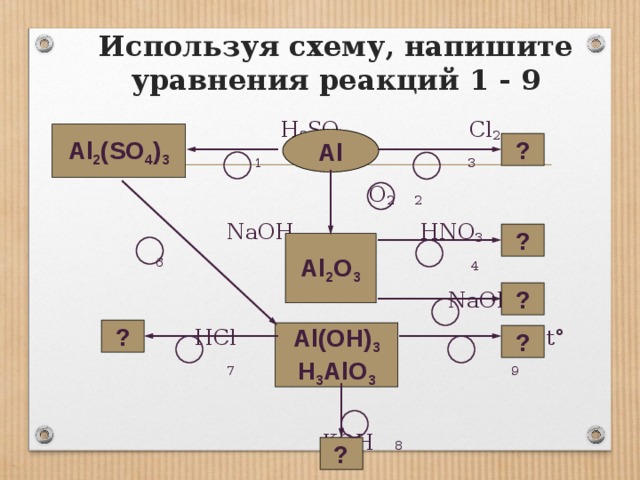
Используя схему, напишите уравнения реакций 1 — 9 H2SO4 Cl2 1 3 O2 2 NaOH HNO3 6 4 NaOH HCl 5 t° 7 9 KOH 8 Al Al2O3 Al2(SO4)3 ? ? ? ? ? Al(OH)3 H3AlO3 ?
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 932 человека из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 40 человек из 25 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 26 человек из 16 регионов
Ищем педагогов в команду «Инфоурок»
Видео:8 класс. Составление уравнений химических реакций.Скачать

Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 575 981 материал в базе
Материал подходит для УМК
«Химия», Габриелян О.С.
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Другие материалы
- 01.06.2018
- 3359
- 10
- 24.05.2018
- 326
- 0
- 17.05.2018
- 763
- 22
- 15.05.2018
- 931
- 4
- 11.05.2018
- 434
- 0
- 10.05.2018
- 1099
- 2
- 10.05.2018
- 414
- 0
- 08.05.2018
- 695
- 8
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 02.06.2018 826
- PPTX 441.5 кбайт
- 15 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Шот Ирина Сергеевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 5 лет и 3 месяца
- Подписчики: 0
- Всего просмотров: 33505
- Всего материалов: 26
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В Курганской области дистанционный режим для школьников продлили до конца февраля
Время чтения: 1 минута
Приемная кампания в вузах начнется 20 июня
Время чтения: 1 минута
Полный перевод школ на дистанционное обучение не планируется
Время чтения: 1 минута
В Забайкалье в 2022 году обеспечат интернетом 83 школы
Время чтения: 1 минута
Профессия педагога на третьем месте по популярности среди абитуриентов
Время чтения: 1 минута
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Презентация к уроку «Алюминий и его соединения»
Продолжить формирование представлений о химическом элементе и простом веществе алюминии, нахождении его в природе; строении атома, физических и химических свойствах, применении алюминия и его сплавов. Совершенствовать умение записывать уравнения хи- мических реакций, характеризующих химические свойства алюминия, особенности его вза- имодействия со щелочами.Продолжить формирование представлений об амфотерности на примере оксида и гидроксида алюминия, применении соединений алюминия. Развивать и совершенствовать умения составлять уравнения в молекулярной, полной и сокращенной ионных формах. Совершенствовать экспериментальные умения на примере доказательства амфотерного характера гидроксида алюминия.
Просмотр содержимого документа
«Презентация к уроку «Алюминий и его соединения»»
Положение в Периодической системе
- Алюминий располагается в 3 периоде, в IIIА — группе.
- Порядковый номер элемента – 13
- Относительная атомная масса – 27
- Алюминий – металл, соединения которого обладают амфотерными свойствами.
Строение атома алюминия
- Заряд ядра атома алюминия +13
- В атоме 3 энергетических уровня
- Электронная оболочка атома алюминия содержит
- На внешнем электронном уровне 3 электрона (2 – спаренных s-электрона и 1 – неспаренный p-электрон)
Нахождение в природе
- По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов. Встречается только в составе соединений.
- Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. Название элемента образовано от лат. aluminis — квасцы .
AlCl 3 + 3K = 3KCl + Al
- В настоящее время алюминий получают электролизом оксида:
2Al 2 O 3 = 4Al + 3O 2 – 3352 кДж
- плотность (при 20°С) 2698,9 кг/м3;
- t пл 660,24°С;
- t кип около 2500°С;
Алюминий сочетает весьма ценный комплекс свойств: малую плотность, высокие теплопроводность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость, обладает высокой отражательной способностью, близкой к серебру (он отражает до 90% падающей световой энергии).

4Al + 3O 2 = 2Al 2 O 3
4 Al 0 — 3 ē → Al +3 окисление, восстановитель
3 O 2 0 + 4ē → 2O -2 восстановление, окислитель
2Al + 6H 2 O = 2Al(OH) 3 + 3H 2 ↑
4 Al 0 — 3 ē → Al +3 окисление, восстановитель
3 2H +1 + 2ē → H 2 0 восстановление, окислитель
2Al + 6HCl = 2AlCl 3 + 3H 2 ↑
2Al + 6H + + 6Cl — = 2Al 3+ + 6Cl — + 3H 2 ↑
2Al + 6H + = 2Al 3+ + 3H 2 ↑
2Al + 2H 2 O + 2NaOH = 2NaAlO 2 + 3H 2 ↑
2Al + 2H 2 O + 2Na + + 2OH — = 2Na + + 2AlO 2 — + 3H 2 ↑
2Al + 2H 2 O + 2OH — = 2AlO 2 — + 3H 2 ↑
- Вытесняет металлы из их оксидов
8Al + 3Fe 3 O 4 = 9Fe + 4Al 2 O 3
8 Al 0 — 3 ē → Al +3 – окисление, восстановитель
3 24 Fe +2 + 2ē → Fe 0 – восстановление, ок-ль
3 2Fe +3 + 6ē → 2Fe 0 – восстановление, ок-ль
Соединения алюминия. Оксид
- Очень твердый порошок белого цвета.
- Образуется:
а) при окислении или горении алюминия:
4Al + 3O 2 = 2Al 2 O 3
б) в реакции алюминотермии:
2Al + Fe 2 O 3 = 2Fe + Al 2 O 3
в) при термическом разложении гидроксида:
2Al(OH) 3 = Al 2 O 3 + H 2 O
Химические свойства оксида алюминия
Al 2 O 3 по характеру амфотерный оксид.
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 3H 2 O
Al 2 O 3 + 6H + + 3SO 4 2- = 2Al 3+ + 3SO 4 2- + 3H 2 O
Al 2 O 3 + 6H + = 2Al 3+ + 3H 2 O
Al 2 O 3 + 6NaOH = 2Na 3 AlO 3 + 3H 2 O
Al 2 O 3 + 6Na + + 6OH — = 6Na + + 2AlO 3 3- + 3H 2 O
Al 2 O 3 + 6OH — = 2AlO 3 3- + 3H 2 O
- Белый нерастворимый в воде порошок
- Проявляет амфотерные свойства.
- Взаимодействует:
Al(OH) 3 + 3HNO 3 = Al(NO 3 ) 3 + 3H 2 O
Al(OH) 3 + 3H + + 3NO 3 — = Al 3+ + 3NO 3 — + 3H 2 O
Al(OH) 3 + 3H + = Al 3+ + 3H 2 O
Al(OH) 3 + 3KOH = K 3 AlO 3 + 3H 2 O
Al(OH) 3 + 3K + + 3OH — = 3K + + AlO 3 3- + 3H 2 O
Al(OH) 3 + 3OH — = AlO 3 3- + 3H 2 O
Используя схему, напишите уравнения реакций 1 — 9
🔥 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Составление уравнений реакций. 1 часть. 9 класс.Скачать
Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Решение цепочек превращений по химииСкачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Химия | Молекулярные и ионные уравненияСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Химия. Разбор заданий по химии 9 класс. Алюминий Вариант 1Скачать