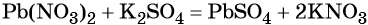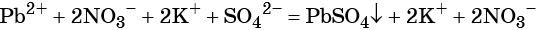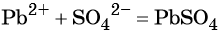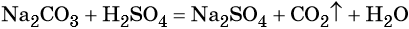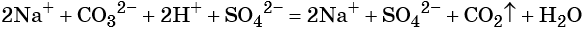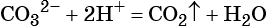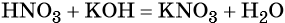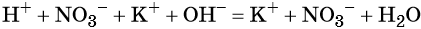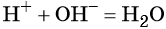Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Реакции ионного обмена
Перейдем к рассмотрению реакций ионного обмена в задании №8 ОГЭ по химии, или А8. Тематика задания сформулирована следующим образом:
- реакции ионного обмена
- условия их осуществления
Теория к заданию №8 ОГЭ по химии
Итак, начнем с определений:
Реакция ионного обмена — одна из видов химических реакций, продуктами которой являются вода, газ или осадок.
Иначе говоря, вещества обмениваются ионами только тогда, когда образуется либо газ, покидающий реакционную смесь, либо малорастворимое вещество — осадок или вода. Более профессиональным языком можно сказать, что движущей силой реакции ионного обмена является образование продукта иного агрегатного или фазового состояния в сравнении с реагентами.
На практике чаще всего мы сталкиваемся с реакциями в растворах, в результате которых образуется осадок, либо газ, либо вода. Чаще всего это реакции обмена.
Пример — реакция карбоната натрия и серной кислоты с выделением углекислого газа:
В сокращенном ионном виде:
Для успешного решения задач нам необходимо запомнить следующие правила:
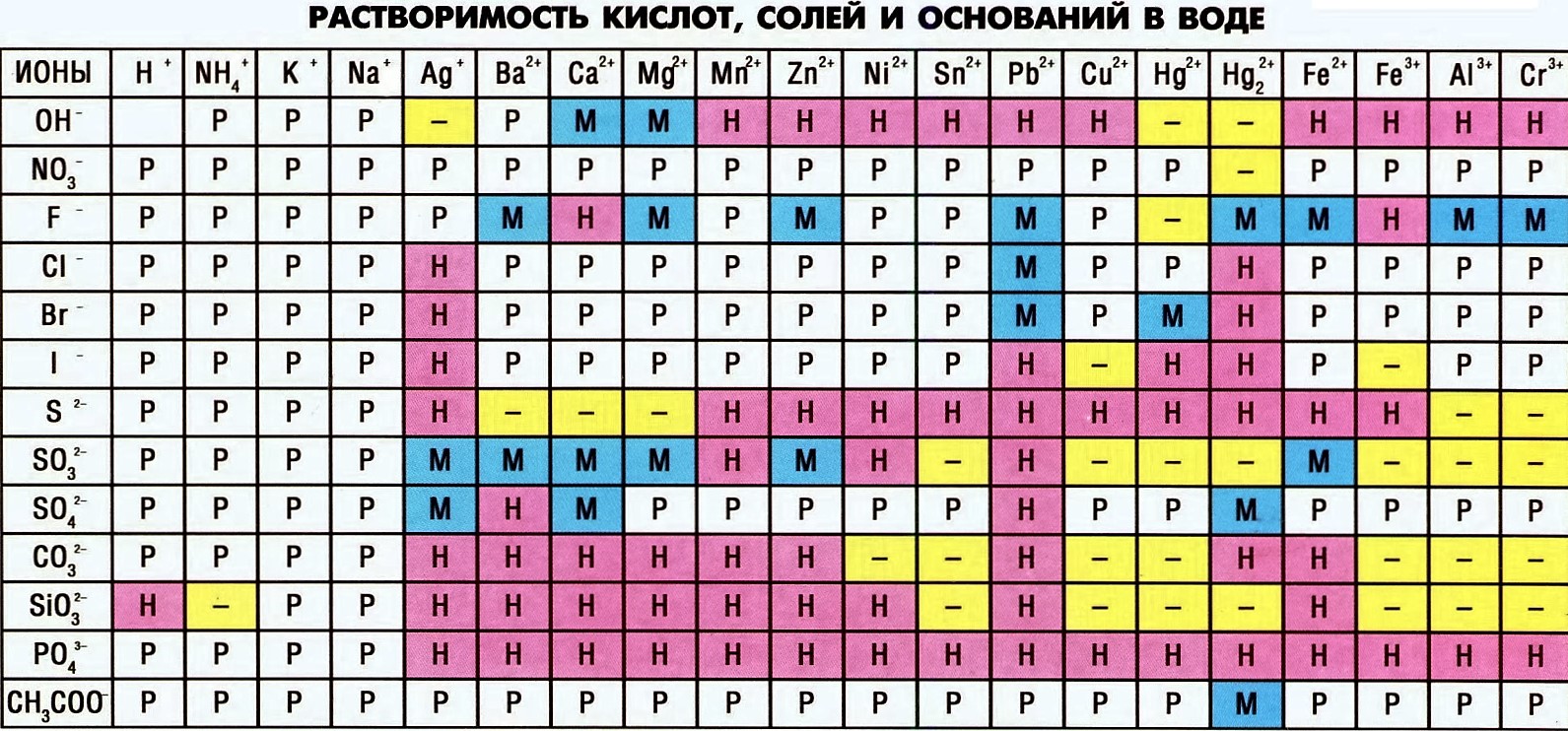
- используем таблицу растворимости: если видим, что продукт (то, что слева в уравнении) нерастворим, то реакция идет.
- если видим в левой части газ (CO2, H2S, SO2 — типичные для ионного обмена), реакция идет.
- если видим воду (H2O), реакция идет.
Разбор типовых вариантов задания №8 ОГЭ по химии
Первый вариант задания
Газ выделяется при взаимодействии
Рассмотрим каждый случай.
MgCl2 + Ba(NO3)2 = Mg(NO3)2 + BaCl2
Смотрим в таблицу растворимости: нитрат магния растворим (кстати, как и все нитраты), хлорид бария — тоже, поэтому реакция не идет. Это во-первых, а во-вторых, нас спрашивают про газ, а газом здесь и не пахнет. 🙂
Na2CO3 + CaCl2 = 2 NaCl + CaCO3
Карбонат кальция нерастворим, реакция ионного обмена идет, но газа в продуктах в ней нет, поэтому этот вариант нам не подходит.
NH4Cl + NaOH = NH4OH + NaCl
NH4OH можно записать как NH3 и H2O, особенно актуально это для щелочной среды, в ней всегда выделяется аммиак!
NH4Cl + NaOH = NH3 + H2O + NaCl
Аммиак — газ, да еще и ядовитый, поэтому этот вариант нам подходит.
CuSO4 + 2 KOH = Cu(OH)2 + K2SO4
Гидроксид меди нерастворим, но газа здесь не наблюдается.
Видео:Реакции ионного обмена. Все типы №14Скачать

Составление уравнений реакций ионного обмена
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
Данный урок продолжает тему «Реакции ионного обмена». Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
Видео:Реакции ионного обмена. 9 класс.Скачать

Реакции ионного обмена и условия их осуществления
Реакциями ионного обмена называют химические реакции, которые протекают между ионами без изменения степеней окисления элементов и приводят к обмену составных частей реагентов.
Уравнения обменных реакций записывают в молекулярной форме (с указанием формул всех реагирующих веществ со стехиометрическими коэффициентами); в полной ионной форме (с указанием всех существующих в растворе ионов) и в сокращённой ионной форме (с указанием только тех ионов, которые непосредственно взаимодействуют между собой). При написании уравнений реакций в ионной форме формулы малодиссоциирующих веществ (слабых электролитов) записывают в молекулярной форме.
Уравнения реакций обмена в водных растворах электролитов составляют так.
- Записывают в левой части уравнения все формулы веществ, вступивших в реакцию, в молекулярной или ионной форме.
- Руководствуясь знаниями физико-химических свойств реагентов и таблицами растворимости веществ, составляют формулы продуктов реакции.
- Проверяют число атомов каждого элемента в обеих частях уравнения и определяют необходимые стехиометрические коэффициенты перед формулами.
Реакции ионного обмена в растворах электролитов протекают практически необратимо и до конца, если в качестве продуктов образуются осадки (малорастворимые вещества), газы (легколетучие вещества), слабые электролиты (малодиссоциированные соединения) и комплексные ионы.
Если при взаимодействии растворов электролитов не образуется ни одно из указанных видов соединений, химическое взаимодействие практически не происходит.
Уравнения обменных реакций можно записать в молекулярной форме, полной ионной форме, с указанием всех существующих в растворе ионов и в сокращённой ионной форме, которая, собственно, и выражает взаимодействие ионов. Следует отметить, что при написании уравнений реакций в ионной форме малодиссоциирующие вещества (слабые электролиты) записывают в молекулярной форме.
Пример 1. Реакция между нитратом свинца и сульфатом калия. В результате этой реакции образуется нерастворимый сульфат свинца и выделяется растворимый нитрат калия:
(полная ионно-молекулярная форма),
(сокращённая ионно-молекулярная форма).
Пример 2. Взаимодействие карбоната натрия с серной кислотой. При этом выделяется углекислый газ и вода, а в растворе остаются катионы натрия и сульфат-ионы:
(полная ионно-молекулярная форма),
(сокращённая ионно-молекулярная форма).
Пример 3. Реакция между азотной кислотой и едким калием. В результате данной реакции образуется малодиссоциированное соединение — вода и в растворе остаются катионы калия и нитрат-ионы:
(полная ионно-молекулярная форма),
(сокращённая ионно-молекулярная форма).
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Тренировочные задания
1. Осадок образуется при взаимодействии водных растворов
2. Газ выделяется при взаимодействии водных растворов
3. Краткое ионное уравнение H + + OH – = H2O описывает взаимодействие
1) гидроксида кальция и фосфорной кислоты
2) гидроксида лития и фосфорной кислоты
3) гидроксида натрия и бромоводородной кислоты
4) гидроксида алюминия и бромоводородной кислоты
4. Краткое ионное уравнение 3Ba 2+ + 2PO4 3– = Ba3(PO4)2↓ описывает взаимодействие
1) карбоната бария и фосфорной кислоты
2) карбоната бария и фосфата натрия
3) хлорида бария и фосфорной кислоты
4) хлорида бария и фосфата натрия
5. Краткое ионное уравнение Ba 2+ + SO4 2– = BaSO4↓ описывает взаимодействие
1) хлорида бария и сульфата натрия
2) хлорида бария и сернистой кислоты
3) гидроксида бария и сульфата натрия
4) гидроксида бария и серной кислоты
6. Краткое ионное уравнение Ag + + Cl – = AgCl↓ описывает взаимодействие
1) хлорида кальция и бромида серебра
2) фосфата серебра и соляной кислоты
3) карбоната серебра и хлорида натрия
4) нитрата серебра и хлорида калия
7. Краткое ионное уравнение H + + OH – = H2O отвечает взаимодействию
1) азотной кислоты и гидроксида железа (III)
2) бромоводородной кислоты и гидроксида натрия
3) азотной кислоты и гидроксида меди
4) сернистой кислоты и гидроксида кальция
8. Краткое ионное уравнение 2Н + + S 2– = Н2S↑ отвечает взаимодействию
1) соляной кислоты и сульфида железа (II)
2) сернистой кислоты и сульфида калия
3) азотной кислоты и сульфида меди
4) азотной кислоты и сульфида натрия
9. Краткое ионное уравнение 2Н + + CO3 2– = CO2↑ + H2O отвечает взаимодействию
1) соляной кислоты и карбоната кальция
2) сернистой кислоты и карбоната бария
3) азотной кислоты и карбоната калия
4) серной кислоты и карбоната бария
10. Краткое ионное уравнение 2Н + + CaCO3 = Ca 2+ + CO2↑ + H2O отвечает взаимодействию
1) соляной кислоты и карбоната кальция
2) сернистой кислоты и карбоната кальция
3) фосфорной кислоты и карбоната кальция
4) серной кислоты и карбоната кальция
11. Краткое ионное уравнение Al 3+ + 3OH – = Al(OH)3↓ отвечает взаимодействию
1) сульфата алюминия и гидроксида кальция
2) сульфата алюминия и гидроксида бария
3) сульфата алюминия и гидроксида меди
4) сульфата алюминия и гидроксида натрия
12. Краткое и полное ионное уравнения совпадают для реакции
1) соляной кислоты и карбоната калия
2) уксусной кислоты и карбоната бария
3) уксусной кислоты и гидроксида калия
4) серной кислоты и гидроксида калия
13. Одновременно в растворе не могут существовать ионы
1) Ba 2+ , Fe 2+ , PO4 3– , CO3 2–
2) Ba 2+ , NO3 – , Cl – , K +
3) CH3COO – , Li + , Br – , Al3 +
4) Mg 2+ , Br – , K + , Cl –
14. Одновременно в растворе могут существовать ионы
1) Ba 2+ , Fe 2+ , PO4 3– , SO4 2–
2) Ba 2+ , SO4 2– , Ca 2+ , PO4 3–
3) Na + , Ba 2+ , NO3 – , Cl –
4) Mg 2+ , Ca 2+ , SO3 2– , CO3 2–
15. Образование осадка происходит при взаимодействии водных растворов
16. Образование газа происходит при взаимодействии водных растворов
1) сульфата калия и хлорида бария
2) гидроксида алюминия и серной кислоты
3) хлорида кальция и карбоната натрия
4) соляной кислоты и карбоната натрия
17. С выпадением осадка протекает реакция ионного обмена между растворами
1) нитрата натрия и фторида калия
2) хлорида алюминия и избытка гидроксида калия
3) нитрата серебра и фторида натрия
4) нитрата магния и гидроксида калия
18. С выделением газа протекает реакция ионного обмена между растворами
1) карбоната калия и бромоводородной кислоты
2) сульфата натрия и гидроксидом калия
3) нитрата серебра и бромида цинка
4) нитрата алюминия и гидроксида бария
19. С выделением газа протекает реакция ионного обмена между растворами
1) гидроксида бария и азотной кислоты
2) сульфата алюминия и нитрата бария
3) нитрата серебра и йодида лития
4) азотной кислотой и карбоната аммония
20. С выделением воды протекает реакция ионного обмена между растворами
1) нитрата меди и хлорида железа
2) гидрокарбоната натрия и гидроксида натрия
3) нитрата ртути и бромида лития
4) нитрата аммония и нитрита натрия
🔍 Видео
Химия | Молекулярные и ионные уравненияСкачать

Реакции ионного обмена. 9 класс.Скачать

Ионные уравнения. Практика. Химия ОГЭ. Видеоурок 16Скачать

9 класс. ОГЭ. Химия. Задание 14. Реакции ионного обмена.Скачать

Задание 13. Диссоциация, как писать уравнения диссоциации? | Химия ОГЭ | УмскулСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания | Как составлять молекулярные и ионные уравненияСкачать

Задание 13: Все про электролитическую диссоциацию на ОГЭСкачать

ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать

Химия. Молекулярные и ионные уравненияСкачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Вся химия 9 класса одном урокеСкачать

Реакции ионного обмена: от простых реакций до самых жёстких заданий на ЕГЭ! | Химия ЕГЭ | УмскулСкачать

Химия.Ионные уравнения. Химия 9класс. Подготовка к огэ.Скачать

Реакция ионного обмена. Полное и сокращенное ионное уравнение. Практика. Видеоурок 39. Химия 9 классСкачать