CoCl2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Видео:Гидролиз солей. 9 класс.Скачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
CoCl2 + HOH ⇄ CoOHCl + HCl
Полное ионное уравнение
Co 2+ + 2Cl — + HOH ⇄ CoOH + + Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
Co 2+ + HOH ⇄ CoOH + + H +
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
CoOHCl + HOH ⇄ Co(OH)2 + HCl
Полное ионное уравнение
CoOH + + Cl — + HOH ⇄ Co(OH)2 + H + + Cl —
Сокращенное (краткое) ионное уравнение
CoOH + + HOH ⇄ Co(OH)2 + H +
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Среда и pH раствора хлорида кобальта (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: нитрат свинца (II), карбонат калия. Какие значения pH имеют растворы их солей?
Решение:
Нитрат свинца (II) Pb(NO3)2– соль слабого двухкислотного основания и сильной кислоты. Катионы слабого основания Pb 2 + связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Pb 2 + + H2O 
полное ионно-молекулярное уравнение:
Pb 2+ + 2NO3 — + H2O 
Pb(NO3)2+ H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 2– связывают ионы водорода из воды, образуя анионы кислой соли HCO3 — . Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
CO3 2– + H2O 
полное ионно-молекулярное уравнение:
2K + + CO3 2– + H2O 
K2CO3 + H2O 
Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7).
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: хлорид цинка, сульфит натрия. Какие значения pH имеют растворы этих солей?
Решение:
Хлорид цинка ZnCl2– соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли ZnOH + .
Сокращенное ионно-молекулярное уравнение гидролиза:
Zn 2+ + H2O 
полное ионно-молекулярное уравнение:
Zn 2+ + 2Cl — + H2O 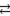
ZnCl2+ 2H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 2– связывают ионы водорода из воды, образуя анионы кислой соли HSO3 — . Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
SO3 2– + H2O 
полное ионно-молекулярное уравнение:
2Na + + SO3 2– + H2O 
Na2SO3 + H2O 
Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7).
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей хлорид кобальта (II), нитрат алюминия. Какие значения pH имеют растворы этих солей?
Решение:
Хлорид кобальта (II) CoCl2– соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли CoOH + .
Сокращенное ионно-молекулярное уравнение гидролиза:
Co 2+ + H2O 
полное ионно-молекулярное уравнение:
Co 2+ + 2Cl — + H2O 
CoCl2+ 2H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 3+ связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Al 3+ + H2O 
полное ионно-молекулярное уравнение:
Al 3+ + 3NO3 — + H2O 
Al(NO3)3+ H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Пособие-репетитор по химии
ЗАНЯТИЕ 7
10-й класс (первый год обучения)
Продолжение. Начало см. в № 22,/2005; 1, 2, 3, 5, 6/2006
План

2. Гидролиз солей различных типов.
3. Обратимый и необратимый гидролиз.
Слово «гидролиз» (от греч. 

Гидролизом соли называют взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. Сущность процесса гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами или ионами водорода из молекул воды. В результате этого взаимодействия образуется слабый электролит. Химическое равновесие процесса диссоциации воды смещается вправо, в сторону образования ионов. Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН – , что и определяет среду раствора соли. При разбавлении раствора или при повышении температуры степень гидролиза увеличивается.
Любую соль можно представить как продукт реакции нейтрализации. В зависимости от силы исходных кислоты и основания различают 4 типа солей. Гидролиз солей разных типов протекает по-разному и дает различную среду раствора.
Соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по анионному типу, среда раствора – щелочная (рН > 7), например:
СН3СООNa + HOH 
СН3СОО – + HOH 
В том случае, когда соль образована слабой многоосновной кислотой и сильным основанием, гидролиз по аниону протекает ступенчато и число ступеней гидролиза зависит от основности слабой кислоты. На первых ступенях гидролиза образуется кислая соль (вместо кислоты) и сильное основание, например:
Na2SO3 + HOH 
SO3 2– + HOH 
NaHSO3 + HOH 
HSO3 – + HOH 
Na2SO3 + 2HOH 
SO3 2– + 2HOH 
Соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катионному типу, среда раствора – кислая (рН + + HOH 
Если соль образована слабым многокислотным основанием и сильной кислотой, катионный гидролиз протекает cтупенчато в зависимости от кислотности слабого основания. Вместо основания на первых ступенях такого гидролиза образуется основная соль, например:
ZnCl2 + HOH 
Zn 2+ + HOH 
Zn(OH)Cl + HOH 

Zn(OH) + + HOH 

ZnCl2 + 2HOH 

Соль, образованная слабым основанием и слабой кислотой, гидролизуется одновременно и по катиону, и по аниону. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной, в зависимости от степени диссоциации продуктов гидролиза, например:
(NH4)2CO3 + 2HOH 
2NH4 + + СО3 2– + 2НОН 
Соль, образованная сильным основанием и сильной кислотой, гидролизу не подвергается, т.к. в процессе реакции не образуется слабый электролит; среда раствора при этом нейтральная, например:
NaCl + HOH 
Для большинства солей гидролиз является обратимым процессом, однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз – необратимый процесс. Необратимому гидролизу подвергаются соли, образованные слабым нерастворимым или летучим основанием и слабой нерастворимой или летучей кислотой. Такие соли не могут существовать в водных растворах (Аl2S3, Fe2(СО3)3 и т.п.), например:
Al2S3 + 6HOH = 2Al(OH)3 

Из-за необратимого гидролиза в реакциях обмена между водными растворами двух солей не всегда образуются новые соли. В таких случаях необходимо учитывать реакции гидролиза исходных солей. Например, при взаимодействии водных растворов сульфида калия и хлорида алюминия сначала протекают обменные реакции исходных реагентов с водой, а потом – продуктов реакции между собой. Процесс описывается суммарным уравнением реакции:
3К2S + 2AlCl3 + 6H2O = 2Al(OH)3 

Тест по теме «Гидролиз солей»

а) А – хлорид натрия, В – нитрат серебра;
б) А – нитрат бария, В – фосфорная кислота;
в) А – хлорид меди(II), В – уксусная кислота;
г) А – фторид натрия, В – хлорид бария.
2. Сумма коэффициентов в уравнении реакции между водными растворами нитрата хрома(III) и сульфида натрия равна:
а) 19; б) 12; в) 6; г) 22.
3. Газ выделяется при смешивании растворов хлорида хрома(III) и:
а) гидросульфида аммония;
б) гидроортофосфата калия;
в) гидросульфата натрия;
г) силиката натрия.
4. В четырех пробирках находятся водные растворы перечисленных ниже солей. Раствор какой соли можно отличить от других с помощью лакмуса?
а) бромид алюминия; б) сульфат цинка;
в) нитрат свинца; г) силикат калия.
5. Гидролиз протекает при растворении в воде:
а) бромида кальция; б) фосфата кальция;
в) нитрита кальция; г) ацетата кальция.
6. Гидролизу по аниону подвергается соль:
а) хлорид бария; б) нитрит калия;
в) хлорид аммония; г) фосфат натрия.
7. Цинк будет растворяться при погружении его в раствор:
а) хлорида натрия; б) хлорида бария;
в) хлорида алюминия; г) хлорида калия.
8. Пара веществ, в растворе которых фиолетовый лакмус изменяет окраску на красную и синюю, соответственно:
а) карбонат натрия и сульфит калия;
б) сульфат цинка и бромид алюминия;
в) хлорид никеля(II) и нитрит бария;
г) нитрат натрия и хлорид кальция.
9. Гидролиз невозможен для следующей группы соединений:
а) оксиды; б) нитриды;
в) фосфиды; г) гидриды.
10. Подавить гидролиз сульфата магния можно:
а) разбавлением раствора;
б) нагреванием раствора;
в) добавлением раствора серной кислоты;
г) добавлением раствора гидроксида натрия.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| а, б | г | а | г | в, г | б, г | в | в | а | в |
Задачи и упражнения по теме «Гидролиз солей»

Гидролиз солей
| Гидролизуются соли (формулы солей) | Растворы с рН | Уравнения гидролиза (молекулярные и ионные) солей с рН |
|---|---|---|
| CoCl2, . | CoCl2, . | CoCl2 + H2O  CoOHCl + HCl, CoOHCl + HCl, |
| . | . | Co 2+ + 2Cl – + H2O  |
| . | . |  CoOH + + H + + 2Cl – , CoOH + + H + + 2Cl – , |
| . | . | . |
Уравнения гидролиза солей с рН 3+ + H2O 
2Fe(OH)SO4 + 2H2O 
Fe(OH) 2+ + H2O 
[Fe(OH)2]2SO4 + 2Н2О 

Fe(OH)2 + + Н2О 

Ni(OH)NO3 + H2O 

NiOH + + H2O 

2. Составьте молекулярные уравнения гидролиза солей на основании сокращенных ионных уравнений:
а) Cr 3+ + H2O = CrOH 2+ + H + ;
б) Fe 2+ + H2O = FeOH + + H + ;
в) Al 3+ + H2O = AlOH 2+ + H + ;
г) Сu 2+ + H2O = CuOH + + H + .
Молекулярные уравнения гидролиза:
а) CrCl3 + H2O 
б) Fe(NO3)2 + H2O 
в) AlCl3 + H2O 
г) СuBr2 + H2O 
3. Опишите процессы, происходящие при сливании водных растворов следующих солей:
а) нитрат хрома(III) и сульфид натрия;
б) хлорид алюминия и сульфид натрия;
в) сульфат железа(III) и карбонат натрия;
г) сульфат алюминия и сульфид аммония;
д) хлорид железа(III) и карбонат аммония.
Обмен и гидролиз одновременно:
а) 2Cr(NO3)3 + 3Na2S + 6H2O = 2Cr(OH)3 

б) 2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 

в) Fe2(SO4)3 + 3Na2CO3 + 3H2O = 2Fe(OH)3 

г) Al2(SO4)3 + 3(NH4)2S + 6H2O = 2Al(OH)3 

д) 2FeCl3 + 3(NH4)2CO3 + 3H2O = 2Fe(OH)3 

4. При добавлении к водному раствору вещества А раздельно аммиака, сульфида натрия и нитрата серебра образуются белые осадки, причем два из них – одинакового состава. Определите вещество А.
5. При добавлении к водному раствору вещества А раздельно сульфида калия, аммиака и хлорида бария образуются осадки. В первом и втором случае – серо-зеленого цвета одного состава, в третьем случае – белый кристаллический. Определите вещество А.
Задачи
1. К 50 г раствора карбоната натрия с массовой долей растворенного вещества 10,6% прилили избыточное количество раствора сульфата алюминия. Какой газ выделяется при этом? Каков объем (н.у.) этого газа?
2. Вычислите относительную плотность по воздуху и по гелию газа, выделяющегося при гидролизе нитрида магния.
3. Вычислите относительную плотность по воздуху и по неону газа, выделяющегося при гидролизе фосфида кальция.
4. Гидроксид алюминия массой 11,7 г обработали раствором серной кислоты объемом 45 мл с молярной концентрацией 5 моль/л. Какая реакция среды будет у полученного раствора?


Мольные соотношения реагентов отвечают стехиометрическим коэффициентам: 0,15/2 = 0,225/3.
Однако среда раствора не нейтральная, а кислая, т.к. протекает гидролиз соли Al2(SO4)3:
Al2(SO4)3 + 6НОН 

📹 Видео
Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Реакции ионного обмена. 9 класс.Скачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Получение комплексных соединенийСкачать

Всё про ГИДРОЛИЗ для ЕГЭ ПО ХИМИИ. с ЭКСПЕРИМЕНТАМИ!Скачать

Электролиз. 10 класс.Скачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Гидролиз солей. 10 класс.Скачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

Реакции ионного обмена. 9 класс.Скачать

Гидролиз солейСкачать

Гидролиз солей.ПримерыСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

76. Гидролиз солей (часть 1)Скачать
