Во всех системах, отвечающих электродам I, II и III рода, одним из компонентов восстановленной формы выступает металл электрода.
Окислительно-восстановительные – это такие электроды, материал которых не принимает участие в электродной реакции, а лишь является передатчиком электронов между окислителем и восстановителем, находящимися в одном растворе. Такой электрод состоит из инертного металла (например, платины), погруженного в раствор, содержащий частицы какого-либо вещества двух разных степеней окисленности и называют его окислительно-восстановительным.
Окислительно-восстановительные электроды бывают простыми и сложными. На простых электродах Red, Ox / Ptэлектродная реакция сводится к перемене зарядности ионов без изменения их состава:


Примером такого электрода может служить Pt, погруженная в раствор, содержащий FeCl2 и FeCl3. Уравнение электродной реакции:


Продукты окисления и восстановления остаются в растворе, а не выделяются на электроде. Потенциал этого электрода зависит от соотношения концентраций окислительных (Fe 3+ ) и восстановительных (Fe 2+ ) частиц. Чем больше 

На сложных электродах реакция протекает с изменением зарядности ионов и их состава. В реакции обычно участвует вода и ионы водорода: Red, Ox, H + / Pt.
Примером такого сложного окислительно-восстановительного электрода является хингидронный электрод, который используется для определения концентрации водородных ионов. Это платина, погруженная в раствор, насыщенный спиртовым раствором хингидрона или порошкообразным хингидроном.
Хингидрон – эквимолекулярное соединение хинона C6H4O2 и гидрохина C6H4(OH)2. Это вещество мало растворимо в воде и при растворении распадается на хинон и гидрохинон.
Гидрохинон –слабая кислота и диссоциирует на ионы:

Ион гидрохинона может окисляться в хинон

Суммарная реакция выражается уравнением


Отсюда видно, что потенциал окислительно-восстановительного электрода зависит от активности ионов водорода Н + в растворе.
Газовые электроды.
Это электроды, состоящие из металлического проводника, контактирующего одновременно с газом и с раствором, содержащим ионы этого газа. Металлы в этих электродах используются не любые, а те, которые обладают высокой каталитической активностью. Являясь катализатором реакции, металл должен быть инертным к различным побочным реакциям и обладать хорошо развитой поверхностью, чтобы адсорбировать газ. Металл должен обеспечивать электроно-проводящий контакт между газом и раствором ионов. Всем этим требованиям удовлетворяет платина (Pt), покрытая электролитической платиновой чернью для создания развитой поверхности.
Молекулы газа адсорбируются на поверхности металла, распадаясь при этом на атомы, а атомы участвуют уже непосредственно в электродном процессе.
Наиболее распространен водородный электрод, обратимый относительно катиона. Это электрод из платинированной (черненой) платины, продуваемой газообразным водородом и погруженной в водный раствор электролита, содержащего ионы продуваемого газа (водорода).

Водород, как и металл, легко отдает свой электрон и энергично взаимодействует с водой, давая гидратированный ион водорода в водном растворе. Поэтому на поверхности электрода устанавливаются равновесия:



В упрощенном виде можно записать:

На это равновесие влияет как активность ионов водорода в растворе, так и давление газообразного водорода. В соответствии с уравнением реакции, чем больше давление водорода, тем сильнее равновесие сдвинуто вправо, тем больше образуется ионов водорода и больше электронов накапливается на металле, и тем отрицательнее потенциал электрода. И наоборот, чем больше активность ионов водорода в растворе, тем сильнее равновесие сдвинуто влево, тем больше ионов превращается в атомы, забирая для этого электроны от металла, и тем более положительный потенциал электрода.
Другой газовый электрод – хлорный. Это платиновый электрод, омываемый потоком газообразного хлора и погруженный в раствор электролита, содержащий ионы хлора (Cl – ).
В этом случае на поверхности электрода также протекают процессы, приводящие к образованию двойного электрического слоя, и скачка потенциала.

Атомы хлора, заимствуя электрон у металла электрода и гидратируясь, образуют гидратированные ионы хлора в водном растворе:


Таким образом, процессы, протекающие на поверхности электрода, могут быть выражены суммарным уравнением:


В упрощенном виде записывается следующим образом:


Чем больше давление газообразного хлора, тем сильнее это равновесие смещается вправо, т.е. тем больше образуется ионов хлора, тем больше электронов отбирается от металла, тем положительнее равновесный потен-циал электрода, т.к. в процессе, приводящем к возникновению электрод-ного потенциала хлорного электрода, участвуют отрицательные ионы (анионы хлора). Хлорный электрод относят к электродам, обратимым относительно аниона.
Кислородный электрод по устройству аналогичен водородному электроду: Н2О, ОН – / О2, Ме.
В щелочной среде будет протекать следующий электродный процесс:




В реальных условиях практически создать кислородный электрод не удается, т.к. в этих условиях металлы под действием кислорода окисляют-ся, и электрод частично представляет собой металлоксид.
В кислой среде системе Н2О, Н + / О2, Ме отвечает электродный процесс:




Потенциал кислородного электрода, как в щелочной, так и в кислой среде, зависит от рН раствора.
Выяснение механизма реакций на кислородном электроде, а также практическое его использование представляет собой сложную теоретичес-кую и экспериментальную задачу. Однако кислородный электрод имеет большое значение, так как используется в топливных элементах.
Амальгамные электроды.
Амальгамные электроды состоят из амальгамы данного металла в контакте с раствором, содержащим ионы этого металла. Амальгамный электрод можно представить схемой:
Ему отвечает электродная реакция:


Примером может служить амальгамный кадмиевый электрод Cd 2+ / Cd(Hg), с электродной реакцией:


который используется в стандартном элементе Вестона, часто применяемом в лабораторной практике.
Ионселективные электроды.
Большую группу электродов составляют ионселективные электроды, чувствительные к определенному иону. В качестве мембран в электрохимических цепях используются разнообразные материалы, в том числе и стекло. Так, например, стеклянный электрод широко применяется для определения рН растворов.
Он представляет собой стеклянную трубку, заканчивающуюся тонкостенным стеклянным шариком, внутрь которого залит стандартный раствор с определенным значением рН, а в раствор погружен метал-лический электрод. Часто применяют 0,1 н раствор соляной кислоты и серебряный электрод, покрытый слоем хлорида серебра. Стеклянный электрод опускают в исследуемый раствор, рН которого требуется определить, и измеряют потенциал этого электрода относительно каломельного электрода сравнения. Общая схема электрохимической цепи для определения рН при помощи стеклянного электрода имеет вид:


В последние годы, благодаря использованию ферментов, функции ионселективных электродов расширились и стало возможным быстрое клиническое определение глюкозы, мочевины аминокислот и других метаболитов. Такие электроды называются ферментными или электро-химическими сенсорами.
ЭЛЕКТРОХИМИЧЕСКИЕ ЦЕПИ И
ЭЛЕКТРОДВИЖУЩАЯ СИЛА (ЭДС)
Типы гальванических цепей
Электрохимическая цепь (или гальваническая цепь) представляет собой систему, состоящую из различных фаз, через границу раздела которых переходят заряженные частицы, что вызвано стремлением систе-мы к термодинамическому равновесию.
Существуют разные классификации гальванических цепей (г.ц.). При этом обычно используют два признака:
1) по источнику электрической энергии;
2) по наличию или отсутствию в цепи границы двух различных растворов: соответственно цепи с переносом и без переноса (рис. 7.17).
Если источником электрической энергии служит различие в физическом состоянии двух одинаковых по своему химическому составу электродов – это физические цепи. Эти электроды погружены в один и тот же раствор и при работе цепи электрод, находящийся в менее устойчивом состоянии, переходит в более устойчивое состояние. Это цепи без переноса. Физические цепи бывают аллотропические и гравитационные.
Аллотропические–это цепи, в которых менее устойчивое состояние одного электрода обусловлено тем, что он изготовлен из метастабильной модификации данного металла.
Гравитационные цепи были впервые реализованы в 1875 г. электрохимиком Р.А. Колли и составлены из двух ртутных электродов разной высоты в растворе соли Hg2(NO3)2. В результате двух электродных процессов:

(на правом электроде) 1 /2Hg2 2+ + 
происходит перенос металлической ртути из левой в правую часть и процесс направлен на выравнивание уровней ртути.
Гравитационные цепи не имеют практического значения, т. к. имеют малую величину ЭДС.
             |
При схематической записи г.ц., а также уравнений, протекающих в них реакций, необходимо соблюдать следующее правила:
– для электродов (полуэлементов): слева от черты указывают вещества, находящиеся в растворе, а справа – вещества, образующие другую фазу или электродный материал.
Например: Cu 2+ /Cu; Cd 2+ /Cd(Hg);
– если одна фаза содержит несколько веществ, то их символы разделяются запятыми.
Cl – /AgCl, Ag; Co 3+ , Co 2+ / Pt;
– уравнение электродной реакции записывают так, чтобы слева располагались вещества в окисленной форме и электроны, а справа – вещества в восстановленной форме:









а две сплошные черты - в случае наличия между двумя электролитами солевого мостика:

Различают обратимые и необратимые г.ц.
1. Обратимые гальванические цепи – цепи, в которых при изменении направления тока меняется направление токообразующейреакции. Например, рассмотрим элемент Якоби – Даниэля. Запишем схему этой гальванической цепи:
Цинк стоит в ряду напряжения значительно левее меди и имеет стандартный потенциал, равный – 0,76В (jCu 0 = +0,348В). Это значит, что цинк является более активным металлом, легче отдает электроны и переходит в виде ионов в раствор. На электроде остаются валентные электроны. Следовательно, цинк будет заряжен более отрицательно.
При замыкании цепи будут протекать те процессы, которые термодинамически возможны и могут идти самопроизвольно. Тогда электроны потекут от более отрицательного (цинкового) электрода по проводнику к более положительному (медному). Это приводит к нарушению равновесия на обоих электродах, тогда на цинковом электроде потенциал окажется менее отрицательным, чем нужно для сохранения равновесия, и будет происходить процесс растворения цинка:

Потенциал медного электрода при этом становится более отрицательным, чем надо для сохранения равновесия. Тогда на нем пойдет процесс связывания избыточных электронов, т.е. на поверхности электрода будут разряжаться ионы меди:


Таким образом, самопроизвольно протекающие процессы на поверхностях электродов реакции направлены к восстановлению равновесия, а значит, и к поддержанию максимально возможной разности потенциалов между электродами. В целом в цепи будет идти суммарный процесс:
Cu 2+ + 2 
Zn + Cu 2+ Zn 2+ +Cu
Токообразующаяреакция обуславливает наличие разности потенциалов между электродами и поддерживает протекающий во внешней цепи электрический ток.
Изменим направление тока в цепи. Для этого соединим ее с внешним источником тока, у которого ЭДС больше, чем ЭДС рассматриваемой цепи. В этом случае поток электронов от отрицательного полюса внешнего источника тока потечет к цинковому электроду.
Теперь цинковый электрод станет более отрицательным, чем нужно для поддержания равновесия, и на нем потечет процесс связывания избытка электронов, путем разряжения ионов цинка


Потенциал медного электрода окажется положительнее равновесного, следовательно, на нем будет протекать реакция растворения меди:

В целом в цепи потечет реакция, уравнение которой можно найти суммированием





Из рассмотренного выше видно, что если к электродам цепи прило-жить разность потенциалов большую, чем ЭДС цепи, то электрический ток будет проходить в противоположном направлении, и в цепи потечет вынужденная реакция, обратная токообразующей. Следовательно, обрати-мая гальваническая цепь представляет собой систему, которая может работать термодинамически обратимо.
2. Необратимые цепи – это цепи, в которых при изменении направления тока не происходит обращения токообразующей реакции, а протекает другая химическая реакция.
В качестве примера необратимой цепи может служить цепь Вольта, которая состоит из цинкового и медного электродов, погруженных в раствор серной кислоты
Если электроды замкнуть металлическим проводником, то цепь может работать самопроизвольно. Электроны с цинкового электрода переходят на медный. Потенциал медного электрода становится все отрицательнее до тех пор, пока при какой-либо химической реакции электроны не начнут связываться. Ионов меди в растворе нет, поэтому такой реакцией будет реакция разряжения ионов водорода:



На цинковом электроде будет идти процесс растворения цинка с отрывом электронов от атомов и с образованием ионов цинка:

За счет этих процессов будет поддерживаться разность потенциалов и протекающий в цепи ток:


Zn Zn 2+ + 2
2Н + + Zn Н2 + Zn 2+
Итак, цинк будет растворяться в серной кислоте, вытесняя водород, который будет выделяться на медном электроде.
Теперь изменим направление тока в цепи, соединив с источником тока, создающим напряжение больше, чем ЭДС цепи. Причем положительный полюс источника тока присоедим к медному электроду, а отрицательный – к цинковому. Ток в цепи потечет в противоположную сторону. Электроны потекут от отрицательного полюса источника тока к цинковому электроду. Потенциал цинкового электрода станет отрицатель-нее, чем до замыкания цепи, и на нем пойдет реакция связывания электронов путем разряжения ионов водорода:



От медного электрода электроны будут течь к положительному полюсу источника тока. Потенциал медного электрода станет более положитель-ным, следовательно, ускорится процесс окисления атомов меди до ионов:

В целом пойдет реакция:






т.е. потечет новая реакция, не являющаяся обратной вышерассмотренной реакции. Очевидно, что необратимые цепи не могут работать равновесно, и, следовательно, реакции, протекающие в них, не могут быть обратимыми в термодинамическом смысле.
Потенциалы необратимых электродов, а значит и ЭДС необратимых цепей, крайне неустойчивы, сильно меняются во времени и неудобны для практического использования.
Все обратимые гальванические цепи делятся на:
1) химические цепи;
3) концентрационные цепи;
1. Химическая гальваническая цепь
Эта гальваническая цепь, в токообразующей реакции которой непосредственно участвуют вещества, из которых изготовлены электроды, или вещества, адсорбированные на них. Химические цепи подразделяют на простые и сложные. В простых химических цепях один электрод обратим относительно катионов электролита, другой – относительно анионов. Примером простой цепи может служить элемент Вестона:
На отрицательном и положительном электродах протекают следующие электродные процессы:



Примером сложной цепи является элемент Якоби – Даниэля:

Химические цепи имеют большое значение в практике, т.к. разные ХИТ представляют собой химические цепи.
2. Окислительно-восстановительной цепью принято называть любую цепь, составленную из окислительно-восстановительных электро-дов. Примером окислительно-восстановительной цепи может служить цепь

Из таблиц стандартных потенциалов известно, что

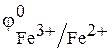
Это значит, что равновесный потенциал левого электрода практически при любых концентрациях четырех ионов (Sn 4+ , Sn 2+ , Fe 3+ и Fe 2+ ) окажется отрицательнее равновесного потенциала правого электрода. В таком случае на левом электроде при замыкании цепи будет идти процесс окисления
Sn 2+ ® Sn 4+ + 2 
а на правом электроде, имеющем более положительный равновесный потенциал, – процесс восстановления:
Fe 3+ + 1 
При сложении этих двух уравнений получают уравнение реакции, протекающей в цепи (токообразующая реакция)
Sn 2+ + 2Fe 3+ ® Sn 4+ + 2Fe 2+
Характерной особенностью окислительно-восстановительной цепи является то, что ее токообразующая реакция протекает в растворе у поверхностей электродов, причем сам материал, из которого изготовлены электроды, участия в ней не принимает, а служит лишь передатчиком электронов.
3. Концентрационной цепью называют гальваническую цепь, на обоих электродах которой идет одна и та же обратимая реакция окисления-восстановления.
Различают два вида концентрационных цепей:
1) Цепи без переноса – это цепи состоящие из одного раствора электролита, в которой помещены два одинаковых электрода, но с разной концентрацией в них активного вещества. Примером такой цепи может служить цепь, составленная из амальгамных электродов
где a1 и a2 – активности кадмия.
Как выбрать активность? Что должно быть больше a1 или a2?
Надо помнить, что чем активнее металл, тем отрицательнее потенциал j. Чтобы правильно составить цепь, надо, чтобы a1 > a2. Если a1 > a2, то электродные процессы на положительном и отрицательном электродах протекают по схеме:
(–) Cd ® Cd 2+ + 2
(+) Cd 2+ + 2 
ЭДС этого концентрационного элемента возникает за счет выравнивания активности кадмия в обеих амальгамах. Соотношение, связывающее ЭДС концентрационной цепи с активностями, делает концентрационные цепи очень удобными для экспериментального определения таких важных величин, как активности и коэффициенты активности ионов и растворимости малорастворимых солей. Примером газового концентрационного элемента может служить элемент
При этом будут наблюдаться электродные процессы при условии, что Р1 > Р2
(–) Н2 ® 2Н + + 2
(+) 2Н + + 2 
ЭДС газового концентрационного элемента без переноса (т.е. без границы двух растворов) получается за счет выравнивания давления водорода на обоих электродах. Таким образом, в цепях без переноса отсутствует граница непосредственного контакта между растворами, т.е. растворы соединены через солевой мостик (при использовании двух растворов электролитов).
2) Цепи (с переносом), состоящие из двух одинаковых электродов, погруженных в раствор одного и того же электролита, но разной концентрации. Электрический ток возникает за счет выравнивания концентраций растворов электролитов, поэтому эти цепи называются цепями с переносом (т.е. имеется граница двух растворов). Например, цепь, составленная из двух серебряных электродов, разделенных пористой перегородкой, чтобы происходила диффузия.

В этом случае a2 > a1. Чем больше концентрация, тем более положительный потенциал электрода. Электродные процессы при этом будут следующие:
(–) Ag 0 ® Ag + +
(+) Ag + + 

Следовательно, в данной концентрационной цепи токообразующим процессом является процесс выравнивания концентраций ионов серебра Ag + . У большинства гальванических цепей ЭДС определяется, главным образом, разностью стандартных потенциалов электродов Dj 0 . Для концентрационной цепи эта величина равна нулю. Поэтому ЭДС концентрационных цепей обычно очень малы. Действительно, из уравне-ния Нернста следует, что даже, если активности ионов у двух электродов цепи различаются в 1000 раз и электроды обратимы относительно однозарядных ионов (z = 1), то ЭДС концентрационной цепи составит при 25 0 С всего 0,177 В.
Малая величина ЭДС концентрационной цепи и необходимость точного ее измерения делает особенно важным полное устранение или точный расчет диффузионного потенциала, возникающего на границе двух растворов в такой цепи.
Хотя ЭДС концентрационных цепей в большинстве случаев очень малы, они имеют большое практическое значение, так как позволяют наиболее просто определять такие важные величины, как коэффициенты активности ионов, растворимости малорастворимых солей, числа переноса и т.д.
3)Газовые цепи состоят из газовых электродов. Они могут быть химическими и концентрационными. Химические цепи состоят из электродов, омываемых разными газами.
Напишем токообразующую реакцию:
на отрицательном электроде: Н2 ® 2Н + + 2


токообразующая реакция: Н2 + Сl2 ® 2Н + + 2Cl –
Следует уметь составлять гальваническую цепь по токообразующей реакции.

Электроду с более высоким значением парциального давления водорода соответствует более отрицательный потенциал, поэтому для этой системы Р1 > Р2 и ЭДС такого элемента без переноса, как указывалось выше, возникает за счет выравнивания давления водорода на обоих электродах.
токообразующая реакция: Н2 + 2Н + ® 2Н + + Н2
электродные процессы: (–) Н2 ® 2Н + + 2
(+) 2Н + + 2 
ЭДС гальванической цепи
Гальваническая цепь или гальванический элемент состоят из последовательно соединенных проводников 1 и II рода (рис. 7.18).
В каждой гальванической цепи имеется несколько границ раздела разных проводящих сред. На каждой из таких границ возникает свой скачок потенциала или гальвани-потенциал. На рис. 7.18 видно, что на границах каждого из металлов с соответствующим электролитом Ме1½Э1 и Ме2½Э2 возникают два электродных потенциала 



 |


Рис. 7.18. Схема гальванической цепи
Она, очевидно, представляет собой алгебраическую сумму всех скачков потенциала цепи, каждый из которых равен разности потенциалов пограничных слоев двух соприкасающихся сред.
Е = 


Заметим, что металлы обладают очень большой электропроводностью, поэтому потенциал в любой точке одного и того же металлического проводника не слишком больших размеров всегда одинаков. Это значит, что сумма контактных потенциалов равна контактному потенциалу на границе металлов, из которых изготовлены электроды гальванической цепи:


Таким образом, ЭДС системы равна:
Е = 



В случае же наличия между двумя электролитами солевого мостика ставятся две сплошные черты:

Абсолютную величину электродного потенциала нельзя рассчитать теоретически и измерить экспериментально, т.к. появляются минимум две границы металл-электролит, что представляет собой добавочные два электролита. Поэтому можно измерить только ЭДС цепи.
Чтобы устранить такое затруднение, введено понятие об относитель-ном электродном потенциале.
Относительный электродный потенциал данного электрода равен электродвижущей силе гальванической цепи, составленной из изучаемого и стандартного водородного электродов, потенциал которого постоянен и принимается равным 0.
Диффузионный потенциал в цепи отсутствует. Потенциал электрода обозначается j. Знак относительного электродного потенциала определяя-ется направлением тока при замыкании цепи, составленной из данного электрода и стандартного водородного. Если электроны текут по металлическому проводнику от изучаемого электрода к водородному, то его потенциал отрицательнее, чем у стандартного водородного, т.е. меньше нуля, и наоборот.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Составление схем электродных процессов на электродах при электролизе солей
Видео:Электролиз. 10 класс.Скачать

Электролиз водного раствора соли хлорида железа (ⅠⅠ)
Задача 152.
Составьте схему электролиза водного раствора FeCl2. Вычислите время, в течение которого должен быть пропущен ток силой I A через раствор, чтобы на катоде выделилось m (г) металла.(восстановление воды не учитывать)
Раствор FeCl2 , катод-угольный, анод-угольный. I = 4 А , m = 2.9 г
Решение:
Е(Fe 2+ /Fe) = 0,44 В;
M(FeCl2) = 126,751 г/моль
Э(FeCl2) = 63,3755 г/?моль.
В водном растворе соль FeCl2 диссоциирует по схеме: FeCl2 = Fe 2+ + 2Cl – . Стандартный электродный потенциал системы
Fe 2+ + 2электрона = Fe 0 (-0,44 В) незначительно положительнее потенциала водородного электрода в нейтральной среде (-0,41В). Поэтому на катоде будет происходить электрохимическое восстановление ионов Fe 2+ и Н2О:
Fe 2+ + 2ē = Fe 0
2Н2О + 2ē = Н2 + 2ОН –
На аноде будет происходить электролитическое окисление ионов хлора с образованием свободных атомов хлора, которые, соединяясь друг с другом, образуют молекулу хлора:
2Cl – — 2ē = 2Cl*
Cl* + Cl* = Cl2
Сложим уравнение катодного и анодного процессов, получим суммарное ионно-молекулярное уравнение:
Fe 2+ + 2Н2О + 2Cl – = 2Fe 0 + Н2↑ + 2ОН – + Cl2↑
На аноде ионы Fe 2+ соединяются с двумя ионами ОН – , образуя нерастворимый гидроксид железа (ⅠⅠ) Fe(OH)2:
Тогда молекулярная форма процесса будет иметь вид:
При гидролизе FeCl2 в водном растворе с инертными электродами образуются металлическое железо, и выделяются газообразный водород и хлор. На катоде будет выделяться металлическое железо и газообразный водород, а на аноде — хлор.
Рассчитаем время электролиза FeCl2, получим:
m = (Э . I . t)/F;
t = (m . F)/(Э . I) = (2,9 . 96500)/(63,3755 . 4) = 48250/324,96 = 1104 c.
Электролиз водного раствора нитрата кадмия
Задача 153.
Электролиз раствора нитрата кадмия с графитовыми электродами и кадмиевым анодом. Опишите электродные процессы на электродах.
Решение:
В водном растворе соль нитрата кадмия диссоциирует по схеме:
1. Электролиз раствор нитрата кадмия с графитовыми электродами
Стандартный электродный потенциал системы Cd 2+ + 2ē = Cd0 (-0,402 В) незначительно отличается от потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, поэтому на катоде протекают одновременно две реакции – образование водорода и выделение кадмия:
Уравнение электролиза будет иметь вид:
2Cd 2+ + 2Н2О = 2Cd 0 + H2↑ + O2↑ + 4Н +
Таким образом, в катодном пространстве будут разряжаться ионы кадмия и молекулы воды при этом на графитовом электроде откладываеся металлический кадмий и выделяется газообразный водород, а в анодном пространстве будет у графитового электрода будет выделяться газообразный водород и будут накапливаться ионы NO3 – и H + . Среда у анода в процессе электролиза Cd(NO3)2 становится кислой.
Суммарная реакция электролиза в молекулярной форме:
2. Электролиз раствора нитрата кадмия с кадмиевым анодом
Так как кадмиевый анод растворим в условиях электролиза соли Cd(NO3)2, то на аноде происходит окисление материала анода. Поэтому при электролизе Cd(NO3)2 с использованием кадмиевого анода на катоде будет выделяться чистый кадмий и водород, а на аноде ионы кадмия не будут разряжаться, и, следовательно, выделение кислорода не наблюдается. В данном случае происходит растворение самого кадмиевого анода, т.е. с анода кадмий в виде ионов Cd 2+ переходит в раствор.
Электродные процессы на электродах:
1|Катод(-): Cd 2+ + 2ē = Cd 0 ;
2H2O + 2ē = H2↑ + 2OH – ;
2|Анод(+): Сd 0 – 2ē = Cd 2+
Уравнение электролиза в ионно-молекулярном виде:
Сd 2+ + 2H2O + 2Cd 0 = Cd 0 + 2Cd 2+ + H2↑ + 2OH –
После приведения членов в обеих частях равенства получим:
Ионы кадмия Cd 2+ у анода будут соединяться с ионами ОН-, образуя малорастворимое основание Cd(OH)2:
Суммарная реакция электролиза в молекулярной форме:
Электролиз водного раствора соли хлорида меди (Ⅰ)
Задача 154.
Составить схему электролиза соли CuCl. Рассчитать массу меди, выделившейся при электролизе соли CuCl, если в течении 40 минут пропущен ток силой 3 А.
Решение:
Mэ(CuCl) = 98,999 г/моль;
I = 3 A;
t = 40 мин = 2400 с.
1. Электродные процессы
Медь находятся в ряду активности металлов «после водорода», значит на катоде будет протекать реакция восстановления только меди:
Стандартный электродный потенциал системы Cu + + 1ē = Cu 0 (+0,52 В) значительно положительнее потенциала водородного электрода в нейтральной среде (-0,41В). Поэтому на катоде будет происходить электрохимическое восстановление ионов меди:
Так как стандартный электродный потенциал системы 2H2O — 4ē = O2↑ + 4OH – и 2Cl – + 2ē = Cl2, соответственно, равны 1,23В и 1,36 B, то на
аноде будет: 2Cl – + 2ē = Cl2.
Схема электролиза соли CuCl с использованием графитовых электродов:
2|Катод: Cu + + 1ē = Cu 0
1|Анод: 2Cl – + 2ē = Cl2.
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2Cu + + 2Cl – = 2Cu 0 + Cl2
катод анод
Таким образом, при электролизе водного раствора CuCl с использованием графитовых электродов на катоде выделяется металлическая медь, а на аноде — газзобразный хлор.
2. Вычисление количества полученной меди
Для вычисления массы меди используем выражение из первого закона электролиза Фарадея:
m(B) = [M(Э)•I•t]/F = M(Э)•q, где
m(B) — масса выделяемого веществав; M(Э) — электрохимический эквивалент (молярная масса эквивыалента вещества); I – сила тока; t – время; F — число Фарадея (96500 Кл/моль); q — количество электричества.
Тогда
m(CuCl) = [Mэ(CuCl)•I•t]/F = (98,999•3•2400)/96500 = 7,4 г.
Ответ: m(CuCl) = 7,4 г.
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

Электродные процессы
Рабочая программа. Электродные процессы. Равновесие металл – раствор. Двойной электрический слой Электродный потенциал. Стандартный электродный потенциал. Стандартный водородный электрод. Стандартный восстановительный потенциал. Зависимость электродного потенциала от температуры и концентрации. Уравнение Нернста. Ряд напряжений. Восстановительный потенциал как мера окислительной и восстановительной способности.
Окислительно-восстановительный потенциал. Направление окислительно-восстановительных реакций.
Газовые электроды (водородный, кислородный, хлорный).
Кинетика электродных процессов. Поляризация катодная и анодная. Концентрационная и электрохимическая поляризация. Уравнение Тафеля.
Рассмотрим систему (рис.8.1), состоящую из металла 2, погруженного в воду 1. Под действием полярных молекул воды часть ионов металла перейдет в воду. Установится равновесие:
В металле образуется избыток электронов. Металл приобретет отрицательный заряд. Это приведет к появлению вблизи поверхности металла избытка положительно заряженных ионов. Образуется двойной электрический слой. Между металлом и раствором возникнет разность потенциалов. Если ввести в раствор соль этого металла, то равновесие сместится влево. Часть ионов перейдет из раствора на поверхность металла. При этом изменится величина разности потенциалов. Если число ионов, перешедших из раствора на поверхность металла, окажется достаточно большим, то это может привести к смене знака заряда металла. Потенциал двойного электрического слоя, образующегося на границе между металлом и раствором его соли, носит название электродного потенциала, а при стандартной температуре Т=298,15 К и 
 |
Водородный электрод состоит из платины 1, покрытой платиновой чернью, т.е. тонкодисперсной платиной. Платина помещена в раствор серной кислоты. Через раствор пропускают ток водорода. Платиновая чернь очень хорошо растворяет водород. В результате образуется система, состоящая из водорода, растворенного в платине, и ионов водорода в растворе. В системе имеет место равновесие:
Возникает скачок потенциала между платиной и раствором. Если активность ионов водорода равна единице, парциальное давление газообразного водорода составляет 101,3 кПа, а Т=298,15 К, то такой электрод называют стандартным водородным электродом. Потенциал стандартного водородного электрода условно принят равным нулю ( 
Для определения потенциалов электродов собирают гальванический элемент, состоящий из стандартного водородного и измеряемого электродов. В схеме гальванического элемента слева записывают водородный электрод, а справа – измеряемый электрод. Например, схема гальванического элемента, состоящего из стандартного водородного электрода и цинкового электрода, запишется как
Символ «Pt» обозначает индифферентный (химически инертный) платиновый электрод, вертикальная черта означает контакт двух фаз, двойная вертикальная черта − контакт двух отличающихся по составу и концентрации растворов, в данном случае серной кислоты и сульфата цинка; в круглых скобках указывается концентрация раствора. Возможна также сокращенная запись, в которой не указываются частицы, не участвующие в электродных процессах (сульфат-ионы):
Схема элемента, состоящего из стандартного водородного электрода и медного электрода, помещенного в раствор сульфата меди, имеет следующий вид:
При замыкании цепи на электродах будет происходить окислительно-восстановительная реакция. В случае элемента, состоящего из цинкового и водородного электродов, на цинковом электроде пойдет процесс окисления цинка:
а на водородном электроде – восстановление ионов водорода:
Суммарная реакция водородно-цинкового элемента запишется как
Zn + 2H + → Zn 2+ + H2.
В процессе окисления цинка выделяются свободные электроны, которые по внешней цепи переходят к водородному электроду, где используются в процессе восстановления ионов водорода. При работе этого гальванического элемента цинковый электрод заряжается отрицательно и носит название анод, а водородный электрод заряжается положительно и носит название катод. Следовательно, на аноде происходит окисление, а на катоде – восстановление. Во внешней цепи гальванического элемента электроны перемещаются от анода к катоду, во внутренней цепи анионы перемещаются к аноду, т.к. в анодном пространстве происходит накопление избытка катионов цинка, а катионы перемещаются к катоду, поскольку при работе гальванического элемента катионы водорода удаляются из катодного пространства. В результате сохраняется электронейтральность раствора.
ЭДС гальванического элемента, равная разности потенциалов измеряемого электрода при условии, что активность его ионов в растворе равна единице, а Т=298,15 К, и стандартного водородного электрода, носит название стандартного электродного потенциала ( 

а для медно-водородного элемента –

Стандартные электродные потенциалы принято относить к электродным полуреакциям восстановления, и по этой причине их называют стандартными восстановительными потенциалами.
Металлы, расположенные в порядке возрастания их величин стандартных восстановительных потенциалов, называют рядом активности металлов: Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Pd, Pt, Au. Чем отрицательнее значение стандартного восстановительного потенциала металла, тем сильнее его восстановительные свойства. Наоборот, чем положительнее значение стандартного восстановительного потенциала металла, тем сильнее окислительные свойства иона металла. Наиболее сильным восстановителем является литий, а наиболее сильными окислителями являются ионы золота, платины, палладия.
Работа гальванического элемента всегда связана с протеканием окислительно-восстановительной реакции, поэтому стандартный электродный потенциал характеризует окислительно-восстановительные свойства участников реакции. Положительная величина 

Электродные потенциалы могут быть измерены не только для металлических электродов, но и для любой системы окислитель–восстановитель, связанной соотношением
где Ox – окисленная форма вещества; Red – восстановленная форма вещества; ne — – число электронов, принимаемых одной структурной единицей окислителя. В качестве материала электрода обычно используют инертный металл, например платину, погруженную в раствор, содержащий окислитель и восстановитель.
Схема электрода записывается в этом случае следующим образом: Pt|Red,Ox.
Запятая в этой записи означает, что окислитель и восстановитель находятся в одной и той же фазе.
Зависимость величины электродного потенциала от температуры и концентрации описывается уравнением Нернста

где R – универсальная газовая постоянная; Т – температура, К; n – число электронов, принимаемых одной формульной единицей окислителя, F – постоянная Фарадея; aOx и aRed – активности окислителя и восстановителя соответственно; a и b – их стехиометрические коэффициенты.
Если в окислительно-восстановительном процессе участвуют ионы Н + или ОН ‾ , то величина электродного потенциала зависит от рН. Приведем в качестве примера выражение уравнения Нернста для реакции

Активность воды является величиной постоянной и учитывается величиной стандартного восстановительного потенциала. Переходя от натуральных логарифмов к десятичным и подставляя значения универсальной газовой постоянной, стандартной температуры и постоянной Фарадея, можно записать уравнение Нернста в следующем виде:

Восстановительные потенциалы являются мерой окислительной и восстановительной способности. Если для двух любых окислительно-восстановительных полуреакций 
Пример 8.2. Какой из трех окислителей 


Решение. Воспользуемся справочными значениями восстановительных потенциалов следующих реакций:

Из величин стандартных восстановительных потенциалов следует, что только 






Пример 8.3.Указать наиболее сильные окислитель и восстановитель в приведенных ниже парах: Cl2(г)/Сl ‾ ; I2(т)/I ‾ .

Решение. 
Газовые электроды.
1) Водородный электрод. Уравнение Нернста для водородного электрода при стандартной температуре запишется следующим образом:

где 

Учитывая, что стандартный электродный потенциал 


Из формулы (8.5) следует, что при стандартном парциальном давлении водорода потенциал водородного электрода определяется только величиной рН:

2) Кислородный электрод.Устройство кислородного электрода аналогично устройству водородного электрода. Пластинка из инертного металла, например платины, помещается в раствор, содержащий гидроксид-ионы. Через раствор пропускают ток кислорода. Схема кислородного электрода запишется следующим образом:
Процесс восстановления на кислородном электроде протекает по уравнению
Уравнение Нернста для электродного потенциала кислородного электрода при стандартной температуре имеет вид

Активность воды является величиной практически постоянной, и она учитывается стандартным потенциалом кислородного электрода, который равен 0,401 В.
Используя соотношения 


или при стандартном парциальном давлении кислорода

Хлорный электрод.
Устройство хлорного электрода аналогично устройству водородного электрода с той разницей, что в качестве электролита используется раствор соляной кислоты, в который подаётся ток газообразного хлора. Процесс описывается реакцией
Электродный потенциал при стандартном парциальном давлении хлора может быть найден по формуле

Пример 8.4.Вычислить электродный потенциал системы Cu |CuSO4(0,01M) при температуре 25 °С.
Решение. Вычисление электродного потенциала j производим по уравнению Нернста

которое для данной системы запишется следующим образом:
Различиями между активной и аналитической концентрациями пренебрегаем и используем аналитическую концентрацию ионов меди.
Стандартный электродный потенциал меди


Пример 8.5.Вычислить электродный потенциал системы Feú FeSO4(0,1 M) при 25°С, если степень диссоциации сульфата железа равна 60 %.
Решение. Для того чтобы найти электродный потенциал указанной системы, определяем концентрацию ионов Fe 2+ в 0,1 М FeSO4:
где Сэлектр – молярная концентрация электролита; n – число ионов данного вида; a – степень диссоциации электролита.
По уравнению Нернста находим
Стандартный электродный потенциал железа равен –0,44 В. Тогда

Пример 8.6.Вычислить активность ионов Н + в растворе, в котором потенциал водородного электрода равен –82 мВ.
Решение. Из уравнения (8.5) 



Пример 8.7.Определить активность ионов хлора в растворе, в котором электродный потенциал хлорного электрода при 25°С равен 1,3 В. Стандартный потенциал хлорного электрода 1,36 В.
Решение. Для хлорного электрода уравнение Нернста имеет вид
Парциальное давление хлора 
Откуда 
Пример 8.8.Гальванический элемент состоит из металлического цинка, погруженного в 0,1 М раствор нитрата цинка, и металлического свинца, погруженного в 0,02 М раствор нитрата свинца. Вычислить ЭДС элемента, написать уравнения электродных процессов, составить схему элемента. 

Решение. Чтобы определить ЭДС элемента, вычисляем электродные потенциалы по уравнению Нернста:


Находим ЭДС элемента:
Поскольку 
т. е. он будет служить катодом. На цинковом электроде будет протекать процесс окисления:
т.е. этот электрод будет анодом.
Схема рассматриваемого гальванического элемента имеет следующий вид:
Пример 8.9.Какова ЭДС гальванического элемента, состоящего из водородного и кислородного электродов, в растворе с рН=4 при 25°С?
Решение. Уравнение реакции, протекающей на кислородном электроде, со стандартным давлением кислорода в кислой среде запишем в виде
О2 + 4Н + + 4е — Û 2Н2О, 
Потенциал кислородного электрода
Потенциал водородного электрода со стандартным давлением водорода находится по уравнению
Поскольку 
Кинетика электродных процессов. Электрохимическая поляризация. Уравнение Нернста описывает равновесные электродные процессы, т.е. процессы, протекающие в отсутствие электрического тока. Прохождение электрического тока является неравновесным процессом. Эти процессы изучает раздел электрохимии, называемый кинетикой электродных (или электрохимических) процессов.
Прохождение тока вызывает изменение потенциала электрода. Это явление, а также величина изменения потенциала называются электрохимической поляризацией:
где ΔЕ – поляризация; Еi – неравновесный потенциал электрода, т.е. потенциал при прохождении электрического тока; Ep – равновесный потенциал.
Изменение потенциала электрода также называют перенапряжением.
Поляризация имеет место, как на катоде, так и на аноде, поэтому различают катодную (ΔЕк) и анодную(ΔЕа) поляризации. Катодная поляризация всегда отрицательна, а анодная – всегда положительна.

Концентрационная поляризация обусловлена замедленным переносом исходных веществ или конечных продуктов реакций, протекающих на электроде. В результате концентрации исходных веществ в зоне реакции понижаются, а конечных – повышаются. Это смещает равновесие в сторону обратной реакции. Приложение дополнительной разности потенциалов (поляризация) увеличивает скорость переноса компонентов и компенсирует нежелательные процессы. Концентрационная поляризация уменьшается при перемешивании раствора, т.к. это ускоряет выравнивание концентраций компонентов на поверхности электродов.
Электрохимическая поляризация (перенапряжение)обусловлена пониженной скоростью электрохимических реакций на электроде. Согласно современным представлениям наиболее медленной стадией электрохимического процесса является процесс разряда ионов. Это связано с тем, что разряд ионов, как и любая химическая реакция, требует значительной энергии активации и по этой причине скорость процесса может быть мала.
Скорость электрохимических реакций можно увеличить нагреванием и использованием катализатора, а также повышением потенциала электрода по сравнению с его равновесным значением, т.е. при поляризации. Роль поляризации сводится к уменьшению энергии активации, и величина этого снижения пропорциональна величине поляризации. Уменьшение энергии активации сопровождается увеличением скорости реакции, что в случае электрохимических процессов ведет к увеличению плотности тока. Между плотностью тока (i) и электрохимическим перенапряжением (ΔЕэл) существует взаимосвязь, выражаемая уравнением Тафеля
ΔЕэл = a + blgi , (8.12)
где a и b – константы, определяемые опытным путем. Константа а зависит от природы реакции, материала электрода, состава раствора и температуры. Константа bзависит от природы реакции и температуры.
Численные значения констант уравнения Тафеля можно найти в справочных изданиях.
Электрохимическое перенапряжение может быть снижено использованием соответствующих материалов для электродов, а также проведением процессов при повышенных температурах и концентрациях растворов. Использование электродов большой площади снижает плотность тока и также ведет к уменьшению перенапряжения.
Вопросы и задачи для самостоятельной подготовки
1. Опишите механизм возникновения электродного потенциала.
2. Приведите схему стандартного водородного электрода. Опишите его устройство.
3. Запишите выражение уравнения Нернста для процесса:
4. Определите, какое вещество является более сильным восстановителем:
1) Mg или Al ( 
2) H2S или Н2 
3) Ni или Н2О2 
5. Определите, какое из веществ является более сильным окислителем:
1) N2 или Fe 3+ 
2) Ti 3+ или Fe 3+ 
3) Cl2 или HClO
6. Может ли BrO — окислить I — ? 
7. Может ли HBrO окислить Ag? 
8. Может ли 

9. Может ли PbO2 окислить Cl — ? 
10. Может ли 

11. Вычислите электродный потенциал системы Ni|NiSO4 (0,02M) при стандартной температуре.
12. Вычислите электродный потенциал кислородного электрода в растворе с рОН=4 при стандартной температуре.
13. Потенциал водородного электрода составляет 0,236 В. Вычислите активность ионов водорода в растворе.
14. Вычислите электродный потенциал системы Cuú CuSO4(0,1 M) при 25°С, если степень диссоциации сульфата меди равна 50 %.
15. Вычислите электродный потенциал системы Pt| Fe 3+ (0,005M), Fe 2+ (0,1M).
🔍 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

ЭлектролизСкачать

Электрохимия. Гальванический элемент Даниэля-ЯкобиСкачать

25. Схема реакции и химическое уравнениеСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Задачи на гальванический элемент. Продукты в ОВР. Ч.5-4.Скачать

Электрохимический ряд потенциалов. 1 часть. 10 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Учимся составлять электронный баланс/овр/8классСкачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

































