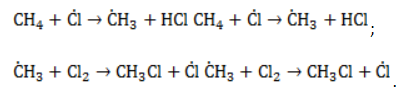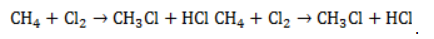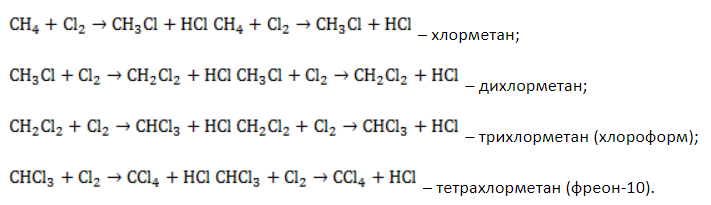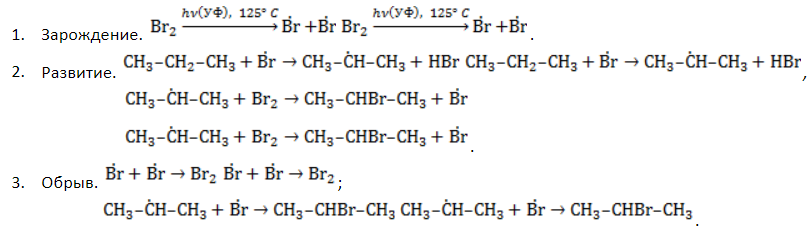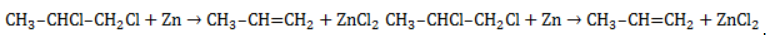Галогенирование – процесс присоединения к молекуле органического соединения атома галогена – это одно из химических взаимодействий, в которых участвуют углеводороды ряда алканов. Благодаря общности структуры молекул у всех членов гомологического ряда реакции с галогеном обладают единым характером. При этом галогенирование пропана и следующих за ним в гомологическом ряду соединений имеет особенности, связанные с наличием в молекулах вторичных, третичных и четвертичных атомов углерода.
- Краткая характеристика алканов
- Галогенирование алканов
- Стадии галогенирования
- Региоселективность
- Хлорирование и бромирование пропана
- Галогенирование бутана
- Реакция отщепления
- Применение галогеналканов
- Пропан: способы получения и химические свойства
- Гомологический ряд пропана
- Строение пропана
- Изомерия пропана
- Химические свойства пропана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование пропана
- 2. Дегидрирование пропана
- 3. Окисление пропана
- 3.1. Полное окисление – горение
- Получение пропана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 3. Гидрирование алкенов и алкинов
- 4. Синтез Фишера-Тропша
- 5. Получение пропана в промышленности
- Химия пропана: технологии преобразования газа
- Производство бытовых сжиженных газов
- Хлорирование пропана – промышленный метод получения перхлорэтилена
- Дегидрирование пропана – способ получения пропилена
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Краткая характеристика алканов
К простейшим органическим соединениям относятся ациклические насыщенные, или предельные углеводороды (алканы). Их отличают следующие структурные особенности:
- неразветвленные (прямые) или разветвленные молекулы, не содержащие циклических образований;
- все химические связи в молекуле – одинарные.
Общая формула имеет вид 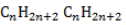
Механизм замещения у алканов носит радикальный характер, так как разрыв слабополярной связи C-H протекает с образованием пары свободных радикалов – нейтральных частиц, имеющих по одному неспаренному электрону. Атом водорода может замещаться галогеном, нитрогруппой или сульфогруппой.
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Галогенирование алканов
Реакция свободно-радикального замещения (обозначается символом SR – от англ. substitution radical reaction) водородного атома в молекуле алкана атомом галогена называется галогенированием. Ее инициирование требует воздействия ультрафиолетового облучения или повышенной температуры. Реакция носит цепной характер, так как в каждом ее акте образуются свободные радикалы, генерирующие следующий акт.
Замещение фтором – фторирование – чрезвычайно экзотермический процесс, сопровождающийся взрывом и разрушением молекулы алкана. Реакция с участием йода, наоборот, является эндотермической и обратимой – в ходе ее происходит восстановление продукта реакции йодоводородом, поэтому прямое йодирование неэффективно. Практический интерес представляют реакции алканов с хлором и бромом.
Стадии галогенирования
Удобнее всего рассмотреть, какой механизм имеет реакция хлорирования алканов, на примере метана. При облучении или нагреве реакционной смеси реакция инициируется, и далее цепная реакция протекает в несколько стадий.
- Зарождение цепи – распад молекулы хлора на активные радикалы:
- Развитие цепи. Взаимодействуя с молекулой метана
, радикал
отщепляет от нее атом водорода с образованием метил-радикала
, который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию:
- Обрыв цепи. Цепной процесс прекращается, когда радикалы реагируют между собой:
В общем виде уравнение галогенирования метана хлором записывается в форме:
Процесс замещения не ограничивается образованием хлорметана, на молекулы которого также воздействуют радикалы 
Выход продуктов зависит от мольного соотношения реагентов и условий реакции. Так, при эквимолярном количестве метана и хлора и температуре 440° C соотношение молярных долей продуктов в процентах составляет около 39:41:19:1.
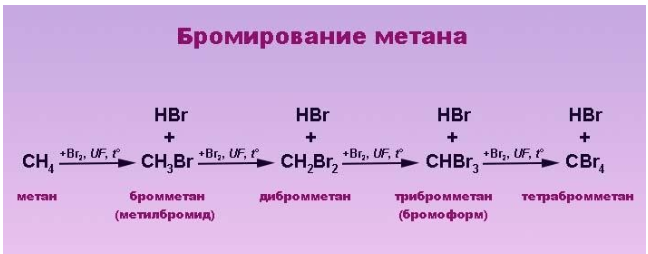
Реакция бромирования отличается меньшим выделением энергии и протекает медленнее, так как его реакционная способность ниже, чем у хлора.
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

Региоселективность
Начиная с пропана 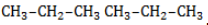
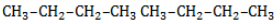
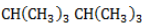
Селективность зависит от следующих факторов:
- Активность реагента. Чем активнее галоген, тем слабее проявляется избирательность при замещении водорода. Так, при взаимодействии алкана с хлором региоселективность значительно меньше, чем в реакциях с бромом, или не наблюдается.
- Температура. Нагревание ведет к снижению селективности.
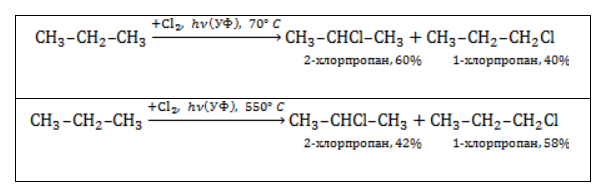
Хлорирование и бромирование пропана
В реакции пропана с хлором при низкой температуре селективная направленность выражена слабо. Несмотря на то, что образующиеся в ходе реакции радикалы 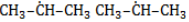
При нагревании радикалы хлора атакуют первичные атомы даже более активно, так как на разрыв их связи с водородом затрачивается меньше энергии.
При бромировании пропана региоселективность вследствие меньшей активности брома достигает высоких значений:
Бромирование протекает аналогично реакции с участием простейших алканов с преимущественным замещением водорода у вторичных атомов:
Продуктом этой реакции является 2-бромпропан.
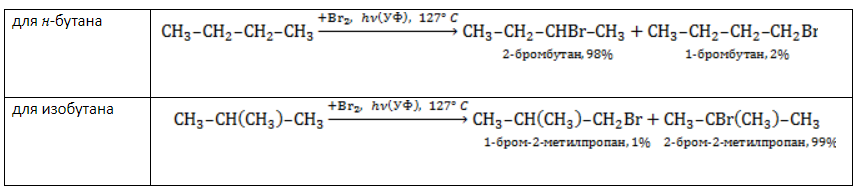
Галогенирование бутана
В реакциях бутана с хлором селективность не играет заметной роли. Даже при низкой температуре соотношение продуктов хлорирования может быть различным:
Бромирование бутана демонстрирует большую селективность:
Видео:Галогенирование алкановСкачать

Реакция отщепления
Активные двухвалентные металлы (как правило, магний или цинк) отщепляют от молекул дигалогеналканов атомы хлора или брома, если они замещают водород у двух соседних атомов углерода. Между последними образуется двойная связь. Продуктом такой реакции является алкен.
Пример реакции дегалогенирования алканов – отщепление цинком атомов хлора от 1,2-дихлорпропана с образованием пропилена (пропена) и хлорида цинка:
Видео:Органическая химия Углеводород Пропан Циклопропан Дегидрирование Гидрирование 10 класс ЕГЭ ВидеоурокСкачать

Применение галогеналканов
Хлорированные и бромированные алканы применяются в качестве промежуточных соединений в различных отраслях, таких как синтез высокомолекулярных соединений, производство лаков, красок и растворителей. Хлоралканы служат сырьем для фторалканов, которые нельзя получить прямым фторированием.
Токсичность галогеналканов тем меньше, чем активнее входящий в их состав галоген. Поэтому фторалканы наиболее безопасны. Фторсодержащие фреоны широко используются в качестве вспенивателей, хладагентов и пропеллентов.
Видео:Серия 8: Хлорирование алкановСкачать

Пропан: способы получения и химические свойства
Пропан C3H8 – это предельный углеводород, содержащий три атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Гомологический ряд пропана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
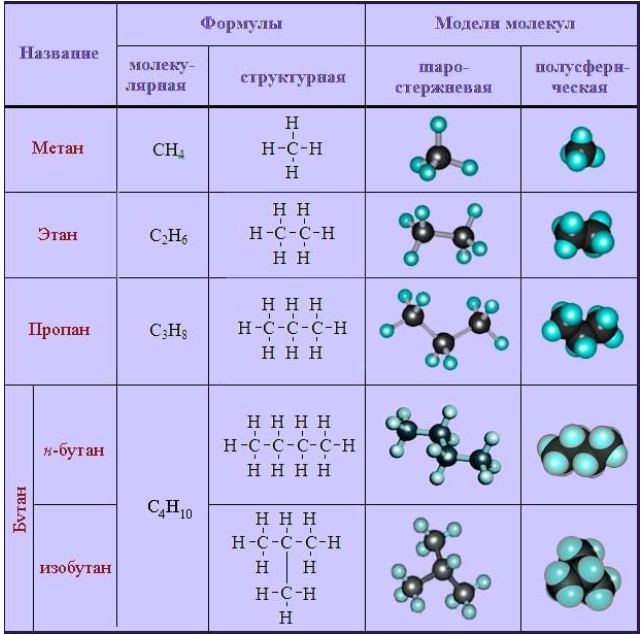
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Строение пропана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :
При образовании связи С–С происходит перекрывание sp 3 -гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению.
| Например, в молекуле пропана C3H8 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет образует угол, т.е. геометрия молекулы — уголковая или V-образная. |
Видео:10 класс. Химия. Свойства алканов. 1 часть.Скачать

Изомерия пропана
Для пропана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Видео:Механизм реакций замещения | Химия ЕГЭ 10 класс | УмскулСкачать

Химические свойства пропана
Пропан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для пропана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для пропана характерны радикальные реакции.
Пропан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Пропан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании пропана образуется смесь хлорпроизводных.
| Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: Бромирование протекает более медленно и избирательно.
|


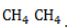 , радикал
, радикал 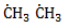 , который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию:
, который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию: