Хлорирование 2-метилбутана. 2-метил-2-хлорбутан. 2-метил-2,3-дихлорбутан. Сазонов Василий Викторович, учитель химии МОУ СОШ д.Васькино.
Слайд 16 из презентации «Фотохимические реакции»
Размеры: 720 х 540 пикселей, формат: .jpg. Чтобы бесплатно скачать слайд для использования на уроке, щёлкните на изображении правой кнопкой мышки и нажмите «Сохранить изображение как. ». Скачать всю презентацию «Фотохимические реакции.ppsx» можно в zip-архиве размером 430 КБ.
- Реакции
- Химические свойства алканов на примере 2-метилбутана
- 1-е задание. Изомеры гептана
- 2-е задание. Гомологи 2-метил-3-этилгептана
- 3-е задание. Получение бутана
- 1. Реакция Вюрца
- 4-е задание. Химические реакции характерные для алканов на примере 2-метилбутана.
- 4) Реакции окисления.
- а) Горение (окисление кислородом воздуха при высоких температурах):
- 7) Реакции отщепления
- 8) Изомеризация алканов
- Химические свойства алканов на примере 2-метилбутана
- 1-е задание. Изомеры гептана
- 2-е задание. Гомологи 2-метил-3-этилгептана
- 3-е задание. Получение бутана
- 1. Реакция Вюрца
- 4-е задание. Химические реакции характерные для алканов на примере 2-метилбутана.
- 4) Реакции окисления.
- а) Горение (окисление кислородом воздуха при высоких температурах):
- 7) Реакции отщепления
- 8) Изомеризация алканов
- 📸 Видео
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

Реакции
«Формулы химических реакций» — Химические уравнения. Алгоритм составления химических уравнений. Закон сохранения массы веществ. М. В. Ломоносов. Перед формулой простого вещества можно увеличить в несколько раз коэффициент . Если в схеме реакции есть формула соли, то вначале уравнивают число ионов образующих соль.
«Скорость реакции» — Определите температурный коэффициент. Катализ – изменение скорости реакции под действием катализаторов. Присутствие катализаторов или ингибиторов. Почему не все столкновения между частицами приводят к осуществлению реакций? Лабораторная работа. Площадь соприкосновения реагирующих веществ. Определите тип реагирующих систем.
«Смещение химического равновесия» — Обратимые реакции. Реакции, протекающие в данных условиях одновременно в двух противоположных направлениях. Укажите верное суждение. Состояние системы. Репродуктивный уровень. Необратимые реакции. Какие из химических реакций являются обратимыми. Костанта равновесия. Равновесие. Воспитывать экологическую культуру.
«Химические уравнения» — Практическая работа №3 «Анализ почвы и воды» 11. 3) Натрий + сера сульфид натрия. Все вещества записать в виде химических формул. Контрольная работа №3 по теме «Явления, происходящие с веществами». Тема урока: Закон сохранения массы веществ. М. В. Ломоносов. Составление уравнений химических реакций.
«Химия «Типы химических реакций»» — Эндотермическая реакция. Глоссарий. Сравни и оцени. Реакция соединения. Проверьте свои знания. Реакция замещения. Реакция разложения. Классификация реакций. Типы химических реакций. Экзотермические реакции. Содержание. Установи соответствие. Реакция обмена.
«Закон сохранения массы веществ Ломоносова» — Расстановка коэффициентов. Михаил Васильевич Ломоносов. Алгоритм составления уравнений химических реакций. Схема разложения воды. Решаем задачи по уравнениям. Получение гидроксида кальция. Масса колбы. Какое явление представлено в фильме. Что показывает химическое уравнение. Назовите признак химической реакции.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Химические свойства алканов на примере 2-метилбутана
Задача 122.
1. Напишите формулы и дайте названия всем изомерам состава С7Н16.
2. Напишите формулу 2-метил-3-этилгептан и двух его гомологов.
3. Получите бутан всеми возможными способами.
4. Напишите химические реакции характерные для алканов на примере 2-метилбутана.
Решение:
Видео:Уравнивание реакций горения углеводородовСкачать

1-е задание. Изомеры гептана
Видео:Галогенирование алкановСкачать

2-е задание. Гомологи 2-метил-3-этилгептана
Гомологи — это химические соединения, имеющие структурную формулу одного типа, например: алканы, алкены, алкины, и т. д. 2-метил-3-этилгептан (изомер декана) относится к гомологическому ряду алканов : метан, этан, пропан, бутан, пентан, гексан, гептан, октан, нонан, декан — это только первые десять, они газы.
Примеры гомологов:
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

3-е задание. Получение бутана
1. Реакция Вюрца
2. Гидрирование бутина.
Первоначально 1-бутин гидрируют до 1-бутена, а затем 1-бутен вторично гидрируют до бутана:
CH3-CH2-C 
СН3—СН2-C 
3. Дегидратация бутилового спирта
Дегидратацию бутилового спирта проводят в присутствии Al2O3 при температуре 300-400 о C:
Затем, полученный 1-бутен гидрируют по водородному радикалу до бутана:
4. Получение из солей карбоновых кислот (реакция Дюма)
При сплавлении безводных солей карбоновых кислот с щелочами получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот:
5. Метод Фишера-Тропша
Смесь угарного газа и водорода (синтез-газ) пропускают над катализатором при нагревании, получают:
6. Реакция Гриньяра
7. Электролиз соли (реакция Кольбе)
CH3-CH2-CH2-COONa + 2Н2О электролиз 
на аноде на катоде
8. Получение бутана из спирта
Катализатором служит LiAlH4:
Видео:Гидрируем и дегидрируем углеводородыСкачать

4-е задание. Химические реакции характерные для алканов на примере
2-метилбутана.
1) Галогенирование (замещение атома водорода атомом галогена — F, Cl, Br с образованием галогеналкана):
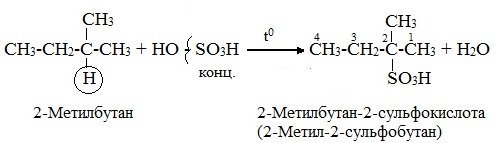
2) Сульфирование (замещение атомов водорода сульфогруппой SO3Н с образованием алкансульфокислот RSO3Н). Сульфирующий реагент – серная кислота Н2SO4 (НО-SO3Н).
1. Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании. Наиболее легко замещается атом водорода у третичного атомауглерода:
2.При совместном действии сернистого ангидрида и кислорода воздуха под влиянием ультрафиолетовых лучей или добавок перекисей парафиновые углеводороды, даже нормального строения, реагируют с образованием сульфокислот (реакция сульфоокисления):
3. Реакция сульфохлорирования.
При совместном действии сернистого ангидрида и хлора при освещении ультрафиолетовым излучением или под влиянием некоторых катализаторов происходит замещение атома водорода с образованием так называемых сульфохлоридов (реакция сульфохлорирования):
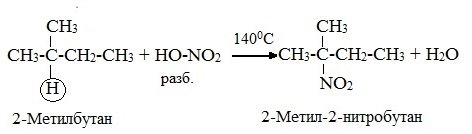
3) Нитрование (замещение атома водорода нитрогруппой – NO2 с образованием нитроалканов R-NO2).
Разбавленная азотная кислота HNO3 (НО-NО2) является нитрующим компонентом. Нитрование алкенов при нагревании называется реакцией М.И.Коновалова. Наиболее легко замещаются атомы водорода у третичного атома:
4) Реакции окисления.
У 2-метилбутана первичные атомы углерода имеют стпень окисления (-3), вторичный атом углерода имеет степень окисления (-2), а третичный — (-1). При обычных условиях алканы устойчивы к действию сильных окислителей (КМnO4, К2Сr2О7). Алканы могут окисляться с образованием различных соединений:
а) Горение (окисление кислородом воздуха при высоких температурах):
б) Каталитическое окисление алканов
Каталитическое окисление может протекать с разрывом связей С–С и С–Н. Например, при неполном окислении 2-метилбутана происходит разрыв связи (С2–С3) и получается молекула кислоты и ацетона:
Из алканов под влиянием каталитических веществ и нагревании до 200 °C получаются молекулы спирта, альдегида или карбоновой кислоты.
Примеры с 2-метилбутаном:
Окисление с образованием гидропероксидов:
5) Крекинг (анг. сracking — расщепление) алканов:
а) Термический крекинг — это разрыв связей С — С в молекулах алканов:
H3C–CH(CH3)–CH2–CH3 
б) Термический крекинг в присутствии катализаторов
Термический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре 500 0 С и атмосферном давлении.Изоалканы термически менее устойчивы, чем алканы нормального строения. Для разветвленных углеводородов преимущественно происходит разрыв связи у третичного или четвертичного атома углерода. При этом с разрывом молекул происходит реакция изомеризации и дегидрирования:
7) Реакции отщепления
а) Дегидрирование
Дегидрирование [отщепление водорода; происходит в результате разрыва связей С — Н; осуществляется в присутствии катализатора (Pt, Pd, Ni, А12О3, Сг2О3) при повышенных температурах (400 — 600°С)]. При этом от молекулы алкена отщепляется молекула водорода:
8) Пиролиз.
Процесс протекает при температуре 1000°С и выше разрываются все связи, образуютс конечные продукты – С и Н2:
8) Изомеризация алканов
Алканы нормального строения под влиянием катализаторов и при нагревании способны превращаться в разветвленные алканы без изменения состава молекул, т.е. вступать в реакции изомеpизации. В этих pеакциях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов. Например, изомеризация н-пентана в изопентан (2-метилбутан) происходит при 100°С в присутствии катализатора хлорида алюминия:
Теоретически можно предположить, что из 2-метилбутана можно получить 2,2-диметилпропан:
Видео:Видео №3. Как составить изомерыСкачать

Химические свойства алканов на примере 2-метилбутана
Задача 122.
1. Напишите формулы и дайте названия всем изомерам состава С7Н16.
2. Напишите формулу 2-метил-3-этилгептан и двух его гомологов.
3. Получите бутан всеми возможными способами.
4. Напишите химические реакции характерные для алканов на примере 2-метилбутана.
Решение:
Видео:Составление формул органических соединений по названиюСкачать

1-е задание. Изомеры гептана
Видео:Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

2-е задание. Гомологи 2-метил-3-этилгептана
Гомологи — это химические соединения, имеющие структурную формулу одного типа, например: алканы, алкены, алкины, и т. д. 2-метил-3-этилгептан (изомер декана) относится к гомологическому ряду алканов : метан, этан, пропан, бутан, пентан, гексан, гептан, октан, нонан, декан — это только первые десять, они газы.
Примеры гомологов:
Видео:химические свойства алканов/органическая химия/ЕГЭСкачать

3-е задание. Получение бутана
1. Реакция Вюрца
2. Гидрирование бутина.
Первоначально 1-бутин гидрируют до 1-бутена, а затем 1-бутен вторично гидрируют до бутана:
CH3-CH2-C 
СН3—СН2-C 
3. Дегидратация бутилового спирта
Дегидратацию бутилового спирта проводят в присутствии Al2O3 при температуре 300-400 о C:
Затем, полученный 1-бутен гидрируют по водородному радикалу до бутана:
4. Получение из солей карбоновых кислот (реакция Дюма)
При сплавлении безводных солей карбоновых кислот с щелочами получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот:
5. Метод Фишера-Тропша
Смесь угарного газа и водорода (синтез-газ) пропускают над катализатором при нагревании, получают:
6. Реакция Гриньяра
7. Электролиз соли (реакция Кольбе)
CH3-CH2-CH2-COONa + 2Н2О электролиз 
на аноде на катоде
8. Получение бутана из спирта
Катализатором служит LiAlH4:
Видео:Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать

4-е задание. Химические реакции характерные для алканов на примере
2-метилбутана.
1) Галогенирование (замещение атома водорода атомом галогена — F, Cl, Br с образованием галогеналкана):
2) Сульфирование (замещение атомов водорода сульфогруппой SO3Н с образованием алкансульфокислот RSO3Н). Сульфирующий реагент – серная кислота Н2SO4 (НО-SO3Н).
1. Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании. Наиболее легко замещается атом водорода у третичного атомауглерода:
2.При совместном действии сернистого ангидрида и кислорода воздуха под влиянием ультрафиолетовых лучей или добавок перекисей парафиновые углеводороды, даже нормального строения, реагируют с образованием сульфокислот (реакция сульфоокисления):
3. Реакция сульфохлорирования.
При совместном действии сернистого ангидрида и хлора при освещении ультрафиолетовым излучением или под влиянием некоторых катализаторов происходит замещение атома водорода с образованием так называемых сульфохлоридов (реакция сульфохлорирования):
3) Нитрование (замещение атома водорода нитрогруппой – NO2 с образованием нитроалканов R-NO2).
Разбавленная азотная кислота HNO3 (НО-NО2) является нитрующим компонентом. Нитрование алкенов при нагревании называется реакцией М.И.Коновалова. Наиболее легко замещаются атомы водорода у третичного атома:
4) Реакции окисления.
У 2-метилбутана первичные атомы углерода имеют стпень окисления (-3), вторичный атом углерода имеет степень окисления (-2), а третичный — (-1). При обычных условиях алканы устойчивы к действию сильных окислителей (КМnO4, К2Сr2О7). Алканы могут окисляться с образованием различных соединений:
а) Горение (окисление кислородом воздуха при высоких температурах):
б) Каталитическое окисление алканов
Каталитическое окисление может протекать с разрывом связей С–С и С–Н. Например, при неполном окислении 2-метилбутана происходит разрыв связи (С2–С3) и получается молекула кислоты и ацетона:
Из алканов под влиянием каталитических веществ и нагревании до 200 °C получаются молекулы спирта, альдегида или карбоновой кислоты.
Примеры с 2-метилбутаном:
Окисление с образованием гидропероксидов:
5) Крекинг (анг. сracking — расщепление) алканов:
а) Термический крекинг — это разрыв связей С — С в молекулах алканов:
H3C–CH(CH3)–CH2–CH3 
б) Термический крекинг в присутствии катализаторов
Термический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре 500 0 С и атмосферном давлении.Изоалканы термически менее устойчивы, чем алканы нормального строения. Для разветвленных углеводородов преимущественно происходит разрыв связи у третичного или четвертичного атома углерода. При этом с разрывом молекул происходит реакция изомеризации и дегидрирования:
7) Реакции отщепления
а) Дегидрирование
Дегидрирование [отщепление водорода; происходит в результате разрыва связей С — Н; осуществляется в присутствии катализатора (Pt, Pd, Ni, А12О3, Сг2О3) при повышенных температурах (400 — 600°С)]. При этом от молекулы алкена отщепляется молекула водорода:
8) Пиролиз.
Процесс протекает при температуре 1000°С и выше разрываются все связи, образуютс конечные продукты – С и Н2:
8) Изомеризация алканов
Алканы нормального строения под влиянием катализаторов и при нагревании способны превращаться в разветвленные алканы без изменения состава молекул, т.е. вступать в реакции изомеpизации. В этих pеакциях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов. Например, изомеризация н-пентана в изопентан (2-метилбутан) происходит при 100°С в присутствии катализатора хлорида алюминия:
Теоретически можно предположить, что из 2-метилбутана можно получить 2,2-диметилпропан:
📸 Видео
Механизм реакции РАДИКАЛЬНОГО ЗАМЕЩЕНИЯ у АЛКАНОВСкачать

ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Номенклатура алканов. Учимся давать названия алканам.Скачать

Алканы. Химические свойства. Ч.1. Реакции радикального замещения.Скачать

Химические свойства алканов / Часть 1. Углублённый уровеньСкачать

Органическая Химия — Алканы и Цепь из АтомовСкачать

Алканы. Химические свойства. 9 класс.Скачать

1.3. Алканы: Химические свойства. Подготовка к ЕГЭ по химииСкачать

Окислительно-восстановительные реакции. 2 часть. 10 класс.Скачать