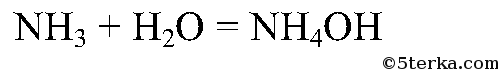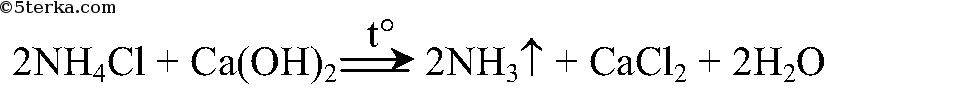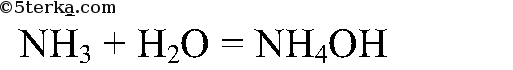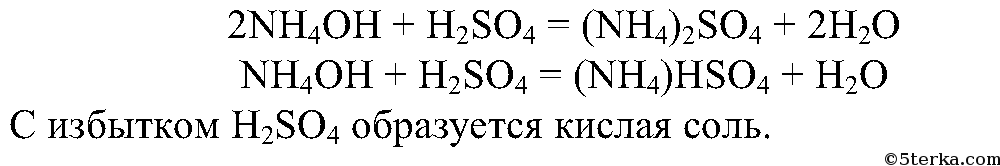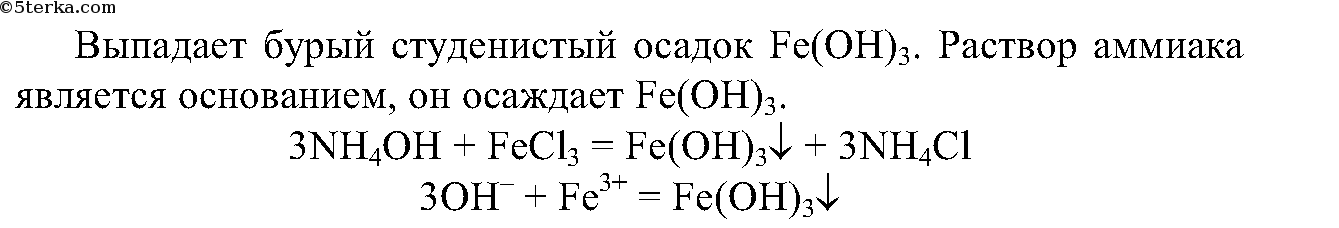Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например , хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например , хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов . Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
Но есть исключение ! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
Также допустима такая запись:
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами .
Например , гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например , гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
4. Г идроксид железа (III) разлагается при нагревании :
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Видео:Равновесие в растворе роданида железаСкачать

Хлорид железа и аммиак ионное уравнение
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к образованию осадка без выделения газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Дан следующий перечень веществ: оксид меди(I), карбонат аммония, гипохлорит калия, серная кислота, хлорид железа(III), аммиак. Допустимо использование водных растворов веществ.
железа(III), аммиак. Допустимо использование водных растворов веществ. Из предложенного перечня выберите вещества, между которыми возможна окислительно-восстановительная реакция, приводящая к образованию двух солей, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для начала запишем молекулярные формулы данных веществ:
,
1) Уравнение реакции:
2) Электронный баланс:
1 | →
2 | →
3) Окислителем является (или хлор в степени окисления +1). Восстановителем является оксид меди (I) (или медь в степени окисления +1).
Видео:Взаимодействие хлорида железа III с роданидом калияСкачать

Практическое занятие № 3. Получение аммиака и изучение его свойств. Ознакомление со свойствами водного раствора аммиака
Задания. 1. Получите аммиак по реакции гидроксида кальция с хлоридом аммония.
2. Изучите некоторые физические свойства аммиака (цвет, запах, относительную плотность, растворимость в воде).
3. Изучите взаимодействие аммиака с водой, азотной и соляной кислотами.
4. Проделайте реакции:а) между раствором аммиака в воде и серной кислотой;б) между гидроксидом аммония и раствором хлорида железа (III).
Соблюдайте правила техники безопасности при проведении опытов!
Оборудование. Детали прибора для получения аммиака, лабораторный штатив, штатив с пробирками, фарфоровая ступка с пестиком, ложечка или шпатель, стеклянные палочки (2 шт.), пробка с держателем, нагревательный прибор.
Вещества. Кристаллические гидроксид кальция и хлорид аммония; концентрированная соляная, концентрированная азотная и 20% -я серная кислоты; вода (в стакане), раствор фенолфталеина, раствор хлорида железа (III).
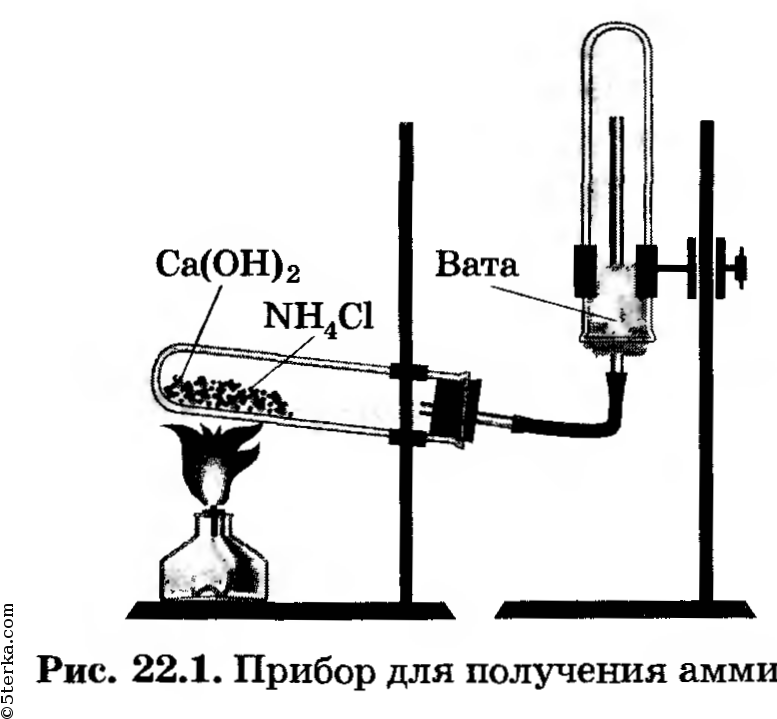
Получение аммиака. Соберите прибор для получения аммиака (рис. 22.1), испытайте на герметичность. За
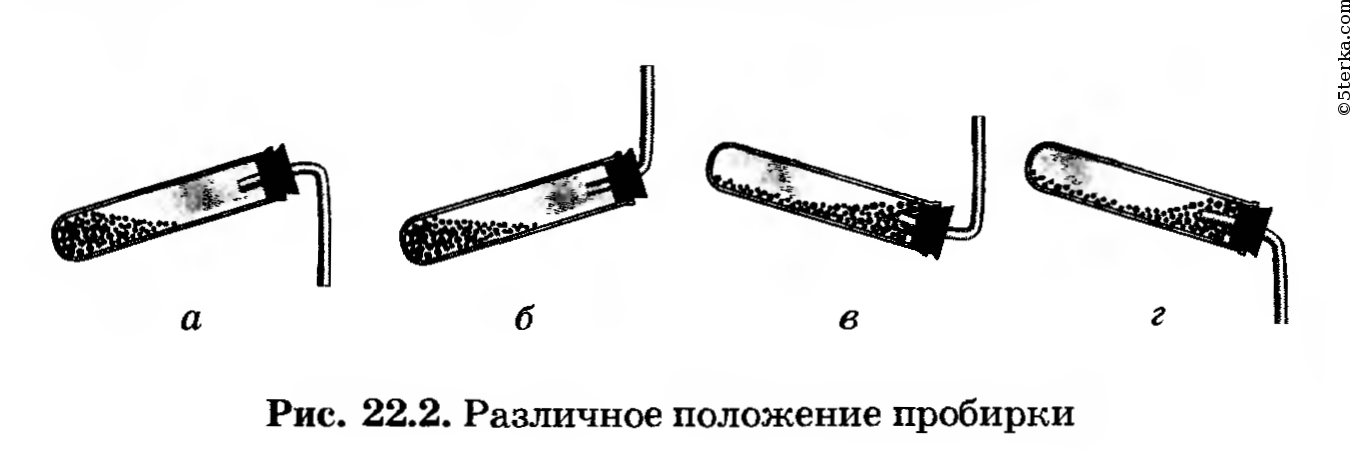
крепите его в штативе так, чтобы удобно было нагревать пробирку. Решите, какое положение пробирки (рис. 22.2, а, б, в или г) является правильным.
Приготовьте три сухих (почему?) пробирки, которые предстоит наполнить аммиаком. Закройте их пробками.
В ступку насыпьте по одной ложечке хлорида аммония и гидроксида кальция, перемешайте их, разотрите пестиком. Затем перенесите порцию смеси в пробирку прибора, заполнив ее не более чем на 1/3.
Начните нагревать содержимое пробирки, при этом сначала обогрейте пламенем горелки всю пробирку, затем пламя направьте так, чтобы нагревалась поверхность смеси.
Наполните три пробирки аммиаком, заткните их пробками с держателями; прекратите нагревание и, не разбирая прибора, перенесите его в вытяжной шкаф.
Изучение свойств аммиака.
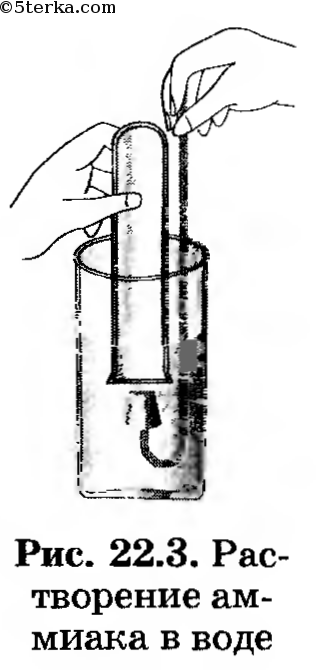
1. Исследуйте растворимость, взаимодействие аммиака с водой. Для этого опустите пробирку с аммиаком в стакан с водой и под водой откройте ее, как это показано на рисунке 22.3.
Что вы наблюдаете?
Не вынимая пробирку, закройте ее также под водой пробкой с держателем, после чего поставьте в штатив. К полученному раствору добавьте 2—3 капли раствора фенолфталеина.
Составьте уравнение реакции взаимодействия аммиака с водой.
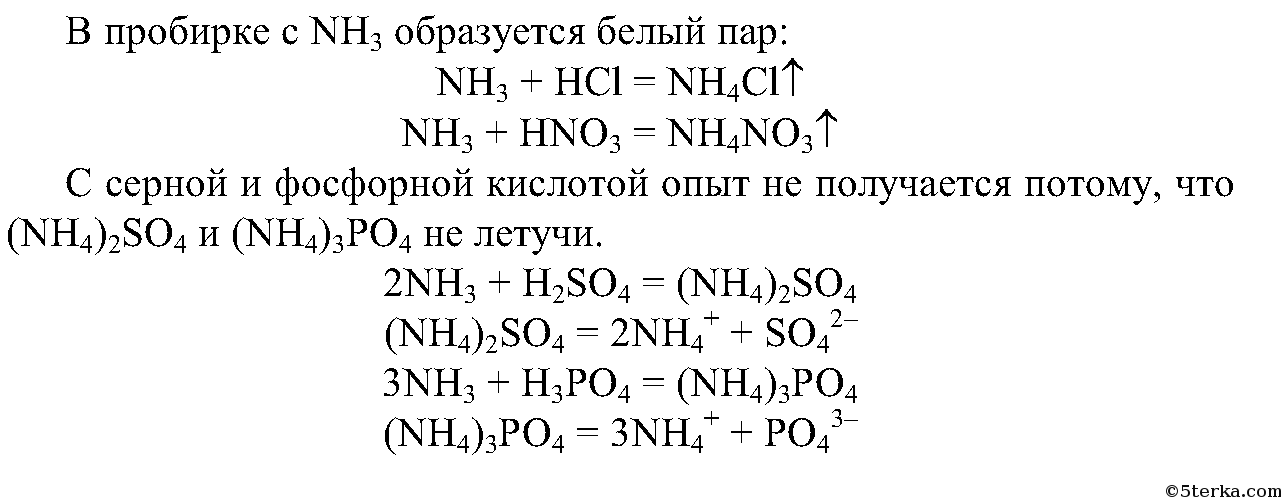
2. Смочите стеклянную палочку концентрированной соляной кислотой, другую — концентрированной азотной кислотой. Внесите их поочередно в пробирки с аммиаком. Что вы наблюдаете?
Составьте уравнения происходящих реакций.
Почему опыт не получится при использовании серной и фосфорной кислот?
3. Разлейте полученный водный раствор аммиака в воде в две пробирки. В одну пробирку добавьте несколько капель раствора фенолфталеина и осторожно прилейте серную кислоту до исчезновения окраски индикатора. Что вы наблюдаете?
Составьте уравнения реакций образования сульфата и гидросульфата аммония.
4. В другую пробирку с раствором аммиака добавьте раствор хлорида железа (III). Что вы наблюдаете?
Запишите ионные уравнения реакций.
Правильное положение пробирки под б). Во-первых, NH3 легче, чем воздух, он будет подниматься вверх, поэтому газоотводная трубка должна также быть направлена вверх. Во-вторых, мы будем нагревать вещество в пробирке, поэтому оно не должно соприкасаться с пробиркой, которая от огня может расплавиться.
Пробирки должны быть сухими, т.к. аммиак реагирует с водой и в результате образуется гидроксид аммония.
Реакция получения аммиака:
Изучение свойств аммиака:
Аммиак хорошо растворяется в воде:
Раствор обесцвечивается, поскольку серная кислота нейтрализует аммиак, т.е. среда становится нейтральной. В нейтральной и кислой среде фенолфталеин бесцветный.

задача №3
к главе «Практические занятия».
💡 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Качественная реакция на фенол (С ХЛОРИДОМ ЖЕЛЕЗА 3)Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакции ионного обмена. 9 класс.Скачать

Получение хлорида железа 3Скачать

Реакции ионного обмена. 9 класс.Скачать

Реакции ионного обменаСкачать

ПОЛУЧЕНИЕ хлоридов железа (II и III)Скачать

Соединения железаСкачать

Хлорное железо растворят все!!!Скачать

Реакция хлорида железа и роданида аммонияСкачать

Аммиак и соли аммония. 11 класс.Скачать

ХЛОРИД ЖЕЛЕЗА. FeCl₃Скачать

Реакция замещения меди железом в растворе сульфата или хлорида меди IIСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Все опыты с железом в одном видео? | Химия ЕГЭ – Екатерина СтрогановаСкачать