SnCl2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора хлорида олова (II)
- Хлорид олова (SnCl2) свойства, структура, использование и риски
- Физико-химические свойства
- Конфигурация Валенсии
- реактивность
- Восстановительная активность
- Химическая структура
- приложений
- риски
- Способ получения хлорного и хлористого олова
- Хлорид олова (II), или хлористое олово
- Оловянные кислоты
- Как получить хлорное олово в домашних условиях?
- Как получить чистое олово в домашних условиях?
- Литьё из олова в домашних условиях
- β-Оловянная кислота
- Применение
- 📸 Видео
Видео:Химия из батарейки - Хлорид аммония - Хлорид олова(II) реактив на ионы золотаСкачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
SnCl2 + HOH ⇄ SnOHCl + HCl
Полное ионное уравнение
Sn 2+ + 2Cl — + HOH ⇄ SnOH + + Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
Sn 2+ + HOH ⇄ SnOH + + H +
Видео:Получение хлорида олова(II) сухим методомСкачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
SnOHCl + HOH ⇄ Sn(OH)2 + HCl
Полное ионное уравнение
SnOH + + Cl — + HOH ⇄ Sn(OH)2 + H + + Cl —
Сокращенное (краткое) ионное уравнение
SnOH + + HOH ⇄ Sn(OH)2 + H +
Видео:Химия | Молекулярные и ионные уравненияСкачать

Среда и pH раствора хлорида олова (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Простой способ получения хлорида олова (IV)Скачать

Хлорид олова (SnCl2) свойства, структура, использование и риски
хлорид олова (II) или хлорид олова, химической формулы SnCl2, представляет собой белое кристаллическое твердое соединение, продукт реакции олова и концентрированного раствора соляной кислоты: Sn (s) + 2HCl (конц) => SnCl2(вод) + H2(G). Процесс его синтеза (приготовления) состоит из добавления кусочков оловянных опилок для взаимодействия с кислотой.
После добавления кусочков олова происходит дегидратация и кристаллизация до тех пор, пока не будет получена неорганическая соль. В этом соединении олово потеряло два электрона из его валентной оболочки, чтобы сформировать связи с атомами хлора.
Это может быть лучше понято, если учесть валентную конфигурацию олова (5 с 2 5pх 2 ри 0 рZ 0 ), из которых пара электронов занимает орбиталь рх дается протонам H + , для того, чтобы сформировать двухатомную молекулу водорода. То есть это реакция окислительно-восстановительного типа.
- 1 Физико-химические свойства
- 1.1 Конфигурация Валенсии
- 1.2 Реакционная способность
- 1.3 Восстановительная активность
- 2 Химическая структура
- 3 использования
- 4 риска
- 5 ссылок
Видео:Хлорное олово. Хлористое олово. Станнан.Скачать

Физико-химические свойства
Ссылки SnCl2 Они ионные или ковалентные? Физические свойства хлорида олова (II) исключают первый вариант. Точки плавления и кипения для этого соединения составляют 247 ° C и 623 ° C, что свидетельствует о слабых межмолекулярных взаимодействиях, что является распространенным фактом для ковалентных соединений..
Его кристаллы белого цвета, что приводит к нулевому поглощению в видимом спектре.
Конфигурация Валенсии
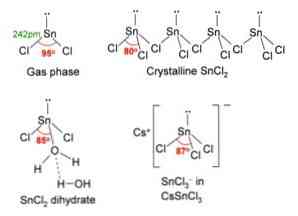
На изображении выше, в верхнем левом углу, показана изолированная молекула SnCl2.
Молекулярная геометрия должна быть плоской, потому что гибридизация центрального атома является sp 2 (3 орбитальных зр 2 и чистой орбитали для образования ковалентных связей), но свободная пара электронов занимает объем и отталкивает атомы хлора вниз, придавая молекуле угловую геометрию.
В газовой фазе это соединение изолировано, поэтому оно не взаимодействует с другими молекулами.
Как потеря пары электронов на орбите рх, олово превращается в ион Sn 2+ и его итоговая электронная конфигурация составляет 5 с 2 5pх 0 ри 0 рZ 0 , со всеми его p-орбиталями, доступными для приема ссылок от других видов.
Ионы Cl — координировать с ионом Sn 2+ дать хлорид олова. Электронная конфигурация олова в этой соли составляет 5 с 2 5pх 2 ри 2 рZ 0 , возможность принять другую пару электронов в своей свободной орбитальной рZ.
Например, вы можете принять другой ион Cl — , образующий комплекс геометрии треугольной плоскости (пирамида с треугольным основанием) и отрицательно заряженный [SnCl3] — .
реактивность
SnCl2 имеет высокую реакционную способность и склонность вести себя как кислота Льюиса (электронный рецептор), чтобы завершить свой валентный октет.
Так же, как он принимает ион Cl — , то же самое происходит с водой, которая «гидратирует» атом олова, связывая молекулу воды непосредственно с оловом, и вторая молекула воды образует взаимодействия водородных связей с первым.
Результатом этого является то, что SnCl2 это не чисто, но согласовано с водой в его дигидратированной соли: SnCl2· 2Н2О.
SnCl2 Он очень растворим в воде и в полярных растворителях, потому что это полярное соединение. Однако его растворимость в воде, меньшая, чем его массовый вес, активирует реакцию гидролиза (разрыв молекулы воды) с образованием основной и нерастворимой соли:
SnCl2(вод) + H2O (l) Sn (OH) Cl (s) + HCl (водн.)
Двойная стрелка указывает на то, что установлено равновесие, благоприятное для левой стороны (по отношению к реагентам), если концентрации HCl увеличиваются. Для этого растворы SnCl2 используемый имеет кислотный рН, чтобы избежать осаждения нежелательного солевого продукта гидролиза.
Восстановительная активность
Реагирует с кислородом в воздухе с образованием хлорида олова (IV) или хлорида олова:
В этой реакции олово окисляется, образуя связь с электроотрицательным атомом кислорода и увеличивает количество связей с атомами хлора..
В целом, электроотрицательные атомы галогенов (F, Cl, Br и I) стабилизируют связи соединений Sn (IV), и этот факт объясняет, почему SnCl2 это восстановитель.
Когда он окисляется и теряет все свои валентные электроны, ион Sn 4+ это остается с конфигурацией 5s 0 5pх 0 ри 0 рZ 0 , будучи парой электронов в орбитальных 5-ых, наиболее трудно быть «схваченным».
Видео:Хлорид олова 2.Скачать

Химическая структура
Видео:КАК СДЕЛАТЬ ХЛОРИСТОЕ ОЛОВО (SnCl2) В ДОМАШНИХ УСЛОВИЯХ !Скачать

SnCl2 представлена кристаллическая структура орторомбического типа, похожая на ряды пил, в которых кончики зубов представляют собой хлориды.
Каждый ряд представляет собой цепь SnCl3 образуя мостик Cl с другим атомом Sn (Cl-Sn (Cl)2-Cl- ···), как видно на изображении выше. Две цепи, связанные слабыми взаимодействиями типа Sn-Cl, составляют один слой расположения, который накладывается на другой слой и так далее, пока не будет определено кристаллическое твердое вещество..
Свободная электронная пара 5s 2 вызывает искажения в структуре, потому что он занимает объем (объем электронного облака).
Sn может иметь координационное число, равное девяти, то же самое, что иметь девять соседей, рисуя тригональную призму с этим, расположенным в центре геометрической фигуры, и Cl в вершинах, в дополнение к другим Cl, расположенным в каждом квадратных граней призмы.
Это легче заметить, если рассмотреть цепь, в которой Sn (темно-серые сферы) направлены вверх, а три Cl, связанные с ней, образуют треугольный пол, а три верхних Cls образуют треугольную крышу..
Видео:Реакция хлорида олова (ll) на некоторые металлыСкачать

приложений
В органическом синтезе он используется в качестве восстановителя для ароматических нитросоединений (Ar-NO2 à Ar-NH2). Поскольку его химическая структура является ламинарной, он находит применение в мире катализа органических реакций, помимо того, что является потенциальным кандидатом на каталитическую поддержку.
Его восстановительное свойство используется для определения присутствия соединений золота, для покрытия стекол серебряными зеркалами и для действия в качестве антиоксиданта..
Также в своей молекулярной геометрии тригональная пирамида (: SnX3 — M + ) используется в качестве основы Льюиса для синтеза большого количества соединений (таких как кластерный комплекс Pt)3Sn8Cl20, где безэлектронная пара координируется с кислотой Льюиса).
Видео:Различия в восстановлении платины и палладия хлоридом олова (II) - ДУСТХИМПРОМСкачать

риски
SnCl2 Это может повредить лейкоциты. Он вызывает коррозию, раздражение, канцерогенность и оказывает сильное негативное воздействие на виды, обитающие в морских экосистемах..
Он может разлагаться при высоких температурах, выделяя вредный газообразный хлор. При контакте с высокоокислительными агентами вызывает взрывные реакции.
Видео:Делаем хлорное олово SnCl2Скачать

Способ получения хлорного и хлористого олова
Видео:Хлорид олова ll, чёткая реакция или недоразумение, тест?Скачать

Хлорид олова (II), или хлористое олово
SnCl2•2H2O получается при растворении олова в соляной кислоте, образует бесцветные кристаллы с двумя молекулами кристаллизационной воды. При нагревании или сильном разбавлении раствора SnCl2 водой происходит частичный гидролиз с образованием осадка основной соли:
SnCl2 + Н2O ⇄ ↓SnOHCl + HCl
Хлористое олово является энергичным восстановителем.
Так, например, хлорное железо FeCl3восстанавливается им в хлористое железо FeCl2:
2FeCl3+ SnCl2 = 2FeCl2 + SnCl4
При действии хлористого олова на раствор сулемы образуется белый осадок каломели. При избыткеSnCl2восстановление идет еще дальше и получается металлическая ртуть:
2HgCl2 + SnCl2 = ↓ Hg2Cl2 + SnCl4
Hg2Cl2 + SnCl2 = 2Hg + SnCl4
Соединения четырехвалентного олова. Двуокись олова
SnO2встречается в природе в виде оловянного камня — важнейшей руды олова. Искусственно может быть получена сжиганием металла на воздухе или окислением его азотной кислотой с последующим прокаливанием полученного продукта. Применяется для приготовления различных белых глазурей и эмалей.
Видео:Ответ на комментарий к видео, как работает хлорид олова llСкачать

Оловянные кислоты
Гидраты двуокиси олова носят название оловянных кислот и известны в двух модификациях: в виде α-оловянной кислоты и в виде β-оловянной кислоты. α-Оловянная кислота
H2SnO3может быть получена действием водного раствора аммиака на раствор хлорного олова SnCl4.
Образование выпадающего белого осадка обычно выражают уравнением
4NH4OH = ↓ H2SnO3 + 4NH4Cl + H2O
При высушивании осадок постепенно теряет воду, пока не останется чистая двуокись олова. Таким образом, никакой кислоты определенного состава получить не удается. Поэтому приведенная выше формула α-оловянной кислоты является лишь простейшей из возможных. Правильнее было бы изобразить состав этой кислоты формулой mSno2 • nН2O.
α-Оловянная кислота легко растворяется в щелочах, образуя соли, содержащие комплексный анион [Sn(OH)6]— и называемые станнатами:
H2SnO3 + 2NaOH + H2O = Na2[Sn(OH)6]
Станнат натрия выделяется из раствора в виде кристаллов, состав которых можно выразить также формулой Na2SnO3 • 3Н2O. Эта соль применяется в качестве протравы в красильном деле и для утяжеления шелка. Шелковые ткани, обработанные перед крашением растворами соединений олова, иногда содержат олово в количестве до 50% от веса ткани.
Кислоты также растворяют α-оловянную кислоту с образованием солей четырехвалентного олова. Например:
H2SnO3 + 4НСl ⇄ SnCl4 + 3Н2O
При избытке соляной кислоты SnCl4 присоединяет две молекулы НСl, образуя комплексную хлороловянную кислоту H2[SnCl6]. Аммониевая соль этой кислоты NH4[SnCl6] имеет же применение, что и станнат натрия.






Видео:Хлорид олова ll, цвет реакции на медь, золото, палладия и платины.Скачать

Как получить хлорное олово в домашних условиях?
Более простым и дешевым методом получения хлорида олова является применение оловянно-свинцового припоя.
- Необходимо взять концентрированную соляную кислоту, довести её до кипения и растворить в ней припой.
- Следующий шаг — сильное охлаждение раствора, в процессе которого в нём будет наблюдаться выпадение осадка хлорида свинца.
- Полученный осадок фильтруют с декантацией, и на основе отфильтрованного раствора готовится электролит (который является практически чистым хлоридом олова с незначительным количеством примеси).
- Из-за быстрого окисления хлористого олова применение полученного раствора должно быть незамедлительным.
Видео о том, как получить хлорное олово в домашних условиях
Как получить чистое олово в домашних условиях?
Для того чтобы сделать электролит, необходимо взять небольшую порцию хлорида олова для затравки. Позже, после выделения, появится возможность приготовления более чистого раствора хлорида. Для этого потребуется взять царскую водку или соляную кислоту и растворить металл. В 7% раствор SnCl2 (хлорид олова) влить, постоянно помешивая, щелочной раствор (9−10%), в результате чего будет наблюдаться образование и выпадение белого осадка — гидроксида олова. Перемешивать раствор необходимо до тех пор, пока он не станет полностью прозрачным, что будет указывать на готовность электролита.
Как сделать олово в домашних условиях? Для этого потребуется консервная банка довольно большого размера (3−5 литров) и крышка из диэлектрического материала. Банки имеют луженную внутреннюю поверхность — то есть, слой олова, защищающий саму железную банку от окисления, а пищевой продукт, находящийся в ней — от порчи. Поэтому возможно извлечение олова из банок для повторного его использования. С банки требуется снять наклейку и удалить с неё загрязнения, для чего нужно прокипятить её в крепком содовом растворе в течение 30 минут. Далее делается следующее:
- В центр банки помещается угольный катод.
- К корпусу банки подключить анод.
- Залить электролит и подключить питание (4В). Для этого можно взять несколько последовательно соединённых батареек или аккумулятор.
- Чтобы увеличить количество получаемого олова, нарежьте несколько старых банок из-под консервов на части и засыпьте их в электролизер. При этом необходимо предотвратить их контакт с катодом. В одной консервной банке среднего размера содержится 0,5 г олова.
- Результат опыта — выделение на катоде губчатого олова. Его требуется собрать и переплавить в тигле в металл характерного серебристого цвета. Почему олово можно расплавить в домашних условиях? Потому что оно имеет температуру плавления 239˚C, а железо, для сравнения — 1538, 85 ˚C.
Видео о литье из олова в домашних условиях
Литьё из олова в домашних условиях
Изготавливать мелкие фигурки и изделия из олова в домашних условиях сегодня не только интересно, но и довольно прибыльно. Ведь многие коллекционеры за оловянного солдатика, модель военной техники или просто сувенир готовы заплатить немалые деньги. Художники-любители, желающие научиться отливать детали, используют для этого, как правило, олово, поскольку оно имеет следующие положительные качества:
- Привлекательный красивый цвет, похожий на цвет серебра.
- Олово технологично, имеет низкую температуру плавления.
- Пластично, легко гравируется и чеканится, «лепится» паяльником.
Умелый мастер, используя нехитрое оборудование, способен превратить небольшой серебристый слиток в прекрасную скульптуру, фонарик, подсвечник, ларец, медаль, брошь, браслет, запонку и многое другое. Кроме того, из олова создаются ажурные и рельефные пластины для украшения шкатулок, декорирования дверных петель, ручек, замочных скважин. Как происходит литьё олова в домашних условиях? Этот процесс состоит из следующих этапов и особенностей:
- Производство будущих изделий начинается с создания цветных эскизов на листе бумаги.
- После берётся полимерная глина и из неё готовится фигурка для создания формы. При этом каждую мельчайшую деталь наносят стеком и тоненьким шилом.
- Изготовление формы — самый ответственный этап. Она должна иметь идеальный разъём. Это необходимо для лёгкого и безопасного извлечения отливки. Как правило, формы для литья делают разборные, состоящие из 2-х частей.
- Наиболее оптимальный материал для формы — гипс или силикон, но для того чтобы сделать силиконовую форму, необходимо затратить гораздо больше материала и времени.
- Кроме того, в магазинах продаются специальные герметики, которые заливаются на модели, они застывают и, таким образом, получают многоразовые формы для заливок.
- В тех случаях, когда в будущем изделии будет присутствовать множество мелких деталей, форма изготавливается с вкладышем.
- Большую роль играет размер канала в форме, через который в неё заливается металл. Чем оно меньше, тем медленнее заполняется форма, при этом существует опасность быстрого остывания металла, что может привести к образованию полостей.
- Отливая деталь, две половины формы следует сложить вместе и поместить между фанерным листом толщиной около 12 миллиметров. Затем их нужно стянуть тугой резинкой.
- После подготовки формы разогревается металл. Готовность сплава к заливке определяется по образованию желтоватой плёнки. Если же металл перегреть, то плёнка приобретёт синий или фиолетовый оттенок.
- Заливка металла в форму должна обязательно производиться тонкой струйкой, при этом следует немного постукивать по форме, предотвращая, таким образом, задержку в ней воздуха. Необходимо при этом помнить о правилах безопасной работы с разогретыми сплавами.
- После того как форма будет залита металлом, требуется оставить её на некоторое время для остывания и затвердевания сплава внутри неё.
- Затем форма открывается, и из неё аккуратно, щипцами извлекается готовое изделие. Как правило, на первом изделии всегда бывают дефекты. Поэтому фигурка дополнительно обрабатывается — удаляются облои (металл, который затёк в швы между двух частей формы). Их счищают с помощью таких инструментов, как скальпель или шабер.
- Далее швы шлифуются довольно мелкой наждачной бумагой. При изготовлении сложных фигурок и изделий, отливающихся отдельными частями, эти части соединяются паяльником.
- Для того чтобы приклеить мелкие детали, используется эпоксидный клей. Места, в которых детали спаивались и склеивались, тщательно и аккуратно шлифуются.
- Затем следует приготовить крепкий раствор соды и помыть в нём готовую фигурку тоненькой щеточкой, чтобы удалить флюс.
- При необходимости готовое изделие раскрашивается акриловыми красками.
Успешно овладев этим увлекательным старинным ремеслом, умелый мастер получит возможность не только заниматься любимым делом, но и зарабатывать неплохие деньги. К тому же, это будет отличным подарком на 10 лет свадьбы (оловянную годовщину).
Видео:Взаимодействие хлорида олова II с цинком Оловянный ёжикСкачать

β-Оловянная кислота
Получается в виде белого порошка при действии концентрированной азотной кислоты на олово. Состав ее является столь же неопределенным, как и состав α-оловянной кислоты. В отличие от α-оловянной кислоты она не растворяется ни в кислотах, ни в растворах щелочей. Но путем сплавления со щелочами можно перевести ее в раствор в виде станната. α-Оловянная кислота при хранении ее в соприкосновении с раствором, из которого она выделилась, постепенно тоже переходит в β-оловянную кислоту.
(IV), или
хлорное олово,
SnCl4 представляет собой жидкость, кипящую при 114° и сильно дымящую на воздухе. Образуется при действии хлора на металлическое олово или на двухлористое олово. В технике получается главным образом путем обработки отбросов белой жести (старых консервных банок) хлором.
Хотя хлорное олово похоже по некоторым свойствам на хлористые соединения металлоидов, однако оно растворяется в воде без заметного разложения и может быть выделено из раствора ввиде различных кристаллогидратов, например SnCl4 • 5H2O.
В разбавленных водных растворах SnCl4 подвергается сильному гидролитическому расщеплению, которое можно выразить уравнением
Sn•••• + 3Н2О ⇄ H2SnO3 + 4Н•
Образующаяся при этом оловянная кислота дает коллоидный раствор.
Видео:Видеоопыты. Неорганика 169. Взаимодействие хлорида олова (II) с цинкомСкачать

Применение
• В химпроме — восстановитель в органических синтезах, сырье для получения олова, катализатор полимеризации материалов на основе эпоксидных смол. Востребован в реакциях восстановления металлов и для осветления минеральных масел, получаемых из нефти. • Реактив для обнаружения в растворе ионов йода, хлора, двухвалентной ртути, трехвалентного железа и некоторых других в лабораторной практике. • В косметической индустрии для получения ароматизаторов и красителей для мыла. • Для получения протрав для окрашивания тканей. • В производстве керамики. • Для изготовления изделий, обладающих высокой отражающей способностью, зеркал. Для полировки стеклянных и пластиковых поверхностей с целью придания им лучшей сцепляемости со следующим отражающим металлическим покрытием. Для химического лужения (покрытия поверхностей слоем олова). • Пищевая добавка Е512 в пищепроме — эмульгатор, стабилизатор формы и консистенции. Применяется для отбеливания сахара. • Входит в состав флюса для сварочных работ. • Используется для проверки слитков золота, если есть подозрение на подделку.
📸 Видео
Хлорное олово 2 0 индикатор на золото. Палладий и...Скачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Хлорное олово SnCl2 готовим самиСкачать