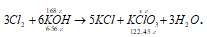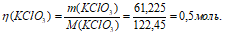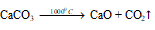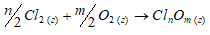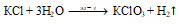Хлорид натрия NaCl — соль щелочного металла натрия и хлороводородной кислоты. Белое кристаллические вещество. Плавится и кипит без разложения. Умеренно растворяется в воде (гидролиза нет);
Относительная молекулярная масса Mr = 58,44; относительная плотность для ж. и тв. состояния d = 2,165; tпл = 800,8º C; tкип = 1465º C;
Видео:Натрий - металл, который взрывается в воде!Скачать

Способ получения
1. Хлорид натрия можно получить путем взаимодействия натрия и разбавленной хлороводородной кислоты, образуются хлорид натрия и газ водород:
2Na + 2HCl = 2NaCl + H2↑.
2. При комнатной температуре, в результате взаимодействия натрия и хлора, образуется хлорид натрия:
2Na + Cl2 = 2NaCl
3. Концентрированный раствор гидроксида натрия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид натрия, газ аммиак и вода:
NaOH + NH4Cl = NaCl + NH3↑ + H2O
4. При взаимодействии с разбавленной и холодной хлороводородной кислотой пер окси д натрия образует хлорид натрия и пероксид водорода:
5. Разбавленная хлороводородная кислота реагирует с гидроксидом натрия . Взаимодействие хлороводородной кислоты с гидроксидом натрия приводит к образованию хлорида натрия и воды:
NaOH + HCl = NaCl + H2O
6. В результате взаимодействия сульфата натрия и хлорида бария образуется сульфат бария и хлорид натрия:
Видео:Взаимодействие галогенидов с хлорной водойСкачать

Качественная реакция
Качественная реакция на хлорид натрия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид натрия образует нитрат натрия и осадок хлорид серебра:
NaCl + AgNO3 = NaNO3 + AgCl↓
Видео:Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

Химические свойства
1. Хлорид натрия вступает в реакцию со многими сложными веществами :
2.1. Хлорид натрия взаимодействует с кислотами :
2.1.1. Хлорид натрия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата натрия и газа хлороводорода:
а если температуру опустить до 50º С, то твердый хлорид натрия и концентрированная серная кислота образуют гидросульфат натрия и газ хлороводород:
2.2. Хлорид натрия способен вступать в реакцию обмена со многими солями :
2.2.1. Твердый хлорид натрия реагирует с концентрированной и горячей серной кислотой и твердым перманганатом калия . Взаимодействие хлорида натрия с перманганатом калия и серной кислотой приводит к образованию сульфата марганца, натрия, калия, газа хлора и воды:
2.2.2. Хлорид натрия взаимодействует с гидросульфатом натрия при температуре 450–800º C . При этом образуются сульфат натрия и хлороводородная кислота:
2.2.3. При взаимодействии холодного хлорида натрия с насыщенным нитритом серебра выделяются нитрат натрия и осадок хлорид серебра:
NaCl + AgNO2 = NaNO2 + AgCl↓
Видео:Хлор – жёлтый газ (часть 1). Химия – ПростоСкачать

Лабораторный и промышленный способы получения хлората калия. Получение хлорной извести
Задача 827.
Рассчитать, какое количество бертолетовой соли можно получить из 168 г гидроксида калия.
Решение:
М(КОН) = 56 г/моль, m(KOH) = 6 . 56 = 336 г;
М(KClO3) = 122,45 г/моль, m(KClO3) = 122,45 г.
Уравнение реакции имеет вид:
Находим массу бертолетовой соли из пропорции:
168 : 336 = х : 122,45; х = (168 . 122,45)/336 = 61,225 г.
Количество бертолетовой соли рассчитаем из уравнения:
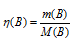
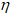
m(B) — масса вещества, г;
M(B) — молярная масса вещества (В), г/моль.
Ответ: m(KClO3) = 61,225 г; М(KClO3) = 0,5 моль.
Задача 828.
Как получить хлорную известь, исходя из карбоната кальция, хлорида натрия и воды? Написать уравнения процессов, которые необходимо для этого осуществить. Какие при этом получаются побочные продукты?
Решение:
Получение хлорной извести, исходя из карбоната кальция, хлорида натрия и воды.
а) При нагревании в 1000 0 С карбонат кальция разлагается на оксид кальция и углекислый газ:
б) Оксид кальция, растворяясь в воде, образует гидроксид кальция:
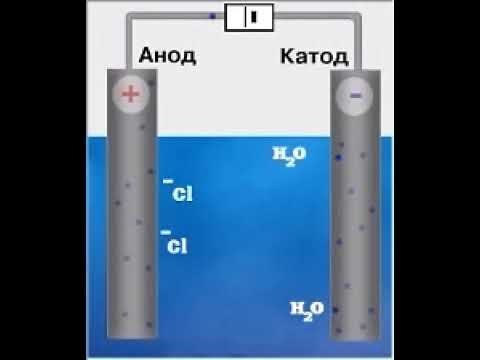
в) Электролизом водного раствора хлорида натрия можно получить хлор, который выделяется у анода:
у катода: 2Н2О + 2 
у анода: 2Cl — +2 
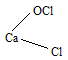
г) При действии хлора на гашеную известь получается так называемая белильная (или хлорная) известь и вода:
CaOCl2 соответствует структурная формула:
Хлорная известь применяется для отбелки растительных волокон (тканей, бумаги) и для дезинфекции.
Задача 829.
Обосновать невозможность получения оксидов хлора непосредственным взаимодействием хлора с кислородом.
Решение:
Хлор непосредственно не взаимодействует с кислородом. Это обусловлено небольшой энергией связи Cl—O и невозможностью использования высоких температур для осуществления реакций:
Для них 



2Cl2(г) + О2(г) → 2Cl2O; 
Из данного уравнения реакции видно, что процесс идёт с поглощением теплоты. Так как 

Исходя из уравнения:



При положительном значении дельта 






Задача 830.
Указать лабораторный и промышленный способы получения хлората калия.
Решение:
а) В лаборатории хлорат калия получают электролизом горячего раствора КCl:
При охлаждении раствора хлорат калия выпадает в осадок, так как мало растворим в холодной воде.
б) В промышленности хлорат калия получают пропусканием хлора в горячий раствор гидроксида калия:
3Cl2 + 6KOH 
Поскольку хлорат калия (или бертолетовая соль) мало растворим в холодной воде, то при охлаждении раствора он выпадает в осадок.
Видео:Натрия хлорид раствор инструкция по применению препарата: Показания, как применять, обзор препаратаСкачать

Лабораторная работа № 2
Лабораторная работа № 2
Тема: Галогены и их соединения
Цель работы: Изучить окислительно-восстановительные свойства галогенов и их важнейших соединений; провести качественные реакции на галогены и галогенид-ионы.
Теоретическое введение. Галогены составляют главную подгруппу VII группы Периодической системы химических элементов. К ним относятся фтор, хлор, бром, иод и астат. Их атомы имеют электронную конфигурацию внешнего уровня ns2np5. Стремясь завершить внешний уровень, атомы этих элементов присоединяют по одному электрону, проявляя степень окисления, равную -1. Такую степень окисления галогены имеют в соединениях с водородом и металлами. Кроме фтора, обладающего самой высокой электроотрицательностью, атомы галогенов могут проявлять и положительные степени окисления: +1, +3, +5, +7.
Молекулы галогенов двухатомны. В воде растворяются плохо, зато легко растворимы в органических растворителях.
Все галогены в свободном состоянии – сильные окислители. Окислительная активность галогенов уменьшается с увеличением порядкового номера, т. е. с увеличением атомного радиуса.
Большое техническое значение имеют галогеноводороды (HF, HCl, HBr, HI), в особенности хлороводород, водный раствор которого называется соляной кислотой. В этих соединениях галогены находятся в отрицательной степени окисления (-1), поэтому они являются восстановителями. Восстановительные свойства галогеноводородов возрастают в порядке, обратном увеличению окислительных свойств галогенов. Таким образом, наиболее сильным среди галогеноводородов восстановителей является йодоводород.
Посуда и принадлежности
Реактивы (часть 1)
• Бромид натрия, NaBr, раствор и кристаллический
• Иодид калия, КJ, раствор и кристаллический
• Хлорная вода, Сl2 +H2O
• Бромная вода, Вr2+H2O
• Серная кислота, Н2SO4, концентрированная
• Йодная вода, J2+H2О
• Хлорид натрия, NaCl, кристаллический
• Нитрат серебра, АgNO3, раствор
• Хлорид железа (III), FeCl3, раствор
• Цинк, Zn, порошок
• Перманганат калия, КMnO4, кристаллический
• Соляная кислота, НСl, концентрированная
• Азотная кислота, HNO3, 2М раствор
• Гидроксид аммония, NH3·H2O, концентрированный раствор
Опыт 1. Исследование состава и свойств хлорной воды
Откройте пробирку с хлорной водой и отметьте запах свободного хлора (осторожно!). При растворении в воде хлор частично реагирует с водой по уравнению:
При этом равновесие сильно смещено влево. Поэтому хлорной водой можно пользоваться для всех реакций, где требуется свободный хлор. Под влиянием света увеличивается скорость реакции разложения непрочной хлорноватистой кислоты.
Реакция (2) вызывает постепенное смещение равновесия реакции (1) вправо. Поэтому хлорную воду следует хранить в склянке из темного стекла или в темном месте.
В чистую пробирку внести 4-5 капель синего лакмуса и несколько капель полученной хлорной воды. Что происходит с окраской раствора лакмуса? На что это указывает? Доказать присутствие в хлорной воде ионов Сl‾, добавив в пробирку с несколькими каплями хлорной воды 2-3 капли нитрата серебра. Выпадает ли белый творожистый осадок АgCl?
Опыт 2. Окислительные свойства свободных галогенов (степень окисления равна 0)
а) Сравнительная характеристика окислительных свойств свободных галогенов. В одну пробирку налить бромид натрия, в две другие — раствор иодида калия. Во все три пробирки добавить немного органического растворителя-бензола. В две пробирки с раствором бромида и иодида внести по 3-4 капли хлорной воды, с раствором иодида калия — столько же бромной воды. Содержимое пробирок перемешать стеклянной палочкой и по окраске полученного слоя органического растворителя определить, какой галоген выделяется в свободном виде в каждой из пробирок. Написать уравнения реакций взаимного вытеснения галогенов в молекулярной и ионной формах. Указать окислитель и восстановитель в каждом случае.
в) Окисление бромом цинка. Внести в пробирку 3-5 капель бромной воды и немного порошка цинка. Перемешать стеклянной палочкой. Отметить обесцвечивание бромной воды и указать причину этого явления. Написать соответствующее уравнение реакции.
Опыт 3. Сравнительная характеристика восстановительных свойств ионов галогенов (галогеноводородов)
а) Восстановление серной кислоты. В одну пробирку положить 2 – 3 кристаллика хлорида натрия, во вторую — бромида натрия, в третью — иодида калия. Добавить к ним по 2 -3 капли концентрированной серной кислоты. Наблюдать выделение белого дыма во всех пробирках в первый момент (влажные галогенводороды). Отметить выделение бурых паров брома и диоксида серы во второй пробирке, фиолетовых паров йода, серы и сероводорода в третьей пробирке, образующихся вследствие окислительно-восстановительных реакций между получившимися HBr и HJ и избытком концентрированной серной кислоты. Протекала ли вторичная реакция в опыте получения хлороводорода? Написать:
· уравнения реакций взаимодействия: хлорида, бромида, иодида калия или натрия с серной кислотой в начале опыта,
· уравнения реакций взаимодействия полученных галогенводородов с избытком серной кислоты.
Расположите галогенводороды в порядке возрастания их восстановительной активности.
б) Восстановление хлорида железа (III). В 2 пробирки внести по 3–4 капли растворов: в одну – бромида калия, в другую – иодида калия. В обе пробирки добавить по 3–4 капли бензола и 1–2 капли хлорида железа (III).
· Наблюдается ли изменение окраски органического растворителя? В каком случае произошло восстановление хлорида железа (III)? Написать соответствующее уравнение реакции. Пойдет ли аналогичная реакция с хлоридом калия? Объясните причину изменения восстановительных свойств ионов галогенов, исходя из их электронной структуры.
Опыт 4. Действие йода на крахмал (реактив на свободный йод)
В пробирку внести 5 – 6 капель свежеприготовленного крахмального раствора и добавить 1-2 капли йодной воды.
· Отметить изменение окраски раствора.
· Окрашивается ли крахмал бромной водой и хлорной водой?
Опыт 5. Реакция обнаружения ионов галогенов. а) Получение галогенпроизводных серебра ( качественная реакция). Внести в три пробирки по 3-4 капли растворов следующих солей: в первую – хлорида натрия, во вторую – бромида натрия, в третью – иодида калия. В каждую пробирку добавить по 1-2 капли раствора нитрата серебра до выпадения характерных творожистых осадков солей серебра галогеноводородных кислот.
· Отметить окраску осадков галогенидов серебра, написать молекулярные и ионные уравнения соответствующих реакций.
б) Отношение галогенпроизводных серебра к азотной кислоте и аммиаку. Каждый осадок, полученный в предыдущем опыте а), разделить на 2 пробирки и прилить в одну из них 1-2 капли 2М раствора азотной кислоты, в другую – насыщенный раствор аммиака.
· Что происходит в каждом случае? Сделать вывод о растворимости галогенпроизводных серебра в азотной кислоте.
· Написать уравнение растворения хлорида серебра в аммиаке, учитывая, что реакция сопровождается образованием комплексного соединения – хлорида диамминсеребра.
· Пользуясь значениями произведений растворимости (ПР), объяснить неполную растворимость в аммиаке бромида и практическую нерастворимость иодида серебра.
ПРAgBr = 7,7 ·10-13
Тема: Сера и её соединения
Цель работы: Изучить свойства серы и ее соединений.
Теоретическое введение. Сера является типичным представителем элементов главной подгруппы 6 группы периодической системы. Сера – это неметалл, и в реакциях с металлами она является окислителем. Однако при взаимодействии с более сильными окислителями сера проявляет восстановительные свойства. В соединениях сера находится в степенях окисления -2, +4 и +6. Соединения серы (II) – восстановители, серы (VI) – окислители, а серы (IV) проявляют окислительно-восстановительную двойственность.
Сера имеет аллотропнные модификации. Существование аллотропных модификаций серы связано с её способностью образовывать устойчивые гомоцепи – S – S –
Серная кислота — самое важное соединение серы. Она производится в огромных количествах и применяется в производстве удобрений, в нефтехимии, при получении химических реактивов, для обработки металлов. Сильный окислитель. Окислительная способность серной кислоты повышается с увеличением ее концентрации в растворе. Концентрированная серная кислота окисляет металлы, находящиеся в ряду напряжений до серебра.
Сероводород — ядовитый газ, обладающий характерным запахом гниющего белка. Раствор H2S в воде обладает слабыми кислотными свойствами. Обладает ярко выраженными восстановительными свойствами.
С кислородом сера образует два оксида (SO2 и SO3), которым соответствуют сернистая (H2SO3) и серная (H2SO4) кислоты. Сернистая кислота может обладать двойными свойствами, т. е. может проявлять свойства восстановителя и свойства окислителя в зависимости от того, с каким веществом она реагирует.
Посуда и принадлежности
Реактивы (часть 2)
• Железо, Fe, гвозди
• Цинк, Zn, гранулы
• Серная кислота, H2SO4: разбавленная, 85%-ная и 96%-ная
• Сульфит натрия, Na2SO3, раствор
• Бромная вода, Br2 + Н2О
• Йодная вода, J2 + Н2О
• Перманганат калия, КМnO4, раствор
• Бихромат калия, K2Cr2O7, раствор
• Азотная кислота, HNO3, концентрированная
• Сульфид натрия, Na2S, раствор и кристаллич.
• Соляная кислота, НС1, разбавленная
• Сульфат меди, CuSO4 раствор
• Ацетат свинца, РЬ(СН3СОО)2, раствор
• Сульфат никеля, NiSO4, раствор
• Хлорная вода, Cl2 + Н2О
• Тиосульфат натрия, Na2S2O3, раствор
• Сульфат натрия, Na2SO4, раствор
• Хлорид бария, ВаCl2, раствор
• Нитрат свинца, РЬ(NO3)2, раствор
• Нитрат серебра, AgNO3, раствор
• Хлорид железа (III), FeCl3, раствор
Опыт 1. Аллотропия серы. Демонстрационный опыт
а) Наполнить тигель на 1/4 часть порошком серы и, укрепив в штативе, осторожно, избегая перегрева, нагреть в пламени горелки, внимательно наблюдая происходящие изменения и доводя серу постепенно до кипения. Кипящую жидкость вылить из тигля тонкой струей в стакан с водой. Если сера при выливании загорится, то, не обращая на это внимание, вылить ее до конца, а оставшуюся в тигле горящую серу потушить, накрыв тигель крышечкой. Вынуть охлажденную серу из воды, оценить ее свойства. Оставить пластическую серу лежать до конца занятия. Она постепенно станет ломкой и хрупкой.
б) Расплавить серу в тигле при слабом нагревании. Оставить тигель охлаждаться до тех пор, пока на поверхности серы появится корка. Пробив в ней посередине отверстие (диаметром 1-2 см), вылить серу, не успевшую застыть. Наблюдать образовавшиеся на стенках тигля кристаллы моноклинной серы.
Опыт 2. Взаимодействие серы с азотной кислотой
Небольшой кусочек серы поместить в цилиндрическую пробирку с 5-6 каплями концентрированной азотной кислоты.
Пробирку закрепить в держателе, нагреть ее пламенем горелки. Отметить выделение газа NO2 и уменьшение кусочка серы. После этого дать пробирке остыть. Несколько капель полученного раствора перенести в другую пробирку, добавить 3-5 капель дистиллированной воды и столько же хлорида бария. Выпавший при этом осадок является солью серной кислоты — сульфатом бария. Написать уравнение реакции взаимодействия серы с азотной кислотой. Составить уравнение электронного баланса.
Опыт 3. Изучение свойств сероводорода
а) Качественная реакция на сероводород и его соли. Налить в пробирку около 2мл сульфата меди, добавить 2-3 капли сероводородной воды. Повторить опыт, последовательно используя (вместо сульфата меди) растворы следующих солей: ацетата свинца, сульфата никеля, сульфата марганца.
Написать уравнения соответствующих реакций, отметить цвет образующихся осадков.
б) Восстановительные свойства сульфидов. Налить в первую пробирку 1мл бромной воды. Аккуратно положить в эту же пробирку 3-4 кристаллика сульфида натрия и перемешать. Записать результаты наблюдений и дать им объяснение, записав уравнение реакции.
Во вторую пробирку налить 1мл раствора перманганата калия, добавить 2-3 капли раствора серной кислоты. Аккуратно положить в эту же пробирку 3-4 кристаллика сульфида натрия и перемешать.
Записать результаты наблюдений, дать им объяснение, записав уравнение реакции. В третью пробирку налить 1мл раствора бихромата калия и 2-3 капли серной кислоты. Аккуратно положить в эту же пробирку 3-4 кристаллика сульфида натрия и перемешать. Записать результаты наблюдений и дать им объяснение, записав уравнение реакции.
Опыт 4. Окислительно-восстановительные свойства солей сернистой кислоты
В 4 пробирки налить несколько миллилитров раствора сульфита натрия. В первую пробирку прилить несколько капель бромной воды, во вторую — йодной воды. Объяснить обесцвечивание растворов.
Содержимое третей и четвертой пробирок подкислить несколькими каплями разбавленной серной кислоты. Затем в третью пробирку добавить несколько капель раствора перманганата калия. Чем объяснить обесцвечивание розовой окраски? В четвертую пробирку прилить несколько капель раствора бихромата калия. Объяснить произошедшие изменения.
Написать уравнения окислительно-восстановительных реакций между: а) йодной водой и сульфитом натрия; в) бромной водой и сульфитом натрия; г) сульфитом натрия и перманганатом калия в кислой среде; д) сульфитом натрия и бихроматом калия в кислой среде.
Составить уравнения электронного или электронно-ионного баланса. Указать, в каких реакциях сульфит натрия — окислитель, в каких — восстановитель.
Опыт 5. Свойства серной кислоты различной концентрации
а) Взаимодействие железа с концентрированной и разбавленной серной кислотой. В три пробирки налить: в первую — разбавленную серную кислоту, во вторую — 85%-ную, в третью — 96%-ную серную кислоту. В каждую из них добавить по несколько опилок железа. В каких случаях протекает реакция, в каких — нет? Какой газ выделяется из первой пробирки, какой — из второй? Написать уравнения соответствующих реакций
б) Взаимодействие цинка с серной кислотой. В первую пробирку налить разбавленную серную кислоту. Добавить гранулу цинка. Какой газ выделяется? Во вторую пробирку налить 85%-ную серную кислоту. Добавить цинк. Осторожно понюхать выделяющийся газ. Какому газу соответствует данный характерный запах (запах горящей серы)? Затем эту пробирку подогреть. Объяснить, чем вызвано помутнение раствора, а затем появление характерного запаха гниющего белка. Написать четыре уравнения реакций: одно — взаимодействия цинка с разбавленной и три — с концентрированной серной кислотой.
Опыт 6. Свойства солей тиосерной кислоты
а) Взаимодействие тиосульфата натрия с хлорсодержащими соединениями.. В первой пробирке к раствору тиосульфата натрия прибавить небольшое количество соляной кислоты. Какой газ выделяется? Написать уравнение протекающей реакции. Во второй пробирке к раствору тиосульфата натрия прибавить небольшое количество хлорной воды. Написать уравнение реакции, имея в виду, что при реакции образуется H2SO4.
б) Взаимодействие тиосульфата натрия с хлоридом железа (III). В пробирку с 5-6 каплями раствора хлорида железа (III) добавить столько же раствора тиосульфата натрия. Отметить изменение окраски, обусловленное реакцией образования комплексного соединения Na[Fe(S2O3)2]. Пробирку поставит в штатив и наблюдать постепенное изменение окраски вследствие восстановления железа (III) до железа (II) и окисления лиганда S2O32- в тетратионат — ион S4O62- . Написать уравнение реакции получения комплексного соединения Na[Fe(S2O3)2]. Его дальнейшее взаимодействие с избытком хлорида железа (III) протекает по уравнению:
Опыт 7. Получение малорастворимых сульфатов
Получить на предметном стекле осадки сульфатов бария, свинца, серебра, прибавляя по капле растворимого сульфата натрия к капле раствора хлорида бария, нитрата свинца и нитрата серебра. Рассмотреть полученные осадки. Написать в ионной форме соответствующие уравнения реакций, являющихся реакциями обнаружения иона SO42-.
1. Написать уравнения реакций в молекулярной и ионной формах.
2. Составьте уравнения реакций гидролиза. Объясните результаты гидролиза в первом и втором случаях. Назовите продукты гидролиза.
а) сульфида натрия,
3. Напишите уравнения реакций. Являются ли данные реакции окислительно-восстановительными и почему? Назовите вещества, которые образуются при взаимодействии FeS:
а) с соляной кислотой,
б) с концентрированной азотной кислотой.
4. Напишите соответствующие уравнения реакций. Назовите продукты реакции взаимодействия хлорида железа (III):
а) с сероводородом,
б) с сульфидом аммония.
5. При взаимодействии 16 г раствора серной кислоты с раствором хлорида бария выделилось 5,7 г осадка. Выразите в процентах концентрацию раствора серной кислоты.
6. Сколько литров сероводорода при н. у. следует растворить в 600 мл воды, для получения 1,5 %-ного раствора.
7. Приведеите по три примера соединений, в которых сера проявляет степень окисления -2, +4, +6
8. Допишите уравнения возможных реакций, укажите окислитель и восстановитель в каждой реакции:
а) взаимодействие иодида калия с бромом
б) взаимодействие бромида калия с хлором
в) взаимодействие хлорида калия с иодом
г) взаимодействие иодата калия с хлором
д) взаимодействие хлората калия с бромом
9. В 40 мл 6 %-ного раствора нитрата серебра (ρ=1,05 г/мл) растворили 250 мл хлороводорода. Вычислите массу полученного осадка
10. Какой объем водорода (н. у.) можно получить при действии 80 мл 0,5 М раствора соляной кислоты на 2,6 г цинка?
11. При разложении галогенида аммония массой 4,9 г получили аммиак, объем которого при нормальных условиях равен 1,12 л. Какой галогенид был взят?
12. В зернохранилищах для истребления насекомых часто сжигают серу, исходя из нормы 24 г на 1 м3 помещения. Рассчитайте, сколько киллограммов диоксида серы должно получиться при газации помещения 100 м3
13. Имеется две склянки без надписей: в одной из них разбавленная соляная кислота, в другой разбавленная серная кислота. Можно при помощи кусочка мрамора узнать, в какой из склянок находится серная кислота? Ответ подтвердить уравнениями химических реакций с выводами
14. При обработке 1,84 г смеси хлорида калия и сульфата калия концентрированной серной кислотой было получено 1,92 г чистого сульфата калия. Сколько грамм содержалось в смеси каждого из упомянутых веществ
15. Из 320 т серного колчедана, содержащего 45%серы, было получено 405 т серной кислоты (в пересчете на 100- процентную). Вычислите выход кислоты
16. Сколько тонн безводной серной кислоты должно получиться по расчету из 800 т серного колчедана, содержащего 45% серы
17. Для очистки коксового и генераторного газов, а также природных горючих газов от вредной примеси – сероводорода и утилизация содержащейся в них серы газовая смесь пропускается через природный гидроксид железа (III) – болотную руду. Получившийся при этом сульфид железа (III) на влажном воздухе окисляется с образованием вновь гидроксида железа (III) и элементарной серы. Запишите уравненияреакций описанных превращений.
18. В Гуардаке (поселке Туркмении) путем подземной выплавки серы (закачкой горячей воды в пласты)ежегодно добывают примерно 350 тыс тонн серы. Сера содержит 7,8 % примесей. Вычислите, сколько тонн сернистого газа может образоваться из такого количества серы.
19. Про пропускании сероводорода через бромную воду окраска, присущая брому, исчезает, одновременно образуется свободная сера. Составьте уравнение этой реакции
20. Поступающий в продажу сульфид железа должен содержать не менее 97 % FeS. Какой объем сероводорода можно получить из 1 кг такого реактива (при н. у.)
💡 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Как получить НАТРИЙ из ВОДЫ?Скачать

Распознавание растворов хлорида натрия, карбоната натрия и сульфата натрияСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

электролиз хлорида натрияСкачать
Взаимодействие HCl с раствором хлорида натрияСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Получил ХЛОРАТ калия из поваренной солиСкачать

Опыты по химии. Получение хлороводорода и растворение его в водеСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Приготовление раствора с заданной концентрациейСкачать

Взаимодействие галогенидов с хлорной водойСкачать