Хлорид кальция CaCl2 — соль щелочноземельного металла кальция и хлороводородной кислоты. Белый, плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 110,98; относительная плотность для тв. и ж. состояния d = 2,51; tпл = 782º C; tкип = 1960º C;
- Способ получения
- Качественная реакция
- Химические свойства
- Взаимодействие углекислого газа с веществами и его химические свойства
- Взаимодействие с другими веществами:
- Заключение
- Через раствор хлорида кальция пропустите диоксид углерода (из аппарата Киппа). Выпадет осадок карбоната кальция. Продолжайте пропускать диоксид.
- Описание и исходные данные задания, 50% решения + фотография:
- 💡 Видео
Видео:Качественная реакция на углекислый газСкачать

Способ получения
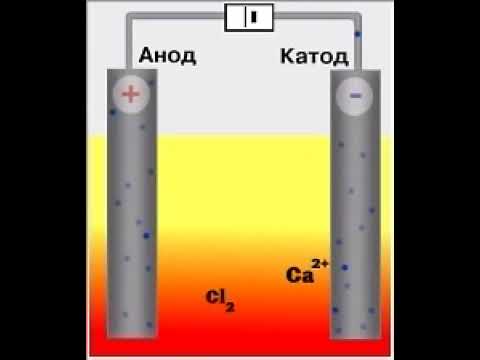
1. Хлорид кальция можно получить путем взаимодействия кальция и хлора :
2. В результате взаимодействия карбоната кальция и соляной кислоты образуется хлорид кальция, углекислый газ и вода:
Видео:хлорид кальция ; электролизСкачать
Качественная реакция
Качественная реакция на хлорид кальция — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид кальция образует нитрат кальция и осадок хлорид серебра:
Видео:Качественная реакция на углекислый газ.Скачать

Химические свойства
1. Хлорид кальция реагирует с простыми веществами:
1.1. В результате реакции между хлоридом кальция и водородом при 600 — 700º С и катализаторах Pt, Fe, Ni образуется гидрид кальция и соляная кислота:
1.2. Хлорид кальция взаимодействует с алюминием при 600 — 700º С и образует на выходе кальций и хлорид алюминия:
3CaCl2 + 2Al = 3Ca + 2AlCl3
2. Хлорид кальция вступает в реакцию со многими сложными веществами :
2.1. Хлорид кальция вступает в реакции с основаниями :
2.1.1. Хлорид кальция взаимодействует с концентрированным раствором гидроксида натрия . При этом образуются гидроксид кальция и хлорид натрия:
CaCl2 + 2NaOH = Ca(OH)2↓ + 2NaCl
2.2. Хлорид кальция реагирует с кислотами:
2.2.1. Твердый хлорид кальция реагирует с концентрированной серной кислотой при кипении , образуя сульфат кальция и газ хлороводород :
2.3. Хлорид кальция вступает в взаимодействие с солями:
2.3.1. В результате реакции между хлоридом кальция и карбонатом натрия образуется карбонат кальция и хлорид натрия:
2.3.2. Хлорид кальция реагирует с фторидом аммония и образует фторид кальция и хлорид аммония:
2.3.3. Хлорид кальция может реагировать с сульфатом калия при 800º С с образованием сульфата кальция и хлорида калия:
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Взаимодействие углекислого газа с веществами и его химические свойства
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
Диоксид углерода + вода ↔ угольная кислота

2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
Аммиак + углекислота = гидрокарбонат аммония

Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Этан + кислород = двуокись углерода + вода + энергия
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода

Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
Пероксид натрия + углекислота → карбонат натрия + кислород

Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Видео:Уроки химии с БСК - Урок "Хлорид Кальция"Скачать

Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?
Спасибо, что указали на ошибку. Исправили.
Скажите пожалуйста На производстве углекислоты мы заменили на комрессорном агрегате старый охладитель углекислого газа с трубками из нержавейки на новый, с латунными трубками. То есть в начале этих трубок охладителя Углекислый газ будет под давлением 16 бар и температурой 130 градусов, на выходе + 10 градусов, всё это с выделением конденсата. Не будет ли какой-то непредвиденной реакции в зоне взаимодействия уг. газа, латуни и воды? Охладитель работает хорошо, но не разрушаться ли трубки от коррозии?
Необходимо определиться для начала, откуда поступает к вам углекислый газ, какие еще газы поступают вместе с углекислым газом в охладитель. У нас, в энергетическом производстве, на определенном участке пароводяного тракта установлены латунные трубки, в которых происходит нагрев теплоносителя. Мы производим замеры растворенного кислорода в конденсате перед подачей его на подогреватели с трубками из латуни. В нашем случае большая концентрация кислорода в воде, при нагревании последней, приводит к коррозии латунных трубок.
Здравствуйте Вячеслав. Углекислый газ поступает с брожения пивного сусла. Углекислый газ (у.г.) сжимается компрессором и при t 130* подаётся на теплообменник (т.о.). хладоносителем t -4*. На латунных стенках т.о. образуется конденсат который отделяется от у.г. в конденсатоотводчике. Содержание кислорода в конденсате не должно быть большим, если вообще не минимальное. После установки нового т.о. конденсатоотводчик стал забиваться непонятной серой массой похожей на мокрый графит. Компрессор разбирали — проблема не в нём (думали одно из графитовых колец размолотило). Разбирать и осматривать т.о. более трудоёмкий процесс.
Затрудняюсь вам ответить на этот вопрос, надо изучать состав газа на входе в теплообменник. Возможно образование угольной кислоты в теплообменнике. А при наличии кислорода кислота может вызывать коррозию, но это не точно.
Видео:Уроки химии с БСК. Урок №2. Хлорид кальцияСкачать

Через раствор хлорида кальция пропустите диоксид углерода (из аппарата Киппа). Выпадет осадок карбоната кальция. Продолжайте пропускать диоксид.






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Через раствор хлорида кальция пропустите диоксид углерода (из аппарата Киппа). Выпадет осадок карбоната кальция. Продолжайте пропускать диоксид. Осадок исчезнет, т.е. образуется растворимая соль гидрокарбоната кальция. Напишите уравнение реакции.
Решение :
В результате реакции происходит помутнение раствора за счет образования карбоната кальция CaCO 3
При дальнейшем пропускании углекислого газа протекает реакция:
| Если вам нужно решить химию, тогда нажмите ➔ заказать химию. |
| Похожие готовые решения: |
- Молярная масса эквивалента хлорида некоторого элемента равна 38,5 г/моль Вычислите массовую долю хлора в хлориде.
- Вещество содержит углерод, водород и бром. При полном сгорании 0,752 г этого вещества было получено 0,352 г СО2 и 0,144 г Н2О.
- В раствор разбавленной азотной кислоты опустите кусочек меди. Нагрейте содержимое. Напишите уравнение реакции, если в результате образуется соль, газ (одноокись азота) и вода.
- К раствору сульфата меди (II) прилейте раствора гидроксида аммония до появления светло – зеленного осадка основной соли. Напишите уравнение реакции. Назовите соли.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
💡 Видео
Химия 9 класс (Урок№18 - Угарный газ. Углекислый газ.)Скачать

Реакция Хлорида Кальция - CaCl2, Хлорида Аммония и Гексацианоферата(2) Калия - K4[Fe(CN)6]Скачать
![Реакция Хлорида Кальция - CaCl2, Хлорида Аммония и Гексацианоферата(2) Калия - K4[Fe(CN)6]](https://i.ytimg.com/vi/Z3ofQDq16JE/0.jpg)
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

пропускание углекислого газа через воду раствор гидроксида кальцияСкачать

Неметаллы. Тема 24. Оксиды углерода. Видеоопыт «Качественная реакция на углекислый газ»Скачать

9 класс Химия Практическая работа Получение углекислого газа и изучение его свойств.Скачать

Взаимодействие углекислого газа с известковой водой (CO2 + Ca(OH)2 = CaCO3 + H2O)Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Хлорид кальция и полисиликатыСкачать

Реакция гидроксида кальция (известкового молока) с углекислым газом | Ca(OH)2+CO2=CaCO3+H2OСкачать

Оксид углерода(IV). Углекислый газ. Состав и строение молекулы. Получение. Свойства и применениеСкачать

Молярная масса. 8 класс.Скачать











