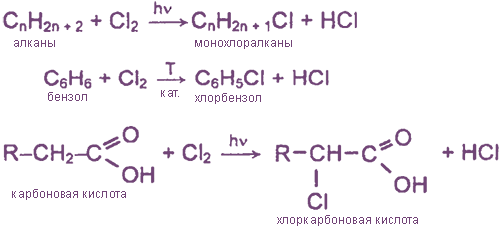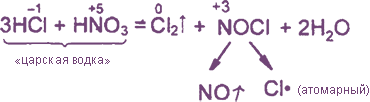Cl2 при об. Т — газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха — в 2,5 раза, малорастворим в воде (
6,5 г/л); х. р. в неполярных органических растворителях. В свободном виде встречается только в вулканических газах.
- Способы получения
- Промышленный
- Лабораторные
- Химические свойства
- Реакции с металлами
- Реакции с неметаллами
- Вытеснение свободных неметаллов (Вr2, I2, N2, S) из их соединений
- Диспропорционирование хлора в воде и водных растворах щелочей
- Взаимодействие хлора с органическими веществами
- Хлороводород и соляная кислота
- Газообразный хлороводород
- Физические и химические свойства
- Способы получения
- Водный раствор HCl — сильная кислота (хлороводородная, или соляная)
- Химические свойства соляной кислоты
- Реакции с органическими соединениями
- Оксиды и оксокислоты хлора
- Кислород: химия кислорода
- Кислород
- Положение в периодической системе химических элементов
- Электронное строение кислорода
- Физические свойства и нахождение в природе
- Способы получения кислорода
- Соединения кислорода
- Химические свойства
- Химические свойства хлора
- 🌟 Видео
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Способы получения
Основаны на процессе окисления анионов Cl —
2Cl — — 2e — = Cl2 0
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Промышленный
Электролиз водных растворов хлоридов, чаще — NaCl:
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Лабораторные
Окисление конц. HCI различными окислителями:
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Химические свойства
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl — :
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Реакции с металлами
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Видео:Уравнивание реакций горения углеводородовСкачать

Реакции с неметаллами
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Видео:Хлор. 9 класс.Скачать

Вытеснение свободных неметаллов (Вr2, I2, N2, S) из их соединений
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Диспропорционирование хлора в воде и водных растворах щелочей
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl — , а другие в положительной степени окисления входят в состав анионов ClO — или ClO3 — .
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 — гипохлориты; КClO3 — хлорат калия (бертолетова соль).
Видео:Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Взаимодействие хлора с органическими веществами
а) замещение атомов водорода в молекулах ОВ
б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
Хлороводород и соляная кислота
Видео:Начинаем решать 10-й вариант сборника Добротина (номера 1-28)Скачать

Газообразный хлороводород
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Физические и химические свойства
HCl — хлорид водорода. При об. Т — бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Способы получения
1. Синтез из простых веществ:
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
Видео:8 класс. Составление уравнений химических реакций.Скачать

Водный раствор HCl — сильная кислота (хлороводородная, или соляная)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется
450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Химические свойства соляной кислоты
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н +
а) с металлами (до Н):
б) с основными и амфотерными оксидами:
в) с основаниями и амфотерными гидроксидами:
г) с солями более слабых кислот:
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl — окисляется до свободного галогена:
2Cl — — 2e — = Cl2 0
Уравнения реакция см. «Получение хлора». Особое значение имеет ОВР между соляной и азотной кислотами:
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Реакции с органическими соединениями
а) с аминами (как органическими основаниями)
б) с аминокислотами (как амфотерными соедимнеиями)
Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора — чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183 о С.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Видео:8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Химические свойства хлора
Межэлектронное отталкивание валентных электронов в атоме хлора заметно меньше, чем в атоме фтора, и лишний электрон не так сильно дестабилизирует систему, поэтому из всех атомов галогенов атом хлора обладает максимальным сродством к электрону.
Большая прочность молекул хлора по сравнению с молекулами фтора объясняется не только эффектом обратного экранирования в атоме фтора, приводящим к ослаблению связи в его молекулах. В молекулах хлора имеет место дополнительное π-связывание за счет p-электронов и d-атомной орбитали. π-связывание возникает по донорно-акцепторному механизму, когда каждый атом хлора одновременно является и донором и акцептором электронной пары (дативная связь). В рамках МВС дополнительное π-связывание можно представить схемой:
Здесь знаком σ показано возникновение основной σ-связи по обменному механизму, а стрелками – дополнительное π-связывание (неподеленная p-электронная пара одного атома хлора взаимодействует с d-АО другого). При этом происходит лишь частичный перенос электронной плотности на d-АО атома партнера и поэтому порядок связи менее 1,5.
Наличие 3d-АО атома хлора резко повышает валентные возможности и вариации его положительных степеней окисления. Теоретически максимальная ковалентность хлора может достигать 9 (9 АО при n=3). Однако практически наблюдаемая координационная валентность хлора не превышает 6. При взаимодействии атомов хлора между собой и с другими элементами хлор проявляет степени окисления -1, 0, +1, +3, +4, +5, +6, +7. Разнообразие валентных состояний и степеней окисления делают химию хлора во многих отношениях отличной от химии фтора. В то же время оба элемента – типичные неметаллы с ярко выраженными окислительными свойствами. Поэтому главное в химии этих элементов – функционирование в качестве анионообразователей в бинарных и более сложных соединениях.
В большинстве соединений хлор как сильно электроотрицательный элемент (ОЭО=3,0) выступает в отрицательной степени окисления -1. В соединениях же с более электроотрицательными фтором, кислородом и азотом он проявляет положительные степени окисления. Особенно разнообразны соединения хлора с кислородом, в которых хлор проявляет степени окисления +1, +3, +5, +7, а также +4 и +6.
Хлор – активный окислитель:
Он весьма энергично реагирует с металлами и большинством неметаллов (за исключением кислорода, азота, благородных газов, углерода), легко окисляет многие сложные соединения.
Так, расплавленный натрий сгорает в атмосфере хлора с ослепительной вспышкой. Подобным образом ведут себя многие металлы и неметаллы: медь, олово, порошок сурьмы, кристаллический фосфор, натрий…
2Na + Cl2 = 2NaCl, ΔH° = -822 кДж
2P + 3Cl2 = 2PCl3, ΔH° = -624 кДж
Фосфор, мышьяк, сурьма, кремний, натрий, калий и магний уже при низкой температуре реагируют с хлором с выделением большого количества теплоты.
Sb + 3/2Cl2 = SbCl3, ΔH° = -381,2 кДж
S + 2Cl2 = SCl4 (при нагревании)
Однако реакция с водородом при стандартных условиях заморожена. При повышенной температуре, сильном освещении (УФ) или электрическом разряде хлор взаимодействует с водородом со взрывом
H2 + Cl2 + hν = 2HCl, ΔH° = -184 кДж
Эта реакция протекает по цепному механизму:
Аналогично протекают реакции хлора с различными углеводородами.
Хлор взаимодействует с другими галогенами:
При этом в реакции со фтором хлор выступает в качестве восстановителя, а в остальных случаях в качестве окислителя.
Хлор способен окислять и сложные вещества:
Вода катализирует многие реакции с участием хлора. Например, хорошо осушенный хлор при стандартных условиях практически не реагирует со многими металлами, в частности с железом. Это позволяет хранить хлор в стальных баллонах.
Наиболее эффективным окислителем хлора в водной среде является сам хлор, вступающий при растворении в воде в реакцию диспропорционирования, для протекания которой наиболее благоприятна щелочная среда, способствующая образованию простых и сложных анионов:
3Cl2 + 6OH – ↔ 5Cl – + ClO3 – + 3H2O (2), Kp = 7,5·10 15
Cl2 + 2OH – ↔ Cl – + ClO – + H2O (3)
Равновесие реакции (1) сдвинуто влево (Kp = 4,2·10 -4 ) поэтому молярная концентрация хлорноватистой кислоты при 20 °C достигает лишь 0,03 моль/л.
Растворение хлора в водном растворе щелочи (реакции 2 и 3) практически нацело смещает равновесие вправо. Состав образующихся при этом солей зависит от температуры.
Образующийся на первой стадии гипохлорит анион склонен к диспропорционированию:
3ClO – ↔ ClO3 – + 2Cl – (a)
4ClO – ↔ ClO4 – + 3Cl – (b)
2ClO – ↔ ClO2 – + Cl – (c)
Как показывает опыт, при комнатной и более низкой температуре скорость всех реакций диспропорционирования аниона ClO – низка. Поэтому реакция хлора с холодным (лучше охлаждаемым льдом) раствором гидроксида натрия или калия позволяет получить смесь хлорида натрия и гипохлорита натрия, хлорида калия и гипохлорита калия соответственно, называемых жавелевой водой, из которой можно выделить кристаллогидраты солей NaClO или KClO. Аналогичная реакция хлора с гидроксидом кальция дает смешанную соль CaCl(ClO) или CaCl2·Ca(ClO)2 и CaCl2·Ca(OH)2, называемой хлорной известью.
При нагревании до 70-80 °C, а тем более до кипения, реакция (a) протекает быстро, причем с большой скоростью, чем реакция (c), в то время как скорость реакции (b) остается очень низкой. Следовательно, реакция хлора с горячим раствором щелочи позволяет получать соли иона ClO3 – (например, KClO3 – бертолетова соль).
🌟 Видео
Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Водород и кислород. 1 часть. 8 класс.Скачать

Решение заданий из Урока 6. Уравнение реакции, расставление коэффициентов, определение типа реакцииСкачать