В неорганической химии существует три основных класса соединений. Это кислоты, щелочи и оксиды. Кислота состоит из катиона водорода и аниона кислотного остатка. Щелочь — из катиона металла и гидроксильной группы. Об оксидах мы поговорим подробнее далее.
- Что такое оксид?
- Оксид калия: формула
- Физические свойства
- Химические свойства К2О
- Реакция с водой
- С другими оксидами
- Взаимодействие с кислотами
- К2О и галогены
- Взаимодействие с аммиаком
- Взаимодействие с органическими веществами
- Получение К2О
- Использование К2О в промышленности
- Хлорид калия: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Что такое оксид?
Это соединение, состоящее из двух разных химических элементов, одним из которых является кислород. Вторым же может быть металл или неметалл. Количество атомов кислорода зависит от валентности второго химического элемента, входящего в состав соединения. Так, например, валентность калия равна одному, поэтому оксид калия будет содержать один атом кислорода и два атома калия. Валентность кальция равна двум, поэтому его оксид будет состоять из одного атома кислорода и одного атома кальция. Валентность фосфора равна пяти, поэтому его оксид состоит из двух атомов фосфора и пяти атомов кислорода.
В этой статье мы более подробно поговорим про оксид калия. А именно — о его физических и химических свойствах, о его применении в различных областях промышленности.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

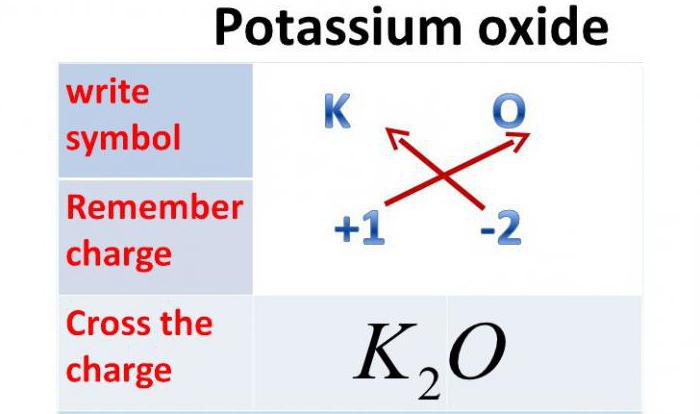
Оксид калия: формула
Так как валентность данного металла равна одному, а валентность кислорода — двум, то это химическое соединение будет состоять из двух атомов металла и одного атома Оксигена. Итак, оксид калия: формула — К2О.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Физические свойства
Рассматриваемый оксид обладает бледно-желтой окраской. Иногда он может быть и бесцветным. При комнатной температуре он обладает твердым агрегатным состоянием.
Температура плавления данного вещества равняется 740 градусам Цельсия.
Плотность составляет 2,32 г/см 3 .
При термическом разложении данного оксида образуется пероксид этого же металла и чистый калий.
Растворим в органических растворителях.
В воде не растворяется, а вступает в реакцию с ней.
Обладает высокой гигроскопичностью.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Химические свойства К2О
Данное вещество обладает типичными для всех основных оксидов химическими свойствами. Рассмотрим химические реакции данного оксида с различными веществами по порядку.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Реакция с водой
В первую очередь оно способно реагировать с водой с образованием в результате гидроксида данного металла.
Уравнение такой реакции выглядит следующим образом:
Зная молярную массу каждого из веществ, из уравнения можно сделать следующий вывод: из 94 граммов рассматриваемого оксида и 18 граммов воды можно получить 112 граммов калий гидроксида.
Видео:Хлор. 9 класс.Скачать

С другими оксидами
Кроме того, рассматриваемый оксид способен реагировать с диоксидом карбона (углекислым газом). При этом образуется соль — карбонат калия.
Уравнение реакции оксида калия и оксида карбона можно записать следующим образом:
Так, можно сделать вывод, что из 94 граммов рассматриваемого оксида и 44 граммов углекислого газа получается 138 граммов калий карбоната.
Также рассматриваемый оксид может вступать в реакцию с оксидом сульфура. При этом образуется другая соль — калий сульфат.
Взаимодействие оксида калия с оксидом сульфура можно выразить следующим уравнением:
Из него видно, что, взяв 94 грамма рассматриваемого оксида и 80 граммов оксида сульфура, можно получить 174 грамма сульфата калия.
Таким же образом К2О может реагировать и с другими оксидами.
Другой тип взаимодействия — реакции не с кислотными, а с амфотерными оксидами. В таком случае образуется не кислота, а соль. Примером такого химического процесса может служить взаимодействие рассматриваемого оксида с оксидом цинка.
Эту реакцию можно выразить следующим уравнением:
Из него видно, что при взаимодействии рассматриваемого оксида и оксида цинка образуется соль под названием калий цинкат. Если знать молярную массу всех веществ, то можно подсчитать, что из 94 граммов К2О и 81 грамма оксида цинка можно получить 175 граммов калий цинката.
Также К2О способен взаимодействовать с оксидом азота. При этом образуется смесь из двух солей: нитрата и нитрита калия. Уравнение этой реакции выглядит таким образом:
Если знать молярные массы веществ, можно сказать, что из 94 граммов рассматриваемого оксида и 92 граммов оксида нитрогена можно получить 101 грамм нитрата и 85 граммов нитрита.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Взаимодействие с кислотами
Самый распространенный случай — оксид калия + серная кислота = сульфат калия + вода. Уравнение реакции выглядит таким образом:
Из уравнения можно сделать вывод, что для получения 174 граммов сульфата калия и 18 граммов воды необходимо взять 94 грамма рассматриваемого оксида и 98 граммов серной кислоты.
Похожим образом происходит химическое взаимодействие между рассматриваемым оксидом и азотной кислотой. При этом образуется нитрат калия и вода. Уравнение этой реакции можно записать следующим образом:
Таким образом, из 188 граммов рассматриваемого оксида и 252 граммов азотной кислоты можно получить 404 грамма нитрата калия и 36 граммов воды.
По такому же принципу рассматриваемый оксид может реагировать и с другими кислотами. В процессе этого будут образовываться другие соли и вода. Так, к примеру, при реакции этого оксида с фосфорной кислотой получается фосфат и вода, с хлоридной кислотой — хлорид и вода и так далее.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

К2О и галогены
Рассматриваемое химическое соединение способно реагировать и с веществами данной группы. К галогенам относятся простые соединения, состоящие из нескольких атомов одного и того же химического элемента. Это, например, хлор, бром, иод и некоторые другие.
Итак, хлор и оксид калия: уравнение:
В результате такого взаимодействия образуется две соли: хлорид и гипохлорит калия. Из 94 грамм рассматриваемого оксида и 70 грамм хлора получается 74 грамма хлорида калия и 90 грамм гипохлорита калия.
Видео:Электролиз. 10 класс.Скачать

Взаимодействие с аммиаком
К2О способен реагировать с этим веществом. В результате такого химического взаимодействия образуется гидроксид и амид калия. Уравнение данной реакции выглядит следующим образом:
Зная молярные массы всех веществ, можно вычислить пропорции реагентов и продуктов реакции. Из 94 граммов рассматриваемого оксида и 17 граммов аммиака можно получить 56 граммов гидроксида калия и 55 граммов амида калия.
Видео:ХИМИЯ | Основные классы соединений. Уравнения реакций ч.1Скачать

Взаимодействие с органическими веществами
Из органических химических веществ оксид калия взаимодействует с эфирами и спиртами. Однако эти реакции идут медленно и требуют специальных условий.
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Получение К2О
Данное химическое вещество можно получать несолькими способами. Вот самые распространенные из них:
- Из нитрата калия и металлического калия. Эти два реагента нагревают, в результате чего образуется К2О и азот. Уравнение реакции выглядит следующим образом: 2KNO3 + 10К = N2 + 6К2О.
- Второй способ происходит в два этапа. Сначала происходит реакция между калием и кислородом, в результате чего образуется пероксид калия. Уравнение реакции выглядит так: 2К + О2 = К2О2. Далее пероксид обогащают калием, в результате чего и получают оксид калия. Уравнение реакции можно записать таким образом: К2О2 + 2К = 2К2О.
Видео:8 класс химические свойства оксидов, оснований, кислот, солей и ионные уравненияСкачать

Использование К2О в промышленности
Наиболее часто рассматриваемое вещество используется в сельскохозяйственной промышленности. Данный оксид является одним из компонентов минеральных удобрений. Калий очень важен для растений, так как повышает их стойкость к различным заболеваниям. Также рассматриваемое вещество применяется в строительстве, так как может присутствовать в составе некоторых видов цемента. Кроме того, оно применяется в химической промышленности для получения других соединений калия.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Хлорид калия: способы получения и химические свойства
Хлорид калия KCl — соль щелочного металла калия и хлороводородной кислоты. Белое вещество, плавится и кипит без разложения. Умеренно растворяется в воде.
Относительная молекулярная масса Mr = 74,55; относительная плотность для тв. и ж. состояния d = 1, 984; tпл = 770º C; tкип = 1430º C;
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Способ получения
1. Хлорид калия можно получить путем взаимодействия калия и разбавленной хлороводородной кислоты, образуются хлорид калия и газ водород:
2K + 2HCl = 2KCl + H2↑.
2. При комнатной температуре, в результате взаимодействия калия и хлора, образуется хлорид калия:
2K + Cl2 = 2KCl
3. Концентрированный раствор гидроксида калия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид калия, газ аммиак и вода:
4. Разбавленная хлороводородная кислота реагирует с гидроксидом калия . Взаимодействие хлороводородной кислоты с гидроксидом калия приводит к образованию хлорида калия и воды:
KOH + HCl = KCl + H2O
5. В результате взаимодействия сульфата калия и хлорида бария образуется сульфат бария и хлорид калия:
6. Карбонат калия взаимодействует с разбавленной соляной кислотой , образуя хлорид калия, углекислый газ и воду:
Видео:Хлор – жёлтый газ (часть 1). Химия – ПростоСкачать

Качественная реакция
Качественная реакция на хлорид калия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид калия образует нитрат калия и осадок хлорид серебра:
KCl + AgNO3 = KNO3 + AgCl↓
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Химические свойства
1. Хлорид калия вступает в реакцию со многими сложными веществами :
1.1. Хлорид калия взаимодействует с кислотами :
Хлорид калия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата калия и газа хлороводорода:
1.2. Хлорид калия способен вступать в реакцию с многими солями :
1.2.1. Твердый хлорид калия реагирует с концентрированной и горячей серной кислотой и твердым перманганатом калия . Взаимодействие хлорида калия с перманганатом калия и серной кислотой приводит к образованию сульфата марганца, сульфата калия, газа хлора и воды:
1.2.2. Хлорид калия взаимодействует с гидросульфатом калия при температуре 450–700º C . При этом образуются сульфат калия и хлороводородная кислота:
1.2.3. При взаимодействии концентрированного раствора хлорида калия и насыщенного перхлората натрия выделяются перхлорат калия и хлорид натрия:
KCl + NaClO4 = KClO4↓ + NaCl
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Please wait.
Видео:Химия 9 класс (Урок№16 - Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V).)Скачать

We are checking your browser. gomolog.ru
Видео:2. Ионные уравнения реакций. (практика)Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df9c2e1bb2a9779 • Your IP : 85.95.188.35 • Performance & security by Cloudflare