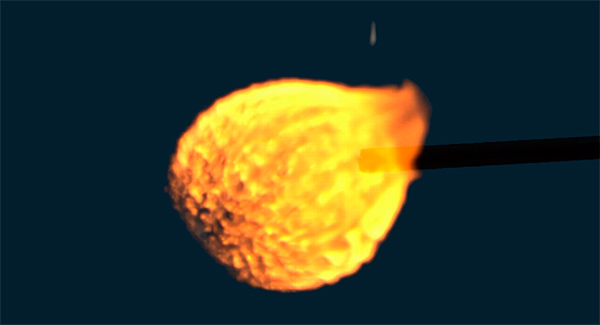
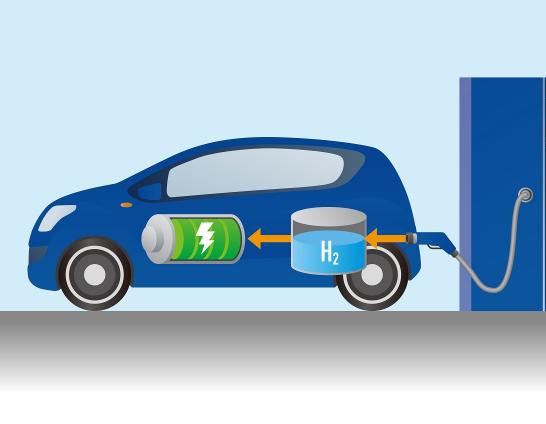
Одной из актуальных проблем является загрязнение окружающей среды и ограниченность энергетических ресурсов органического происхождения. Многообещающим способом решения этих проблем является использование водорода в качестве источника энергии. В статье рассмотрим вопрос горения водорода, температуру и химию этого процесса.
- Что такое водород?
- Химическая реакция горения
- Механизм процесса горения водорода
- Инициация реакции
- Процентное содержание газов в горючей смеси
- Безопасность горения
- Температура реакции горения
- Количество выделяемой теплоты
- Применение водородной горючей смеси в технике: проблемы
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Синтез воды Образование воды при горении
- Синтез воды это
- Горение водорода в кислороде
- Определение содержания кислорода в воздухе
- 🎦 Видео
Видео:Горение водородаСкачать

Что такое водород?
Прежде чем рассматривать вопрос, какая температура сгорания водорода, необходимо вспомнить, что собой представляет это вещество.
Водород — это самый легкий химический элемент, состоящий всего из одного протона и одного электрона. При нормальных условиях (давление 1 атм., температура 0 o C) он присутствует в газообразном состоянии. Его молекула (H2) образована 2 атомами этого химического элемента. Водород является 3-м по распространенности элементом на нашей планете, и 1-м во Вселенной (около 90 % всей материи).
Водородный газ (H2) не имеет запаха, вкуса и цвета. Он не токсичен, однако, когда содержание его в атмосферном воздухе составляет несколько процентов, то человек может испытывать удушье, по причине недостатка кислорода.
Любопытно отметить, что хотя с химической точки зрения все молекула H2 идентичны, физические свойства их несколько отличаются. Дело все в ориентации спинов электронов (они ответственны за появление магнитного момента), которые могут быть параллельными и антипараллельными, такую молекулу называют орто- и параводородом, соответственно.
Видео:Взаимодействие кислорода с водородомСкачать

Химическая реакция горения
Рассматривая вопрос, температуры горения водорода с кислородом, приведем химическую реакцию, которая описывает этот процесс: 2H2 + O2 => 2H2O. То есть в реакции участвуют 3 молекулы (две водорода и одна кислорода), а продуктом являются две молекулы воды. Эта реакция описывает горение с химической точки зрения, и по ней можно судить, что после ее прохождения остается только чистая вода, которая не загрязняет окружающую среду, как это происходит при сгорании органического топлива (бензина, спирта).
С другой стороны, эта реакция является экзотермической, то есть помимо воды она выделяет некоторое количества тепла, которое можно использовать для приведения в движение машин и ракет, а также для его перевода в другие источники энергии, например, в электричество.
Видео:Горение водородаСкачать

Механизм процесса горения водорода
Описанная в предыдущем пункте химическая реакция известна любому школьнику старших классов, однако она является очень грубым описанием того процесса, который происходит в действительности. Отметим, что до середины прошлого века человечество не знало, как происходит горение водорода в воздухе, а в 1956 году за ее изучение была присуждена Нобелевская премия по химии.
В действительности, если столкнуть молекулы O2 и H2, то никакой реакции не произойдет. Обе молекулы являются достаточно устойчивыми. Чтобы горение происходило, и образовывалась вода, необходимо существование свободных радикалов. В частности, атомов H, O и групп OH. Ниже приводится последовательность реакций, которые происходят в действительности при горении водорода:
Что видно из этих реакций? При горении водорода образуется вода, да, верно, но происходит это только, когда группа из двух атомов OH встречается с молекулой H2. Кроме того, все реакции происходят с образованием свободных радикалов, это означает, что запускается процесс самоподдержания горения.
Таким образом, ключевой момент в запуске этой реакции заключается в образовании радикалов. Они появляются, если поднести к кислород-водородной смеси горящую спичку, либо если нагреть эту смесь выше определенной температуры.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Инициация реакции
Как было отмечено, сделать это можно двумя способами:
- С помощью искры, которая должна предоставить всего 0,02 мДж теплоты. Это очень маленькое значение энергии, для сравнения скажем, что аналогичное значение для бензиновой смеси составляет 0,24 мДж, а для метановой — 0,29 мДж. С уменьшением давления энергия инициации реакции растет. Так, при 2 кПа она составляет уже 0,56 мДж. В любом случае, это очень маленькие значения, поэтому водород-кислородная смесь считается легко воспламеняющейся.
- С помощью температуры. То есть кислород-водородную смесь можно просто нагревать, и выше некоторой температуры она сама воспламенится. Когда это произойдет, зависит от давления и процентного соотношения газов. В широком интервале концентраций при атмосферном давлении реакция самовозгорания происходит при температурах выше 773-850 К, то есть выше 500-577 o C. Это достаточно высокие значения по сравнению с бензиновой смесью, которая начинает самовоспламеняться уже при температурах ниже 300 o C.
Видео:Горение водорода (2H2+O2=2H2O) под увеличением в 100,000,000 разСкачать

Процентное содержание газов в горючей смеси
Говоря о температуре горения водорода в воздухе, следует отметить, что не всякая смесь этих газов будет вступать в рассматриваемый процесс. Экспериментально установлено, что если количество кислорода меньше 6% по объему, либо если количество водорода меньше 4% по объему, то никакой реакции не будет. Тем не менее, пределы существования горючей смеси являются достаточно широкими. Для воздуха процентное содержание водорода может составлять от 4,1 % до 74,8 %. Отметим, что верхнее значение как раз соответствует необходимому минимуму по кислороду.
Если же рассматривается чистая кислород-водородная смесь, то здесь пределы еще шире: 4,1-94 %.
Уменьшение давления газов приводит к сокращению указанных пределов (нижняя граница поднимается, верхняя — опускается).
Также важно понимать, что в процессе горения водорода в воздухе (кислороде), возникающие продукты реакции (вода) приводят к уменьшению концентрации реагентов, что может привести к прекращению химического процесса.
Видео:Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Безопасность горения
Это важная характеристика воспламеняющейся смеси, поскольку она позволяет судить о том, происходит реакция спокойно, и можно ее контролировать, либо процесс имеет взрывной характер. От чего зависит скорость горения? Конечно же, от концентрации реагентов, от давления, а также от количества энергии «затравки».
К большому сожалению, водород в широком интервале концентраций способен к взрывному горению. В литературе приводятся следующие цифры: 18,5-59 % водорода в воздушной смеси. Причем на краях этого предела в результате детонации выделяется наибольшее количество энергии на единицу объема.
Отмеченный характер горения представляет большую проблему для использования этой реакции в качестве контролируемого источника энергии.
Видео:Галилео. Эксперимент. Взрыв водородаСкачать

Температура реакции горения
Теперь мы подошли непосредственно к ответу на вопрос, какая низшая температура сгорания водорода. Она составляет 2321 К или 2048 o C для смеси с 19,6 % H2. То есть температура горения водорода в воздухе выше 2000 o C (для других концентраций она может достигать 2500 o C), и в сравнении с бензиновой смесью — это огромная цифра (для бензина около 800 o C). Если сжигать водород в чистом кислороде, то температура пламени будет еще выше (до 2800 o C).
Столь высокая температура пламени представляет еще одну проблему в использовании этой реакции в качестве источника энергии, поскольку не существует в настоящее время сплавов, которые могли бы работать длительное время в таких экстремальных условиях.
Конечно, эта проблема решается, если использовать хорошо продуманную систему охлаждения камеры, где происходит горение водорода.
Видео:Опыты по химии. Горение серы в кислородеСкачать

Количество выделяемой теплоты
В рамках вопроса температуры горения водорода любопытно также привести данные о количестве энергии, которая выделяется во время этой реакции. Для разных условий и составов горючей смеси получили значения от 119 МДж/кг до 141 МДж/кг. Чтобы понять, насколько это много, отметим, что аналогичное значение для бензиновой смеси составляет около 40 МДж/кг.
Энергетический выход водородной смеси намного выше, чем для бензина, что является огромным плюсом для ее применения в качестве топлива для двигателей внутреннего сгорания. Однако, и здесь не все так просто. Все дело в плотности водорода, она слишком низка при атмосферном давлении. Так, 1 м 3 этого газа весит всего 90 грамм. Если сжечь этот 1 м 3 H2, то выделится около 10-11 МДж теплоты, что уже в 4 раза меньше, чем при сжигании 1 кг бензина (чуть больше 1 литра).
Приведенные цифры говорят о том, что для использования реакции горения водорода необходимо научиться хранить этот газ в баллонах с высоким давлением, что создает уже дополнительные сложности, как в технологическом вопросе, так и с точки зрения безопасности.
Видео:Решаем жгучий ПРОБНИК ЕГЭ ПО ХИМИИ 2024Скачать

Применение водородной горючей смеси в технике: проблемы
Сразу необходимо сказать, что в настоящее время водородная горючая смесь уже используется в некоторых сферах человеческой деятельности. Например, в качестве дополнительного топлива для космических ракет, в качестве источников для выработки электрической энергии, а также в экспериментальных моделях современных автомобилей. Однако масштабы этого применения являются мизерными, по сравнению с таковыми для органического топлива и, как правило, носят экспериментальных характер. Причиной этому являются не только трудности в контроле самой реакции горения, но также в хранении, транспортировке и добыче H2.
Водород на Земле практически не существует в чистом виде, поэтому его необходимо получать из различных соединений. Например, из воды. Это достаточно популярный способ в настоящее время, который осуществляется с помощью пропускания электрического тока через H2O. Вся проблема заключается в том, что при этом расходуется больше энергии, чем потом можно получить путем сжигания H2.
Еще одна важная проблема — транспортировка и хранение водорода. Дело в том, что этот газ, ввиду маленьких размеров его молекул, способен «вылетать» из любых контейнеров. Кроме того, попадая в металлическую решетку сплавов, он вызывает их охрупчивание. Поэтому наиболее эффективным способом хранения H2 является использование атомов углерода, способных прочно связывать «неуловимый» газ.
Таким образом, применение водорода в качестве топлива в более-менее широких масштабах возможно, только если его использовать в качестве «сохранения» электричества (например, переводить ветровую и солнечную энергию в водород с помощью электролиза воды), либо если научиться доставлять H2 из космоса (где его очень много) на Землю.
Видео:Свойства кислорода. 8 класс.Скачать

Please wait.
Видео:Уравнивание реакций горения углеводородовСкачать

We are checking your browser. gomolog.ru
Видео:Опыты по химии. Получение кислорода из перманганата калияСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Водород и кислород. 1 часть. 8 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de8adcfad899702 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Водород - Самый ЛЕГКИЙ Газ во Вселенной!Скачать

Синтез воды Образование воды при горении
Видео:Взаимодействие хлора с водородомСкачать

Синтез воды это
Это химические реакции взаимодействия атомов кислорода с атомами водорода, причем в результате синтеза воды образуется большое количество энергии в виде взрыва.
Образование воды при горении водорода в кислороде (воздухе) послужило доказательством состава воды как сложного вещества, состоящего из двух химических элементов — водорода и кислорода.
Схема установки для синтеза воды из простых веществ изображена на рисунке 2.
Приступая к выполнению опыта в собранной установке, прежде всего убеждаются в чистоте водорода, после чего его поджигают на конце Г-образной трубки 1, подводя ее под воронку 2. Включают водоструйный насос 4, соединенный с предохранительной двугорлой склянкой 5. Через некоторое время в дугообразной трубке 3 собирается немного жидкости. Водоструйный насос останавливают и прекращают ток водорода.
Образовавшийся продукт реакции идентифицируют, внося в приемник небольшое количество безводного сульфата меди. Появление голубого окрашивания (образование медного купороса) свидетельствует о том, что полученная в опыте жидкость — вода.

Для опытов собирают установку согласно рисунку 3. В качестве реактора используют со суд без дна (рис. 3, а) из набора НПХ или универсальную го релку (рис. 3,6).
Горение водорода в кислороде
Водород из прибора для получения газов 1 проверяют начистоту. Заполняют реактор 2 кислородом из газометра 3. Проверяют наполнение реактора 2 кислородом, поднося к его отверстию тлеющую лучинку. Поджигают водород на конце газоотводной трубки, не прекращая подачи кислорода из газометра.

Рис. 3. Установка для сжигания водорода и кислорода друг в друге:
а —горение водорода в кислороде: 1 — прибор для получения газов, 2 — реактор, 3 — газометр; б — универсальная горелка; в — горение кислорода в водороде.
Если пламя кислорода внутри реактора 2 погасло, немедленно закрывают кран аппарата для получения водорода. Повторять опыт можно после остывания колокола-реактора.
Чтобы установить, в каких объемных отношениях водород и кислород взаимодействуют с образованием паров воды, берут для взрыва определенные объемы газов и после реакции устанавливают, какой газ остался неизрасходованным и какой он занимал объем. Опыт проводят в эвдиометре — толстостенной трубке с дном и впаянными электродами. В настоящее время промышленный эвдиометр не может быть использован в школе из-за отсутствия безопасного высоковольтного преобразователя, который сейчас разрабатывается.
В качестве индуктора может быть использован пьезоэлектрический высоковольтный преобразователь . Верхний конец этой трубки плотно закрыт резиновой пробкой через которую продеты две проволоки. Верхние концы их присоединены вилке для подключения к источник тока (в сеть), а нижние концы загнуты. В них продета и укреплена тон чайшая медная проволочка-волосок В нижний конец трубки вставлена ре зиновая пробка 5 с узким отверстием, чтобы уменьшить поток воды в трубку (после взрыва) и таким образом предотвратить возможность выброса верхней пробки. Пробка не должна доходить до дна чаши 6 на 4—5 мм.

Взрыв кислородно-водородной смеси можно осуществить с помощью пьезоэлектрического источника электрического тока, используя насадку для воспламенения газов.
Если для взрыва были взяты одинаковые объемы кислорода и водорода, то после реакции остался один объем кислорода, (это доказывается вспыхиванием тлеющей лучинки). Следовательно, объемы вступающих в реакцию газов — водорода и кислорода—относятся как 2:1. Принимают во внимание, что кислород в 16 раз тяжелее водорода (это видно из сравнения плотности 1,44:0,089=16:1) и что соотношение объемов кислорода и водорода 1:2. Делают вывод, что массовые отношения этих эле ментов в воде 16:2, или 8 : 1 (или 88,9% О и 11,1 % Н).
Рис. 4. Установка для синтеза воды в искровом разряде:
1 — трубка-реактор, 2 —электроды, 3 — трубка с зажимом, 4 — воронка.
Для этого опыта и для разложения метана в искровом разряде можно использовать установку, изображенную на рисунке 4. Реактор 1, разделенный на четыре равные по объему части, заполняют водой через воронку 4 до появления капель воды из трубки при открытом зажиме 3. Затем реактор 1 через верхнюю трубку с зажимом 3 заполнят сначала двумя объемами водорода (из аппарата Киппа), а затем двумя объемами кислорода (из газометра). Электроды присоединяют к источнику тока. Вместо выпрямителя ВС-24М (В-24) можно использовать батарейку КБС. Искра получается при повороте одного из электродов на 180° до замыкания и размыкания цепи. После взрыва наличие оставшегося кислорода доказывают по воспламенению тлеющей лучинки, поднесенной к отверстию трубки 3. Для вытеснения кислорода из реактора воронку поднимают вверх при открытом зажиме.
Меры предосторожности. Перед наполнением реактора водород проверяют на чистоту. Во избежание выплескивания при взрыве воды из воронки ее накрывают листом мокрой фильтровальной бумаги.
Определение содержания кислорода в воздухе
Эксперименты по определению состава воздуха сыграли важную роль в развитии химии как науки, что нашло отражение и в учебной литературе по химии. Разработаны в связи с этим многочисленные учебные опыты по определению состава воздуха. Все они основаны на том, что воздух состоит из двух основных компонентов: один из них легко вступает во многие химические реакции (кислород), тогда как второй компонент смеси (атмосферный азот)—вещество Значительно менее реакционноспособное. Для демонстрации малопригодны исторические опыты с использованием электрических разрядов и поглощением образовавшихся оксидов азота ввиду их сложности и длительности. В учебных опытах используют для связывания кислорода легкоокисляющееся вещество — фосфор.
Сжигание фосфора в закрытом пространстве (стеклянный колпак-колокол, склянка с отрезанным дном) — традиционный школьный опыт,для определения состава воздуха. Техника выполнения этого опыта приведена во многих руководствах по химическому эксперимент, а также в школьных учебниках по химии, Этим способом состав воздуха определяют приблизительно.
Содержание кислорода в воздухе можно определить, если вме сте фосфора использовать медь (рис. 30). Простейший опыт состоит в нагревании порошка меди, помещенного на дно пробирки 1, градуированной на 5 равных частей и плотно закрытой ре зиновой пробкой с газоотводной трубкой, опущенной в стакан с водой. При нагревании кислород, содержащийся в пробирке 1, соединяется с медью. После охлаждения пробирки при открытом кране 2 вода засасывается на 1 /5 часть ее вместимости. Более точные результаты могут быть получены при использовании усовершенствованной установки опыт проводят в двух градуированных цилиндрах 1, 5 объемом по 500 мл каждый. В трубке помещена «колбаска» из свеже-восстановленной медной сетки.
Левый цилиндр 1 заполонен воздухом, правый — подкрашенной водой и погружен вверх дном в чашу с водой. Делительную воронку 2 заполняют водой, а трубку с медной сеткой сильно нагревают. Выде ляющиеся пузырьки газа сразу не следует собирать в цилиндр. После того как выделение газа прекратилось, цилиндр помещают на газоотводную трубку. В левый цилиндр начинают приливать воду с такой скоростью, чтобы на вытес нение 500 мл воздуха потребовалось 10—15 мин. После приливания 500 мл воды кран воронки закрывают. В правом цилиндре 5 собирается только 4 /5 вытесненного объема воздуха.
Пробку с газоотводной трубкой 4 отделяют от реакционной трубки, после чего прекращают нагревание.
Заслуживают внимания опыты по определению состава воздуха с использованием медицинских шприцев. В настоящее время для учебных целей созданы специальные шприцы — стеклянные поршневые дозаторы. С их помощью могут быть выполнены многие количеств венные опыты, в том числе и по определению состава воздуха. Для наглядности их следует использовать при проецировании некоторых опытов на экран с помощью графопроектора .
Статья на тему Синтез воды
🎦 Видео
Опыты по химии. Взрыв кислорода с водородомСкачать

Горение. 7 класс.Скачать

Кислород - Самый НУЖНЫЙ газ на ЗЕМЛЕ!Скачать

Поджигаем спичку марганцовкой и перекисью водорода #shortsСкачать

горение железа в кислородеСкачать