а) концентрацию А увеличить в 2 раза, оставив концентрацию В прежней; б) концентрацию В увеличить в 2 раза, оставив концентрацию А прежней; в) концентрацию обоих веществ увеличить в 2 раза;
При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает
Думаю, что в случае а) и б) скорость возрастет в 2 раза, а в случа в) в 4 раза
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Расчеты изменения скорости реакции
Задача 331.
Реакция между веществами А и В выражается уравнением: А + 2В → С. Начальные концентрации составляют: [А]0 = 0,03 моль/л, [В]0 = 0,05 моль/л. Константа скорости реакции равна 0,4. Найти начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,01 моль/л.
Решение:
До изменения концентрации скорость реакции можно выразить уравнением:
v — скорость реакции, k — константа скорости реакции, [А] и [В] – концентрации исходных веществ.
Для нахождения скорости реакции по истечении некоторого времени учтём, что на образование 1 моля вещества С затрачивается 1 моль вещества А и 2 моля вещества В, поэтому при уменьшении концентрации вещества А на 0,01 моль/л, концентрация вещества В уменьшится соответственно на 0,02 моль/л (2 . 0.01 = 0,02). Тогда оставшиеся концентрации веществ будут равны [A]ост. = 0.03 – 0,01 = 0,02 моль/л, [B]ост. = 0,05 – 0,02 = 0,03моль/л. Тогда скорость реакции по истечении некоторого времени будет составлять:
Ответ: v1 = 3 . 10 -5 ; v2 = 7,2 . 10 -6 .
Задача 332.
Как изменится скорость реакции 2NO (г.) + O2 (г.) → 2NO2 (г.), если: а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 3 раза; в) повысить концентрацию в 3 раза?
Решение:
До изменения объёма, давления и концентрации скорость реакции можно выразить уравнением:
а) Вследствие увеличения давления в системе в 3 раза, соответственно концентрация каждого из реагирующих веществ возрастёт в 3 раза. Следовательно, теперь скорость реакции будет равна:
Тогда, сравнивая выражения v и vа) , находим, что скорость реакции возрастает в 27 раз
б) при уменьшении объёма в 3 раза в системе концентрация каждого из реагирующих веществ возрастёт в 3 раза. Следовательно, теперь скорость реакции будет равна:
Тогда, сравнивая выражения v и vб), находим, что скорость реакции возрастает в 27 раз
в) При увеличении концентрации NO в 3 раза скорость реакции будет равна:
Cравнивая выражения v и vв), находим, что скорость реакции возрастает в 9 раз
Ответ: а) возрастёт в 27 раз; б) возрастёт в 27 раз; в) возрастёт в 9 раз.
Задача 333.
Две реакции протекают при 25 °С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,0, а второй 2,5. Найти отношение скоростей этих реакций при 95°С.
Решение:
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Здесь vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); 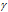
Поскольку 
Скорость второй реакции равна:
Найдём отношение этих скоростей:
Ответ:
Задача 334.
Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
Решение:
Согласно правилу Вант Гоффа зависимость скорости реакции от температуры выражается уравнением:
vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); 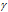

Ответ: 2,5.
Задача 335.
Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
Решение:
Согласно правилу Вант Гоффа зависимость скорости реакции от температуры выражается уравнением:
vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); 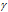

Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

задачи по теме «Скорость химических реакций»
учебно-методический материал по химии (9 класс) по теме
разноуровневые задачи по теме «Скорость химических реакций» могут быть использованы на уроках в 9 и11 классах при изучении или повторении данной темы.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Скачать:
| Вложение | Размер |
|---|---|
| zadachi_po_teme_skorost_khim._reaktsiy.doc | 33.5 КБ |
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Предварительный просмотр:
1. Если внести на железной ложечке уголек в пламя горелки и, когда он раскалиться, вынуть его из пламени и подержать на воздухе, то уголек некоторое время будет тлеть, затем погаснет. А если раскаленный уголек внести в банку с кислородом, то он раскаляется добела и горит вне пламени без дыма, постепенно уменьшаясь в размерах. Дайте теоретическое обоснование этим наблюдениям. Как изменится скорость реакции горения угля, если его перед сжиганием мелко измельчить? Почему?
2. Почему для окисления сахара на воздухе требуется высокая тем-пература, а в организме человека эта реакция протекает при 36,6˚С?
3. Как изменится скорость химической реакции при повышении тем-пературы от 45˚ до 80˚ С, если температурный коэффициент равен 2?
4.Концентрация одного из веществ через 20 с после начала реакции равна 0,1моль/л, а через 30 с – в 2 раза выше. Рассчитайте среднюю скорость.
5. Химической реакции в растворе отвечает уравнение 3А + В = 2С. Как изменится её скорость, если:
а) концентрацию А увеличить в 2 раза, оставив концентрацию В прежней;
б) концентрацию В понизить в 2 раза, оставив концентрацию А прежней;
в) концентрацию обоих веществ удвоить;
г) увеличить в 2 раза давление на реагирующую смесь, предполагая,
что А – жидкость, а В – газообразное вещество?
6. Химическая реакция протекает в растворе согласно уравнению А + 2В = С. Исходные концентрации веществ: А – 0,8 моль/л,
В – 1 моль/л. Спустя 20 минут концентрация А снизилась до 0,78 моль/л. Какова стала концентрация В? С какой средней скоростью протекала реакция за этот промежуток времени, если о скорости её судить по изменению а) концентрации А? б) концентрации В?
1. Если смешать порошкообразные железо и серу, то признаков реакции нет. Чтобы реакция началась, смесь можно нагреть, а можно добавить к ней воду и размешать смесь до тестообразного состояния. Через несколько минут смесь раскаляется, и процесс внешне протекает также как и при нагревании. Дайте теоретическое обоснование этим наблюдениям. Как изменится скорость реакции, если взять не порошки, а небольшие, размером с горошину, кусочки? Почему?
2. Превращение SO 2 в SO 3 можно ускорить, если 1)добавить озон O 3 к смеси SO 2 и O 2 ; 2) пропускать эту смесь над нагретым V 2 O 5. В чем принципиальное отличие влияния V 2 O 5 и O 3 на скорость окисления SO 2 ?
3. Как изменится скорость химической реакции при понижении температуры от 45˚ до 20˚ С, если температурный коэффициент равен 4?
4. Концентрация одного из веществ через 13 с после начала реакции равна 0,05моль/л, а через 25 с – на 0, 048 моль/л меньше. Рассчитайте среднюю скорость.
5. Химической реакции, протекающей между газами, отвечает уравнение А + 2В = 2С. Как изменится её скорость, если:
а) концентрацию А увеличить в 3 раза, оставив концентрацию В прежней;
б) концентрацию В увеличить в 3 раза, оставив концентрацию А прежней; в) концентрацию обоих веществ утроить;
г) уменьшить давление на реагирующую смесь в 2 раза?
6. В склянке емкостью 2 л смешали 4,5 моль газа А и 3 моль газа В. Газы А и В реагируют соответственно уравнению А + В = 2С. Через 2 с в реакционной системе образовался газ С количеством 1 моль. Определите среднюю скорость реакции. Рассчитайте количества веществ газов А и В, которые не прореагировали.
🔍 Видео
Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Проклятая химическая реакция 😜 #shortsСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

75. Ионные реакции в растворах электролитовСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Скорость химических реакций. 9 класс.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Реакции ионного обмена. 9 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать




















