Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Реакция взаимодействия марганца и кислорода
Уравнение реакции взаимодействия марганца и кислорода:
Реакция взаимодействия марганца и кислорода.
В результате реакции образуется оксид марганца (IV).
Реакция протекает при условии: при нагревании до температуры не более 450 °C.
Формула поиска по сайту: Mn + O2 → MnO2.
Реакция взаимодействия нитрата скандия и гидроксида рубидия
Реакция взаимодействия гидроксида калия и оксида алюминия
Реакция взаимодействия оксида лития и алюминия
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Видео:Опыты по химии. Получение кислорода из перманганата калияСкачать

Марганец, цинк и серебро
Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.
Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 — амфотерные, +6, +7 — кислотные.
Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит
Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + C = (t) Mn + CO
- Реакции с неметаллами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
При нагревании марганец вытесняет водород из воды.
Реакции с кислотами
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.
Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная)
Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
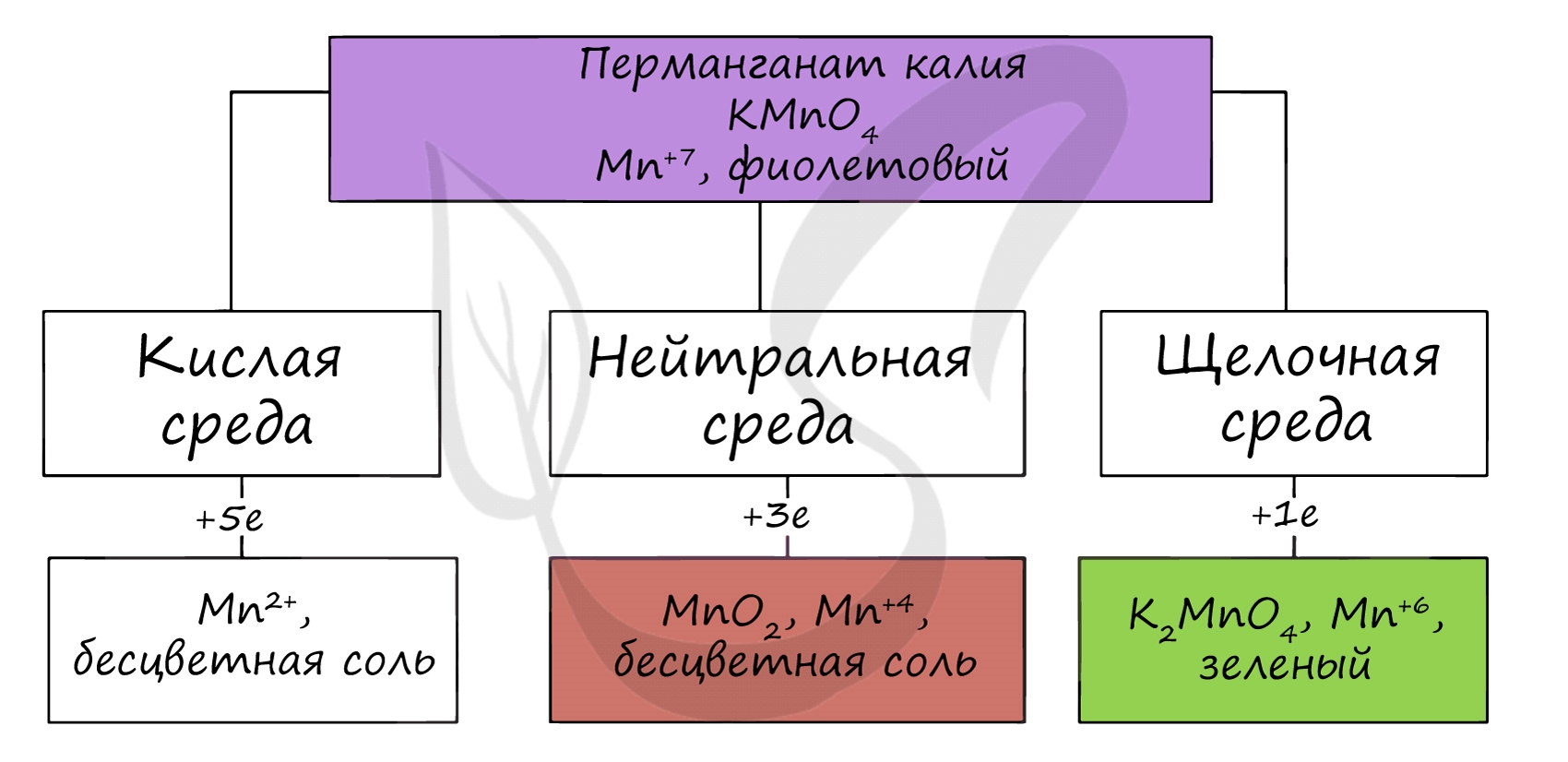
Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют кислотные свойства. Соли марганцовой кислоты — перманганаты.
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
При стоянии в растворе постепенно разлагается водой.
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn 2+ , в щелочной — Mn 6+ .
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав меди с цинком — латунь.
Для цинка характерна постоянная степень окисления +2.
Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
- Реакции с неметаллами (и аммиаком 🙂
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Реакции с кислотами
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.
- Реакции с неметаллами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Реакции с кислотами
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
С органическими веществами
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Марганец, цинк и серебро
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Марганец
Марганец на воздухе покрывается защитной оксидной пленкой, но в виде порошка при нагревании реагирует с галогенами, серой, фосфором, кремнием, углеродом, бором и азотом:
Mn + Cl 2 → MnCl 2
2 Mn + Si → Mn 2 Si
С кислородом при нагревании, в зависимости от температуры образуются различные оксиды марганца, самый устойчивый из них MnO2:
Mn + 2 HCl → MnCl 2 + H 2 ↑
С растворами щелочей практически не взаимодействует. Но со щелочными расплавами окислителей марганец и его соединения образуют манганаты:
Mn + KClO 3 + 2 KOH → K 2 MnO 4 + KCl + H 2 O
Если вести окисление соединений марганца в кислой среде – образуется перманганат ион:
2MnO 2 + 3PbO 2 + 6HNO 3 → 2H MnO 4 + 3Pb(NO 3) 2 + 2H 2O
Марганец металл средней активности, при этом он является d-элементом, поэтому для него, как и для других d-элементов характерно наличие нескольких степеней окисления, в которых его соединения проявляют различные свойства:
Степень окисления марганца +2 – основные свойства:
MnO + 2 HCl → MnCl 2 + H 2 O
В степени окисления +4 мы считаем соединения марганца амфотерными (и кислотные и основные свойства выражены слабо). Этой степени окисления соответствуют оксид MnO2 и не устойчивый гидроксид Mn(OH)4. MnO 2 с кислотами образует соли марганца ( II ), т.к. соли марганца ( IV ) так же не устойчивы:
MnO 2 + 4 HCl (конц.) → MnCl 2 + Cl 2 ↑ + 2 H 2 O
Со щелочами и оксидами активных металлов образует устойчивые манганаты (IV):
MnO 2 + 2 KOH → K 2 MnO 3 + H 2 O
MnO 2 + K 2 O → K 2 MnO 3
В ЕГЭ обычно не встречаются две последние реакции, но могут быть вопросы на возможность протекания реакции амфотерного оксида MnO 2 со щелочами и оксидами активных металлов. Т.е. нужно просто запомнить, что Mn+4 – амфотерен, а значит, как и другие амфотерные соединения, реагирует и с кислотами, и со щелочами, и с оксидами очень активных металлов при сплавлении.
В степенях окисления +6 и +7 марганец проявляет кислотные свойства, образуя сильную марганцовую кислоту HMnO4 и соли – манганаты K 2 MnO 4 и перманганаты KMnO 4 .
По большей части вопросы про марганец в ЕГЭ связаны с окислительно-восстановительными реакциями, поэтому самое важное запомнить продукты, которые у нас образуются при различных средах протекания реакции:
Перманганат калия в кислой среде всегда переходит в ион Mn +2 , в водной (и слабощелочной) среде наш продукт всегда MnO2, т.к. Mn(OH)4 и соли марганца (IV) не устойчивые соединения, а в сильнощелочных средах записываем соли марганца в степени окисления +6 – манганаты:
2KMnO 4 + 5Na 2SO 3 + 3H 2SO 4 → 2MnSO 4 + 5Na 2SO 4 + 3H 2O + K 2SO 4
2KMnO 4 + 3Na 2SO 3 + H 2O→ 2MnO 2 ↓ + 3Na 2SO 4 + 2KOH
2KMnO 4 + Na 2SO 3 + 2KOH→ 2K 2MnO 4 + Na 2SO 4 + H 2O
! Манганат калия K 2 MnO 4 устойчив только в сильнощелочных средах поэтому например, при окислении ацетилена перманганатом в слабощелочной среде мы указываем в продуктах не манганат, а оксид марганца MnO 2:
При нагревании перманганат разлагается:
2 KMnO 4 → K 2 MnO 4 + MnO 2 ↓ + O 2
Эту реакцию используют для получения кислорода в лаборатории.
Манганат калия выступает окислителем, в водной среде так же образуя MnO 2 , а в кислой соли марганца ( II ):
K 2MnO 4 + 2Na 2SO 3 + 2H 2SO 4 → MnSO 4 + 2Na 2SO 4 + 2H 2O + K 2SO 4
K 2MnO 4 + Na 2SO 3 + H 2O→ MnO 2 ↓ + Na 2SO 4 + 2KOH
Если как исходное вещество в ОВР вам предлагают MnO2, то в зависимости от среды реакции он может выступать как окислитель в кислой среде :
MnO 2 + Na 2SO 3 + H 2SO 4 → MnSO 4 + Na 2SO 4 + H 2O
И как восстановитель при реакции с сильными окислителями в щелочной среде :
3 MnO 2 + KClO 3 + 6 KOH → 3 K 2 MnO 4 + KCl + 3 H 2 O
Mn +2 может выступать восстановителем в реакциях с окислителями в водной и щелочной средах:
3MnSO 4 + 2KMnO 4 + 2H 2O → 5 MnO 2 ↓ + K 2SO 4 + 2H 2SO 4
📹 Видео
Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Опыты по химии. Каталитическое разложение пероксида водородаСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Диоксид Марганца - ПОЛУЧЕНИЕСкачать

Физические и химические свойства кислорода Применение кислородаСкачать

ВСЕ РЕАКЦИИ С АЗОТОМ И ЕГО СОЕДИНЕНИЯМИ | ЕГЭ ХИМИЯ 2024| НООСкачать

Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Химические св-ва соединений марганца Mn (+7) (KMnO4). Решаем окислительно-восстановительные р-ции.Скачать

Химические уравнения. Урок 15. Химия 7 классСкачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Кислород. Физические свойства. Получение. Урок 17. Химия 7 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Электролиз сульфата МАРГАНЦАСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Химические свойства марганца. Часть 1.Скачать