Среди элементов IIIa группы один лишь бор относится к неметаллам. Представляет собой аморфное кристаллическое вещество красного или темного цвета, может быть бесцветным.
Общая характеристика элементов IIIa группы
От B к Tl (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Оксид бора проявляется кислотные свойства, алюминий и галлий — типичные амфотерные элементы, у соединений индий и таллия преобладают основные свойства.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 1 :
- B — 2s 2 2p 1
- Al — 3s 2 3p 1
- Ga — 4s 2 4p 1
- In — 5s 2 5p 1
- Tl — 6s 2 6p 1
Природные соединения
Получение
Бор получают путем пиролиза бороводородов, методом металлотермии (вытеснением активным металлом) и термическим разложением бромида бора в присутствии катализатора
BBr3 + H2 → (вольфрам, t = 1000-1200 С°) B + HBr
Химические свойства
- Реакции с фтором
Необходимо заметить, что бор довольно инертный неметалл. При комнатной температуре без нагревания он реагирует только со фтором:
Реакции с неметаллами
При нагревании бор реагирует с другими галогенами, азотом, фосфором, углеродом и кислородом.
При сильном нагревании бор способен восстановить кремний из его оксида:
Ионы бора окрашивают пламя в оттенки зеленого цвета.
Оксид и гидроксид бора
Оксид и гидроксид бора (борная кислота) проявляют кислотные свойства.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Кислородные соединения бора
Оксид бора
Он может быть получен взаимодействием бора и кислорода или при нагревании борной кислоты:
4 В + 302= 2В203,
2 Н3ВО3 = В2О3 + 3Н2О
Свойства
В2О3 — это кислотный оксид, который медленно растворяясь в воде, дает борную кислоту:
В2О3 + 3 Н2О = 2Н3ВО3
В2О3 реагирует с основными оксидами, основаниями и солями.
Бинарные соединения бора ( III) кислотные. Об этом, в частности, свидетельствует характер их сольволиза ( гидролиза) и взаимодействия с основными соединениями.
Многиебинарные соединения бора похожи по свойствам на аналогичные соединения кремния.
Длябинарного соединения бора с азотом — нитрида бора — известны в основном две модификации. Одна из них может быть получена синтезом из элементов. Однако синтез осуществляется трудно, требуется температура выше 1200 С.
Избинарных соединений бора ( III) галогениды ВНа13 ( BF3 — газ, ВС13 и ВВг3 — жидкости, В13 — легкоплавкое, 43 С, твердое вещество) мо-номолекулярны, а оксид В2О3, сульфид B2S3, нитрид BN — полимерны и тугоплавки.
По химической природебинарные соединения бора ( III) кислотные.
4. Оксид бора В2О3 – бесцветное стеклообразное или кристаллическое вещество. Стеклообразная модификация имеет слоистую структуру, атомы бора расположены внутри равносторонних треугольников ВО3, температура плавления 325–450 °С, обладает высокой твердостью. Кристаллический оксид бора существует в виде двух модификаций: гексагональной и моноклинной. Температура плавления 450 °С, температура кипения 2250 °С.
Гидроксид бора B(OH)3
Внесите в термостойкий химический стакан емкостью 250 мл 16,00 г декагидрата тетрабората натрия и 25 мл воды, растворите кристаллы в воде при нагревании. К горячему раствору реагента осторожно (по палочке) прилейте 15 мл разбавленной (1:1 по объему) серной кислоты. Полученную смесь нагревайте при температуре кипения в течение 5 минут, а затем охладите в бане с холодной водой. Наблюдайте кристаллизацию продукта.
Кристаллы отделите от раствора вакуумным фильтрованием и промойте на фильтре водой, охлажденной до 0 °С. Продукт перекристаллизуйте, используя для растворения минимальным объем воды. Очищенный продукт высушите на воздухе.
Идентификация:
- продукт (тв) — бесцветные кристаллы, (т.пл. 170 °С, с разложением);
- продукт (тв) + вода + Инд (универсальный) = рН (слабокислотная среда);
- кач.р-ция на бор — см. 6.3.
5. Борная кислота — H3BO3 — (ортоборная) — бесцв. кристаллы, очень слабая одноосновная к-та, за счет равновесия в растворе: H3BO3 + H2O H + + [B(OH)4] —
При реакции со щелочами образует соли полиборных кислот (обычно тетрабораты), или метаборной:
4H3BO3 + 2NaOH = Na2B4O7 + 7Н2О; H3BO3 + NaOH = NaBO2 + 2Н2О.
При нагревании теряет воду превращаясь в метаборную (HBO2), затем в тетраборную (H2B4O7) кислоты, и, в итоге, в оксид бора.
Реагирует со спиртами в присутствии концентрированной серной кислоты, образуя легколетучие эфиры:
H3BO3 + 3 С2H5OH = B(OС2H5)3 + 3Н2О
При поджигании эти эфиры горят зеленым пламенем, что является качественной реакцией на соли борной кислоты.
6. Галоидные соединения бора общей формулы ВГ3 могут быть получены путем взаимодействия элементов при нагревании. Они представляют собой бесцветные вещества. При обычных условиях BF3 газообразен, ВСl3 кипит при + 18°С, ВВr3 – жидкость и BJ3 –твердое тело. В водном растворе все они подвергаются гидролизу по схеме:
Бура (от араб. бурак — селитра), тетраборат натрия, Na2B4O7 — 10H2O, кристаллогидрат натриевой соли тетраборной кислоты. В природе встречается в виде минерала — бура (или тинкал) белого, реже серого и жёлтого цвета; плотность 1690—1720 кг/м 3 (см. Бораты природные). Б. растворима в воде (1,6 г безводной соли в 100 г H2O при 10°С). Водные растворы Б. имеют щелочную реакцию и поглощают СО2 из воздуха. Сильными кислотами Б. разлагается. Применяется при паянии, так как расплавленная Б. растворяет окислы металлов и тем самым очищает спаиваемые металлические поверхности. Употребляется для приготовления специальных сортов стекла (главным образом оптического), эмалей, глазурей, для дубления кож, дляборирования; в сельском хозяйстве — как микроудобрение.
Б. — лекарственный препарат, обладающий антисептическим действием. Применяют в виде 3—5%-ного раствора для промываний и смазываний полости рта, носа и носоглотки при различных инфекционных заболеваниях (трахеит, насморк, стоматит и др.). Внутрь Б. назначают при лечении эпилепсии (особенно у детей).
7. Внешний вид:
водный раствор Брутто-формула (система Хилла): HBF4 Способы получения: 1. Растворением трифторида бора в воде.
Дополнительная информация:
При попытке выделения из раствора разлагается на трифторид бора и фтороводород. Сильная кислота. Соли — тетрафторбораты — устойчивы. Не может быть получена растворением трифторида бора во фтороводороде (не взаимодействуют без акцептора протона). Расстояние B-F = 0,143 нм (1,43 ангстрема). Константа гидролиза = 0,0023 (при 25 С). Не действует на стекло.
Алюминий, получение и применение. 2.Алюмотермия. 3.Сплавы на основе алюминия. 4.Химические свойства. 5.Оксид и гидроксид алюминия, их амфотерность. 6.Алюминаты, квасцы, комплексные соединения алюминия.
1. Алюми́ний — элемент главной подгруппы третьей группы третьего периода периодической системы химических элементов, с атомным номером 13. Обозначается символом Al (лат. Aluminium). Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий (CAS-номер: 7429-90-5) — лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
История
Впервые алюминий был получен Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути.
Получение
Современный метод получения был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых электродов. Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке.
Для производства 1 т алюминия чернового требуется 1,920 т глинозёма, 0,065 т криолита, 0,035 т фторида алюминия, 0,600 т анодной массы и 17 тыс. кВт·ч электроэнергии постоянного тока.
2. Алюмотермией называют метод восстановления металлов из оксидов порошком металлического алюминия. Так можно получить корольки (маленькие слитки) многих переходных металлов, например хрома, марганца, ванадия, железа:
2Al+Fe2O3=Al2O3+Fe. Если поджечь с помощью магниевой ленты смесь, состоящую из алюминия и оксида железа, а после этого остывший тигель разбить молотком, из образовавшейся массы (пека) нетрудно извлечь королёк металла.
3.В качестве конструкционного материала обычно используют не чистый алюминий, а разные сплавы на его основе.
Алюминиево-магниевые Al-Mg. Характеризуются сочетанием удовлетворительной прочности, хорошей пластичности, очень хорошей свариваемости и коррозионной стойкости. Кроме того, эти сплавы отличаются высокой вибростойкостью. Наиболее широкое распространение в промышленности получили сплавы с содержанием магния от 1 до 5 %. Рост содержания Mg в сплаве существенно увеличивает его прочность. Каждый процент магния повышает предел прочности сплава на 30 МПа, а предел текучести — на 20 МПа. Сплавы с содержанием магния до 3 % (по массе) структурно стабильны при комнатной и повышенной температуре даже в значительно нагартованном состоянии. Увеличение содержания магния свыше 6 % приводит к ухудшению коррозионной стойкости сплава. Для улучшения прочностных характеристик сплавы системы Al-Mg легируют хромом, марганцем, титаном, кремнием или ванадием. Попадания в сплавы этой системы меди и железа стараются избегать, поскольку они снижают их коррозионную стойкость и свариваемость.
Алюминиево-марганцевые Al-Mn. Сплавы этой системы обладают хорошей прочностью, пластичностью и технологичностью, высокой коррозионной стойкостью и хорошей свариваемостью.
Основными примесями в сплавах системы Al-Mn являются железо и кремний. Оба этих элемента уменьшают растворимость марганца в алюминии. Для получения мелкозернистой структуры сплавы этой системы легируют титаном. Присутствие достаточного количества марганца обеспечивает стабильность структуры нагартованного металла при комнатной и повышенной температурах.
Алюминиево-медные Al-Cu (Al-Cu-Mg). Механические свойства сплавов этой системы в термоупрочненном состоянии достигают, а иногда и превышают, механические свойства низкоуглеродистых сталей. Эти сплавы высокотехнологичны. Однако у них есть и существенный недостаток — низкое сопротивление коррозии, что приводит к необходимости использовать защитные покрытия.
В качестве легирующих добавок могут встречаться марганец, кремний, железо и магний. Причем наиболее сильное влияние на свойства сплава оказывает последний: легирование магнием заметно повышает предел прочности и текучести. Добавка кремния в сплав повышает его способность к искусственному старению. Легирование железом и никелем повышает жаропрочность сплавов второй серии. Нагартовка этих сплавов после закалки ускоряет искусственное старение, а также повышает прочность и сопротивление коррозии под напряжением.
Сплавы системы Al-Zn-Mg (Al-Zn-Mg-Cu). Сплавы этой системы ценятся за очень высокую прочность и хорошую технологичность. Представитель системы — сплав 7075 является самым прочным из всех алюминиевых сплавов. Эффект столь высокого упрочнения достигается благодаря высокой растворимости цинка (70 %) и магния (17,4 %) при повышенных температурах, резко уменьшающейся при охлаждении.
Однако существенным недостатком этих сплавов является крайне низкая коррозионная стойкость под напряжением. Повысить сопротивление коррозии сплавов под напряжением можно легированием медью. Нельзя не отметить открытой в 60-е годы закономерности: присутствие лития в сплавах замедляет естественное и ускоряет искусственное старение. Помимо этого, присутствие лития уменьшает удельный вес сплава и существенно повышает его модуль упругости. В результате этого открытия были разработаны новые системы сплавов Al-Mg-Li, Al-Cu-Li и Al-Mg-Cu-Li.
Алюминиево-кремниевые сплавы (силумины) лучше всего подходят для литья. Из них часто отливают корпуса разных механизмов.
Комплексные сплавы на основе алюминия: авиаль. Алюминий переходит в сверхпроводящее состояние при температуре 1,2 кельвина.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Бор (B)
Первыми бор получили французы Гей-Люссак и Тенар в 1808 году.
В природе элементарный бор не встречается. Почит во всех минералах бор связан с кислородом, он встречается в небольших концентрациях во многих природных соединениях, в виде боратов и боросиликатов, в изверженных и осадочных породах, в водах морей, соляных озер, горячих гейзеров, грязевых вулканов.
Электронная конфигурация бора — 1s 2 2s 2 2p 1 (см. Электронная структура атомов).
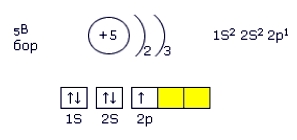
Рис. Электронная конфигурация атома бора.
На внешнем электронном слое бора находятся три электрона, которые он может либо отдавать, либо принимать еще 3, проявляя кислотность +3 или -3.
Видео:Водород и кислород. 1 часть. 8 класс.Скачать

Бор, как простое вещество
Бор является инертным (при н. у.) неметаллом, образует ряд аллотропных модификаций, отличающихся строением кристаллической решетки — это самое твердное (после алмаза) природное вещество, обладающее малой электропроводностью. Свойства бора во многом зависят от его модификации и чистоты.
Химические свойства бора:
- при комнатной температуре бор вступает в реакцию только со фтором;
- при t=500-700°C реагирует с кислородом, серой, хлором: 4B + 3O2 = 2B2O3;
- при t=1200°C реагинует с кремнием (силицид бора) и азотом (нитрид бора): 3B + Si = B3Si;
- при t=2000°C реагинует с углеродом: 3C + 12B = B12C3;
- в сплавах с металлами бор образует бориды различного состава (в зависимости от условий сплавления и концентрации бора): Ni + 2B = NiB2; 2Ni + B = Ni2B;
- с парами воды бор вступает в реакцию при температуре красного каления: 6H2O + 2B = 2H3BO3 + 3H2.
- взаимодействует с горячими концентрированными азотной и серной кислотой, а также царской водкой: 3HNO3 + B = 3NO2 + H3BO3.
- с кислотами неокислителями бор не реагирует.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Соединения бора
Борная кислота (H3BO3) — это слабая одноосновная кислота, представляет собой растворимое в воде бесцветное кристаллическое вещество.
Борную кислоту получают из минерала сассолина.
Кислотные свойства борной кислоты обусловлены образованием протона при ее взаимодействии с водой:
При нагревании борная кислота, теряя воду, превращается в метаборную кислоту:
Борная кислота применяется как дезинфицирующее и антисептическое средство, для изготовления эмалей, специальных стекол, цементов, косметики, средств гигиены.
Борный ангидрид (B2O3) — диэлектрическое бесцветное кристаллическое вещество, легко переходящее в стеклообразное состояние.
Энергично вступает в реакцию с водой, образуя борную кислоту: B2O3 + 3H2O = 2H3BO3.
Получение борного ангидрида:
Борный ангидрид нашел применение в производстве специальных стекол и для получения бора.
Получение бора:
- металлотермией получают аморфный «грязый» бор (магний и натрий выступают в роли восстановителей): B2O3 + 3Mg = 2B + 3MgO;
- кристаллический бор высокой частоты получают при температуре 800°C восстановлением галогенидов бора водородом: 2BBr3 + 3H2 = 6HBr + 2B;
- промышленным способом бор получают электролизом расплава K[BF4] и B2O3 (t=800-1000°C).
Применение бора:
- в изготовлении полупроводников (бор — полупроводник p-типа с дырочной проводимостью);
- для изготовления огнеупорных, кислотостойких материалов (силициды устойчивы к действию воды, щелочей, кислот, высокой температуры);
- в качестве металлургических добавок при изготовлении жаропрочной, механически и коррозионноустойчивой стали;
- для изготовления деталей реактивных двигателей, газовых турбин, работающих в тяжелых условиях высоких температур;
- в ядерной энергетике для изготовления замедлителей быстрых нейтронов и для биологической защиты.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
📽️ Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Кислород. 8 класс.Скачать

Химические свойства кислорода. Урок 18. Химия 7 класс.Скачать

Эффект Бора и эффект ХолдейнаСкачать

Строение атома. Как составить электронную и электронно-графическую формулы?Скачать

Проклятая химическая реакция 😜 #shortsСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Свойства кислорода. 8 класс.Скачать

8 класс. Распределение электронов в атоме. Электронные формулы.Скачать

Уравнивание реакций горения углеводородовСкачать

Квантовые числа. 1 часть. 10 класс.Скачать

Химические уравнения. Урок 15. Химия 7 классСкачать

Химические уравнения. Как составлять химические уравнения.Скачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать







