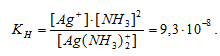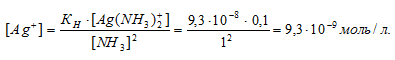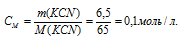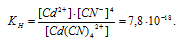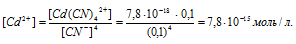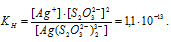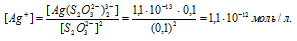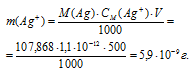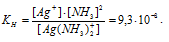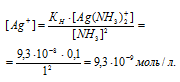Материалы портала onx.distant.ru
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
- Состав комплексных соединений
- Номенклатура комплексных соединений
- Реакции образования комплексных соединений
- Реакции разрушения комплексных соединений
- Диссоциация комплексных соединений
- Задачи для самостоятельного решения
- Получение и химические свойства комплексных соединений
- Получение комплексных соединений
- Химические свойства комплексных соединений
- Уравнения химических реакций комплексных соединений в молекулярной и ионно-молекулярной форме
- 📺 Видео
Видео:Комплексные соединения. 1 часть. 11 класс.Скачать

Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Видео:Свойства комплексных соединений. 11 класс.Скачать

Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами . Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F — — фторо, Cl — -хлоро, ОН — — гидроксо, CN — — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование комплексных солей.
Если комплексообразователем является Fe 2+ или Fe 3+ , то координационные числа в обоих случаях равны шести:
Координационные числа ртути и меди, как правило, равны четырем:
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
Видео:Комплексные соединения. Определяем заряд комплексного иона и валентность комплексообразователя.Скачать

Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
- образования малорастворимого соединения с комплексообразователем:
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
Видео:Комплексные соли | ЕГЭ по химии | Екатерина СтрогановаСкачать

Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например , в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
Для комплексного иона [Ni(NH3)6] 2+ , диссоциирующего по уравнению
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni 2+ ]·[NH3] 6 / [[Ni(NH3)6] 2+ ] (1)
Величина, обратная Кн, называется константой устойчивости:
Она представляет собой константу равновесия процесса образования комплексного иона:
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGT о = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3 — в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag + в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2] + = 5,7× 10 — 8 при 298 К.
3) Величину ΔG o 298 процесса диссоциации комплексного иона.
[NO3 — ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag + и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2] + составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
Следовательно, [Ag + ] = 1,43× 10 — 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2] + уравнением:
Значит, при Т = 298 К получаем:
ΔG о 298 = — 8,314× 298× ln5,7× 10 — 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10 — 10 , Кн.[Ag(NH3)2] + = 5,7× 10 — 8 .
Решение. Осадок выпадет при условии: [Ag + ][Сl — ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag + и Сl — в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10 -3 , 1 и 0,25 М соответственно.
Найдем концентрацию [Ag + ] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10 — 10 .
Значит, [Ag + ] = 2,85× 10 — 10 моль/л, а [Сl — ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag + ][Сl — ] = 2,85× 10 — 10 × 0,25 = 7,1× 10 — 11 (моль/л) 2 .
Поскольку [Ag + ][Сl — ] = 7,1× 10 — 11 — 10 , то осадок не выпадет.
Задача 3. При какой концентрации ионов S 2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10 — 27 , Кн[Cd(CN)4] 2- = 7,8× 10 — 18 .
Решение. Осадок выпадет при условии: [Cd 2+ ][S 2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd 2+ и S 2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S 2- ] > ПР(CdS):[Cd 2+ ].
Комплексный ион диссоциирует незначительно:
[Cd(CN)4] 2- → Cd 2+ + 4CN —
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd 2+ и 4x моль/л ионов CN — . Суммарная концентрация ионов CN — равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4] 2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4] 2- = [Cd 2+ ] · [CN — ] 4 / [[Cd(CN)4] 2- ]
Следовательно, [Cd 2+ ] = 1,8·10 — 12 моль/л.
Выпадение осадка начнется при [S 2- ] > 7,9·10 — 27 : 1,8·10 — 12 > 4,39·10 — 15 моль/л.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия;
2. Назовите следующие комплексные соединения
[Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II).
3. Составьте уравнение химической реакции:
4. Составьте уравнение химической реакции:
5 . Составьте уравнение химической реакции:
6. Составьте уравнение химической реакции:
7. Составьте уравнение химической реакции:
Видео:Комплексные соединенияСкачать

Получение и химические свойства комплексных соединений
Видео:Комплексные соединенияСкачать
Получение комплексных соединений
Комплексные соединения можно получить различными способами:
1. В результате реакций соединения:
2. По реакции замещения лиганда во внутренней сфере:
Некоторые комплексы способны к быстрому замещению лигандов. Такие комплексы называются лабильными. У других же этот процесс происходит очень медленно – это инертные комплексы.
3. С помощью окислительно-восстановительных реакций:
4. С помощью реакций, использующих реакции трансвлияния лигандов:
Некоторые лиганды оказывают трансвлияние, т.е. способствуют замещению групп, расположенных в транс-положении. Лиганды расположены в ряд по уменьшению их трансвлияния:
CN — ≈ CO ≈ C2H4 > NO2 — > I — > Br — > Cl — > NH3 > OH — > H2O
При воздействии NH3 на K2[PtCl4], сначала один из четырех лигандов замещается молекулой аммиака:
При дальнейшем воздействии аммиака замещается еще один лиганд. Ионы Cl — , находящиеся в транс-положении не замещаются, т.к. их трансвлияние больше, чем молекулы NH3, и тем самым, они сильнее связаны с комплексообразователем:
Процессы образования комплексных соединений влияют на свойства всех частиц, образующих комплекс.
Видео:Ерёмин В. В. - Общая химия - Комплексные соединения (Лекция 7)Скачать

Химические свойства комплексных соединений
Для комплексных соединений проявление химической и биологической активности заключается в наличии свободных орбиталей комплексообразователя (координационная ненасыщенность) и наличии свободных электронных пар лигандов. Комплекс будет обладать электрофильными и нуклеофильными свойствами, отличающимися от свойств комплексообразователя и лигандов.
В целом, комплексным соединениям присущи свойства, аналогичные другим классам соединений:
1. Диссоциация:
Первичная (как сильные электролиты):
Вторичная (как слабые электролиты):
2. Реакции обмена
Обмен ионами внешней сферы:
Обмен ионов внутренней сферы:
3. Образование более прочного комплексного соединения:
4. Окислительно-восстановительные реакции:
Без разрушения комплекса:
С разрушением комплекса:
5. Разрушение комплексного соединения:
Чем более прочно связаны лиганд и комплексообразователь, тем менее заметно проявляются их свойства в растворе и тем больше сказываются особенности комплекса.
Видео:Номенклатура комплексных соединений. 11 класс.Скачать

Уравнения химических реакций комплексных соединений в молекулярной и ионно-молекулярной форме
Задача 729.
Установить, в каких случаях произойдет взаимодействие между растворами указанных электролитов. Написать уравнения реакций в молекулярной и ионно-молекулярной форме:
а) К2[HgI4] + KBr;
б) К2[HgI4] + KCN;
в) [Ag(NH3)2]Cl + K2S2O3;
г) K[Ag(CN)2] + KBr;
д) K[Ag(CN)2] + NH3;
е) K[Ag(NO2)2] + NH3;
ж) [Ag(NH3)2]Cl + NiCl2;
з) K3[Cu(CN)4] + Hg(NO3)2.
Решение:
а) К2[HgI4] + KBr
Реакция не протекает так как Kн(K2[HgI4] 2- ) 2- ),
При диссоциации К2[HgI4] и KBr образуются ионы К +, Br — и [HgI4] 2- , который обладает большой устойчивостью:
2K + + [HgI4] 2- + K + + Br — = 3K + + [HgI4] 2- + Br — — реакция не протекает.
б) К2[HgI4] + KCN
Реакция протекает так как Kн(K2[HgI4]) > Kн(K2[Hg(CN)4], получим:
K2[HgI4] + 4KCN = K2[Hg(CN)4] + 4KI (молекулярная форма);
2K + + [HgI4] 2- + 4K + + 4CN — = 2K + + [Hg(CN)4] 2- + 4K + + 4I — (полная ионная форма);
[HgI4] 2- + 4CN — = [Hg(CN)4] 2- + 4I — (сокращенная ионная форма).
г) K[Ag(CN)2] + KBr;
Реакция не протекает так как при диссоциации K[Ag(CN)2] и KBr образуются ионы К+, Br- и [Ag(CN)2]-, который обладает большой устойчивостью.
д) K[Ag(CN)2] + NH3
Реакция не протекает так как Kн([Ag(CN)2] — ) + ). При диссоциации K[Ag(CN)2] образуются ионы К + и [Ag(CN)2] — , который ведет себя в обменных реакциях как неразрывное целое:
K[Ag(CN)2] + NH3 = K + + [Ag(CN)2] — + NH3.
е) K[Ag(NO2)2] + NH3
При диссоциации K[Ag(NO2)2] образуются ионы K + и [Ag(NO2)2] — , который обладает большой устойчивостью:
K[Ag(NO2)2] = K + и [Ag(NO2)2] — . Реакция не протекает, так как ион [Ag(NH3)2] + не образуется, потому что Kн([Ag(NO2)2] — ) + .
ж) [Ag(NH3)2]Cl + NiCl2
Как электролиты обе соли диссоциируют:
[Ag(NH3)2]Cl = [Ag(NH3)2] + + Сl — ;
NiCl2 = N1 2+ + 2Cl — .
Ионы Ag + и Cl — соединяясь друг с другом образуют нерастворимое соединение AgCl, а ион Ni 2+ с NH3 образует комплекс [Ni(NH3)6] 2+ , так как Kн (Ni(NH3)6] 2+ ) + ), получим:
3[Ag(NH3)2]Cl + NiCl2 = [Ni(NH3)6]Сl2 + 3AgCl↓ (молекулярная форма);
3[Ag(NH3)2] + + Cl — + Ni 2+ + 2Cl — = [Ni(NH3)6] 2+ + 2Сl — + 3AgCl↓ (полная ионная форма);
3[Ag(NH3)2] + + Ni 2+ + 3Cl — = [Ni(NH3)6] 2+ + 3AgCl↓ (сокращенная ионная форма).
Задача 730.
Вычислить концентрацию ионов Ag+ в 0,1 М растворе [Ag(NH3)2]NO3, содержащем в избытке 1 моль/л NH3.
Решение:
Константа нестойкости иона [Ag(NH3)2] + равна 9,3 . 10 -8 . Вторичная диссоциация комплексного иона протекает по схеме:
[Ag(NH3)2]+ = Ag + + 2NH3
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда [NH3] = С(NH3 ) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2] + может быть приравнена общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
Отсюда выражаем концентрацию ионов Ag+:
Ответ: 9,3 . 10-8 моль/л.
Задача 731.
Вычислить концентрацию ионов кадмия в 0,1 М растворе K2[Cd(CN)4], содержащем, кроме того, 6,5 г/л КCN.
Решение:
M(KCN) = 65г/моль. Рассчитаем концентрацию цианида калия:
Константа нестойкости иона [Cd(CN)4] 2+ равна 7,8 . 10 -18 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка ионов CN — , создаваемого в результате диссоциации КCN (которую можно считать полной), это равновесие смещено влево настолько, что количество ионов CN — , образующихся при вторичной диссоциации, можно пренебречь. Тогда [Сd 2+ ] = С(соли) = 0,01 моль/л. По той же причине равновесная концентрация ионов [Cd(CN)4] 2- может быть приравнена к общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
Отсюда выражаем концентрацию ионов Сd 2+ :
Ответ: 7,8 . 10-15 моль/л.
Задача 732.
Найти массу серебра, находящегося в виде ионов в 0,5 л 0,1 М раствора дитиосульфатоаргентата натрия Na3[Ag(S2O3)2], содержащем, кроме того, 0,1 моль/л тиосульфата натрия.
Решение:
М(Ag) = 107,868г/моль. Константа нестойкости иона [Ag(S2O3)2] 3- равна 1,1 . 10 -13 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка ионов S 2 O 3 2- , создаваемого в результате диссоциации К2S2O3 (которую можно считать полной), это равновесие смещено влево настолько, что количество ионов S 2 O 3 2- , образующихся при вторичной диссоциации, можно пренебречь. Тогда [Ag + ] = С(К2S2O3) = 0,1 моль/л. По той же причине равновесная концентрация ионов [Ag(S2O3)2] 3- может быть приравнена к общей концентрации комплексной соли (0,1 моль/л).По условию задачи:
Отсюда выражаем концентрацию ионов Ag + :
Теперь рассчитаем массу серебра, находящуюся в виде ионов в количестве 1,1 . 10 -12 моль/л в растворе комплексной соли:
Ответ: 5,9 . 10 -9 г.
Задача 733.
Выпадет ли осадок галогенида серебра при прибавлении к 1 л 0,1 м раствора [Ag(NH3)2]NO3, содержащему 1 моль/л аммиака: а) 1 . 10 -5 моль КВг; б) 1 . 10 -5 моль КI? ПР(AgBr) = 6 . 10 -13 ; ПР(AgI) = 1,1 . 10 -16 .
Решение:
Константа нестойкости иона [Ag(NH3)2] + равна 9,3 . 10 -9 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда <NH3] = С(NH3 ) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2] + может быть приравнена общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
Отсюда выражаем концентрацию ионов Ag+:
а) Уравнение реакции имеет вид:
Из уравнения реакции следует, что из 1 моль КBr и 1 моль [Ag(NH 3 ) 2 ]NO 3 образуется 1 моль AgBr. Так как [Ag + ] = 9,3 . 10 -9 моль/л; [Br — ] =1 . 10 -5 моль/л, то произведение концентраций ионов Ag + и Br — будет равна: (9,3 . 10 -9 ) . (1 . 10 -5 ) = 9,3 . 10 -14 . Так как 9,3 . 10 -14 > 1,1 . 10 -16 , то осадок бромида серебра не образуется.
📺 Видео
Химия. Объяснение темы "Комплексные соединения"Скачать

Комплексные соли | Химия ЕГЭ 2022 | УмскулСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химическая связь в комплексных соединениях (дистант - 17-11-2020)Скачать

Константа нестойкости и диссоциация комплексных соединенийСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Комплексные соединенияСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Классификация комплексных соединений. 11 класс.Скачать