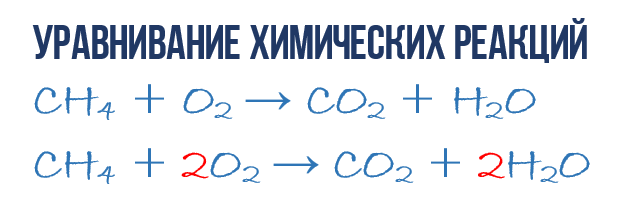В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
- Химическое уравнение
- Уравнивание химических реакций
- Коэффициенты в уравнениях химических реакций
- Как расставлять коэффициенты в химических уравнениях
- Пример разбора простых реакций
- Пример разбора сложной реакции
- Видео
- Коэффициенты в химических уравнениях — как правильно расставлять и уравнивать
- Краткое описание
- Правильная запись реакций
- Ключевые нюансы
- Понятие ОВР в химии
- Определение коэффициентов
- Решение классической задачи
- Дополнительная информация
- Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химическое уравнение
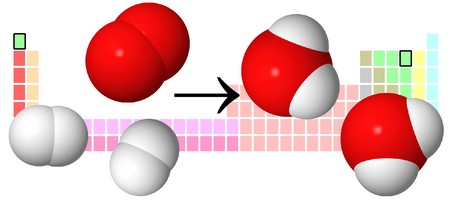
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Видео:ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Как расставлять коэффициенты в химических уравнениях
Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Видео:Химические уравнения. Урок 15. Химия 7 классСкачать

Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Коэффициенты в химических уравнениях — как правильно расставлять и уравнивать
Не только ответственные ученики старших классов, но и студенты, которые решили заняться изучением базовых элементов сложной и интересной науки, стремятся научиться расставлять коэффициенты в химических уравнениях, чтобы итоговый результат соответствовал всем требованиям. Эта тема имеет много интересных фактов и правил, которые позволяют хорошо усвоить направление. Если правильно разобраться во всех нюансах, то в будущем не возникнет проблем с решением сложных задач.
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Краткое описание
Всем достоверно известно, что диоксид углерода (СО2) и вода (Н2О) образуются в результате горения метана (СН4) в кислороде (О2). Это химическое явление элементарное и вполне логическое. Саму реакцию можно обозначить следующим уравнением: СН4+О2→СО2+Н2О. Если ученик решил более углублённо заняться изучением этой удивительной науки, то наверняка ему будет интересно постараться извлечь из этого примера химического уравнения гораздо больше ценной информации, нежели просто просмотреть запись всех реагентов, а также продуктов реакции.
Уравнение относится к категории неполных, из-за чего неподготовленный ученик не может быстро посчитать, сколько именно молекул О2 уходит на одну молекулу метана, а также какое количество молекул диоксид углерода и воды можно получить в сумме. В такой ситуации может помочь дополнительная запись данных перед соответствующими молекулярными формулами (численные стехиометрические коэффициенты).
Указанные цифры будут обозначать, сколько именно молекул каждого вида будет принимать активное участие в химической реакции. В химии часто используется стехиометрия (направление науки, которое занимается изучением количественного соотношения между веществами, вступившими в реакцию и сформированными во время этого процесса продуктами) для переноса зарядов.
Чтобы ученик мог логическим образом закончить составление уравнения, необходимо усвоить одно, но очень важное правило: в обеих частях примера должно присутствовать равное число атомов каждой разновидности. Во время химических реакций не образуются новые атомы, а также не происходит ликвидация имеющихся молекул. Именно это правило базируется на законе сохранения массы, что тоже нужно запомнить.
Востребованные сегодня онлайн-калькуляторы позволяют найти ответы на самые сложные задания, а также выстроить поэтапно алгоритм решения более сложных упражнений.
Видео:Химические уравнения. Как составлять химические уравнения.Скачать

Правильная запись реакций
Различные примеры того, как можно уравнивать химические реакции позволяют ученикам лучше усвоить то, каким именно образом принято расставлять коэффициенты в уравнениях. Для избежания грубых ошибок нужно подробно разобраться во всех нюансах. Если ученику необходимо записать правильное уравнение, которое сможет подтвердить базовые характеристики метана, тогда ему следует выбрать один из следующих вариантов:
Стоит отметить, что для первого варианта в левой части пишут первоначальное вещество, а вот в правой подробно описаны полученные во время реакции продукты. После тщательной проверки количества атомов можно сформировать оптимальную финальную запись происходящего процесса. Во время произведённых экспериментов специалистами было доказано, что в результате горения метана в кислороде неизбежно происходит своеобразный экзотермический процесс. В итоге возникает углекислый газ и водяной пар.
Чтобы уметь правильно расставлять коэффициенты в химических уравнениях, необходимо прибегнуть к действующему закону сохранения массы веществ.
Лучше всего начинать процесс уравнения с определения точного количества атомов углерода. На финальном этапе остаётся только выполнить все необходимые расчёты для водорода, чтобы после этого иметь возможность проверить количество кислорода. Базовые значения задействованных элементов можно узнать из специальной таблицы.
Видео:Химические свойства алкенов: всё, что нужно знать для ЕГЭСкачать

Ключевые нюансы
Для правильного решения поставленных задач ученики обязательно должны знать, что собой представляет балансировка химических уравнений. Элементарное уравнение необходимо для того, чтобы из самого обычного примера получить максимально развёрнутый результат.
Проще всего начинать изучение этой темы с углерода. В левой части присутствует всего один атом С, который является неотъемлемым компонентом состава молекулы СН4. А вот с правой стороны содержится одна молекула С, которая дополняет состав СО2. Это значит, что в двух присутствующих частях итоговое количество атомов углерода максимально совпадает, из-за чего нет необходимости выполнять какие-либо действия. Просто для лучшего понимания всех нюансов можно поставить единицу в качестве коэффициента перед молекулами с углеродом. Итоговая формула примет следующий вид: 1СН4+О2→1СО2+Н2О.
После всех проделанных манипуляций можно подсчитать количество атомов водорода. С левой стороны присутствует четыре атома H в составе СН4, а вот с правой — только два атома, которые входят в состав Н2О. После этого остаётся только всё уровнять. Для этих целей достаточно записать коэффициент 2 перед молекулой Н2О. В итоге не только в реагентах, но и в полученных продуктах будет по четыре молекулы водорода. Формула будет выглядеть так: 1СН4+О2→1СО2+2Н2О.
Во время расстановки коэффициентов методом электронного баланса очень важно не только разбираться в химии, но и владеть элементарными математическими навыками. Если изучить этот пример — 1СН4+2О2→1СО2+2Н2О, то можно понять, как выглядит полноценное уравнение исследуемой химической реакции. В этом случае полностью соблюдается закон о сохранении имеющейся массы.
Число атомов, которые вступают в сложную реакцию, максимально совпадает с итоговым количеством веществ определённого сорта по окончании реакции. Но ученику нужно хорошо понимать тот факт, что возникающая реакция представляет собой весьма специфическую последовательность отдельных промежуточных стадий. Но даже успешное уравнение не может раскрыть всю информацию об изучаемом молекулярном механизме.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Понятие ОВР в химии
В учебной литературе подробно описано то, что даже самые сложные уравнения можно уровнять. Но для этих целей понадобятся знания в сфере того, как управлять методом электронного баланса либо полуреакций. Существует определённая последовательность всех манипуляций, которая была разработана специалистами для поэтапной расстановки всех коэффициентов в реакциях двух категорий:
Для избежания грубых ошибок на первом этапе правильно расставляют степени окисления возле каждого задействованного элемента. В этом случае нужно учитывать ряд рекомендаций:
- Показатель окисления всегда равен нулю у простых компонентов.
- Если в состав соединения входит три и более элемента, тогда у первого вещества проявляется положительная характеристика, а вот у крайнего только отрицательное. Необходимый центральный элемент высчитывают исключительно при помощи математических знаний, но в итоге должен получиться ноль.
- В соединении бинарного типа степень окисления соответствует нулю.
После проделанных манипуляций учащемуся нужно выбрать те ионы либо атомы, показатель степени окисления которых можно преобразовать. Количеством электронов можно показывать при помощи знаков + и -. А также нельзя забывать о необходимости определить наименьшее кратное. Во время деления НОК можно находить максимально достоверный результат.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Определение коэффициентов
Лучше всего разобраться во всех нюансах на конкретном примере. Специалисты рекомендуют рассмотреть тринитротолуол (ТНТ) С7Н5 N 3О6. Этот элемент отлично соединяется с кислородом, благодаря чему образуется Н2О, СО2, а также N2. Чтобы не запутаться, данные могут записаться в виде обычного уравнения реакций, с которым нужно будет активно работать: C7H5N3O6+O2→CO2+H2O+N2.
Гораздо проще самостоятельно составлять максимально развёрнутую химическую задачу, базируясь во время этого на двух молекулах тринитротолуола, так как с левой стороны содержится нечётное количество атомов азота и водорода, а с правой записывают чётное число молекул. Если изучить приведённый пример, то становится понятно, что атомы углерода, водорода и азота содержатся в соотношении 14:10:6. Но после нехитрых действий они подвергнутся изменениям. В итоге можно будет получить молекулы воды, диоксид углерода и азота (соотношение 5:14:3).
Полное химическое уравнение примет следующий вид — 4C7H5N3O6 + 21O2 → 28CO2 + 10H2O + 6N2. Пример несёт в себе много полезной информации, которая первым делом указывает на исходные вещества — конкретные реагенты, а также другие химические продукты. Во время реакции индивидуально сохраняются абсолютно все атомы каждого сорта.
Если попробовать умножить обе части уравнения на число Авогадро (NA=6,022·1023), то в итоге можно будет смело утверждать, что 4 моля ТНТ реагируют на 21 моль О2. После такого «контакта» могут сформироваться 28 молей СО2, 10 молей Н2О, а также 6 молей N2.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Решение классической задачи
Если учащемуся необходимо определить точный объём раствора хлороводорода 10%, стандартная плотность которого находится в пределах 1,05 г/мл, тогда нужно знать, что эта жидкость идеально подходит для полной ликвидации гидроксида кальция, неизбежно формирующегося в процессе гидролиза его карбида. Из химии всем хорошо известно, что во время этой процедуры в воздух выделяется специфический газ, объём которого составляет 8,96 л. Чтобы решить поставленную задачу без единой ошибки, нужно первым делом постараться составить уравнение для гидролиза карбида кальция.
Эта задача не является сложной, но только в том случае, если ученик хорошо усвоит все основные правила. Гидроксид кальция вступает во взаимодействие с хлороводородом, из-за чего происходит полноценная нейтрализация. На финальном этапе формула примет такой вид: Са (ОН)2+2HCI = CaCl2+2H2O. Обязательно нужно записать точную массу кислоты, так как она неизбежно понадобится для дальнейших действий. Остаётся установить объём задействованного раствора хлороводорода.
Абсолютно все расчёты по этой задаче должны выполняться в соответствии с коэффициентами стереохимического типа, что лишний раз подтверждает их актуальность.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Дополнительная информация
Если учитывать то, что в большинстве случаев расстановка коэффициентов вызывает определённые затруднения, тогда нужно отработать схему действий на конкретных примерах. Для лучшего понимания всех нюансов следует рассмотреть уравнение, которое связано с расстановкой важных данных в классической реакции окислительно-восстановительного типа. Нужно разобраться со следующей формулой: Н2S+HMnO4=S+MnO2…
Ключевая особенность этой задачи в том, что ученику нужно максимально дополнить утерянный продукт реакции, чтобы в итоге иметь возможность перейти к указанию всех необходимых коэффициентов. После правильной расстановки на положенные места базовых степеней окисления у каждого вещества в соединениях можно выполнить логический вывод, что первоначальные свойства проявляет только марганец, который понижает валентность. Восстановительную способность в этой реакции лучшим образом демонстрирует сера, которая восстанавливается до простого вещества.
После окончательного составления электронного баланса остаётся правильно расставить коэффициенты в предполагаемую схему химического процесса. На этом задачу можно считать выполненной.
Необходимо дополнительно поработать над нахождением наименьшего общего кратного, чтобы правильно делить, а также умножать числа. Расстановке коэффициентов в уравнениях обязательно нужно уделять должное внимание, так как это одна из основных тем в многогранной и интересной химии.
🔍 Видео
ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Как УРАВНИВАТЬ химические уравнения | Расстановка коэффициентов в химических реакцияхСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

СЕКРЕТНЫЙ СПОСОБ — Как составлять химические уравнения? Химия 8 класс #shorts #youtubeshortsСкачать