- Положение в периодической системе химических элементов
- Электронное строение меди
- Физические свойства
- Нахождение в природе
- Способы получения меди
- Качественные реакции на ионы меди (II)
- Химические свойства меди
- Оксид меди (II)
- Способы получения оксида меди (II)
- Химические свойства оксида меди (II)
- Оксид меди (I)
- Способы получения оксида меди (I)
- Химические свойства оксида меди (I)
- Гидроксид меди (II)
- Способы получения гидроксида меди (II)
- Химические свойства
- Соли меди
- Соли меди (I)
- Соли меди (II)
- Медь и соединения меди
- Медный купорос ГОСТ 19347-99
- Содержание
- Нахождение в природе
- Получение
- В промышленности
- В лабораторных условиях
- Очистка
- Глубокая очистка
- Физические свойства
- Строение кристаллогидрата
- Термическое воздействие
- Растворимость
- Химические свойства
- Электролитическая диссоциация
- Реакция замещения
- Реакция с растворимыми основаниями (щелочами)
- Сокращённое ионное уравнение (Правило Бертолле)
- Реакция обмена с другими солями
- Прочее
- Сульфат меди Е519: свойства, применение, вред и польза
- Что такое сульфат меди?
- Формула, уравнение, свойства сульфата меди
- Получение сульфата меди
- Реакции с сульфатом меди, соединения
- Сферы применения сульфата меди
- Применение сульфата меди в медицине, ветеринарии
- Применение сульфата меди в садоводстве
- Применение сульфата меди в пищевой промышленности
- Применение сульфата меди в металлургии, машиностроении и строительстве
- Влияние на организм человека, фармакологическое действие
- Допустимые нормы приема сульфата меди
- Польза сульфата меди
- Вред сульфата меди
- Инструкция по применению
- В медицине
- В садоводстве
- В других сферах
- Класс опасности и токсичности, хранение
- Где купить и сколько стоит сульфат меди
- Заключение
- 🔥 Видео
Положение в периодической системе химических элементов
Медь расположена в 11 группе (или в побочной подгруппе II группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии :
+29Cu 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 1s 

3s 


У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Изображение с портала zen.yandex.com/media/id/5d426107ae56cc00ad977411/uralskaia-boginia-liubvi-5d6bcceda660d700b075a12d
Температура плавления 1083,4 о С, температура кипения 2567 о С, плотность меди 8,92 г/см 3 .
Медь — ценный металл в сфере вторичной переработки. Сдав лом меди в пункт приема, Вы можете получить хорошее денежное вознаграждение. Подробнее про прием лома меди.
Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2 (OH) 2 CO 3 . Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн .
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
- Гидрометаллургический метод: р астворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например , вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
- Пирометаллургический метод : получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций. Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
- Электролиз растворов солей меди:
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами . При этом образуется голубой осадок гидроксида меди(II).
Например , сульфат меди (II) взаимодействует с гидроксидом натрия:
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями , например , с кислородом , образуя CuО, Cu2О в зависимости от условий:
2Cu + О2 → 2CuО
1.2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
1.3. Медь взаимодействует с галогенами . При этом образуются галогениды меди (II):
Но, обратите внимание:
2Cu + I2 = 2CuI
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например , медь не реагирует с разбавленной серной кислотой :
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой . При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
2.4. Медь реагирует даже при обычных условиях с азотной кислотой .
С концентрированной азотной кислотой:
С разбавленной азотной кислотой:
Реакция меди с азотной кислотой
2.5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей .
Например , медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO 3 ) 2 + Cu = Cu(NO 3 ) 2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например , оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например , оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
Например , алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
Химические свойства оксида меди (I)
1. Оксид меди (I) обладает основными свойствами.
При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду:
Например , соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl↓ + H2O
2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2] + . Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом :
СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например , при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя :
Cu2O + CO = 2Cu + CO2
А под действием окислителей, например, кислорода — свойства восстановителя :
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например , хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных ).
1. Взаимодействует с кислотами .
Например , взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака , образуя сине-фиолетовое комплексное соединение:
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается :
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность . Как восстановители они реагируют с окислителями.
Например , хлорид меди (I) окисляется концентрированной азотной кислотой :
Также хлорид меди (I) реагирует с хлором :
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
Иодид меди (I) реагирует с концентрированной серной кислотой :
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Для соединений меди (I) возможна реакция диспропорционирования :
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2] + получают растворением в концентрированном растворе аммиака :
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например , соли меди (II) окисляют иодиды и сульфиты :
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
Бромиды и иодиды меди (II) можно окислить перманганатом калия :
Соли меди (II) также окисляют сульфиты :
Более активные металлы вытесняют медь из солей.
Например , сульфат меди (II) реагирует с железом :
CuSO4 + Fe = FeSO4 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой . При нагревании возможно образование сульфата меди (II):
Еще одна форма этой реакции:
CuS + 10HNO 3( конц .) = Cu(NO 3 ) 2 + H 2 SO 4 + 8NO 2 ↑ + 4H 2 O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например , растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO 4 + 2NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
Электролиз раствора нитрата меди (II):
Некоторые соли меди при нагревании разлагаются , например , нитрат меди (II):
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Медь и соединения меди
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
Видео:Реакция сульфата меди II ( медный купорос) с гидроксидом натрия ( щелочами)Скачать

Медный купорос ГОСТ 19347-99
| Медный купорос | |
|---|---|
| Систематическое наименование | медный купорос |
| Традиционные названия | пентагидрат: сульфат меди (II), медь сернокислая техническая |
| Хим. формула | CuSO 4 |
| Состояние | кристаллическое |
| Молярная масса | 159,609 (сульфат) 249.685 (пентагидрат) г/моль |
| Плотность | 3,64 г/см³ |
| Твёрдость | 2,5 |
| Т. разл. | выше 650 °C |
| pKa | 5⋅10 −3 |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | безв. — ромбическая пентагидрат — триклинная пинакоидальная тригидрат — моноклинная |
| ГОСТ | ГОСТ 19347-99 |
| Рег. номер CAS | 7758-98-7 |
| PubChem | 24462 |
| Рег. номер EINECS | 231-847-6 |
| SMILES | |
| Кодекс Алиментариус | E519 |
| RTECS | GL8800000 |
| ChEBI | 23414 |
| ChemSpider | 22870 |
| ПДК | в воздухе: мр 0,009, сс 0,004; в воде: 0,001 |
| ЛД50 | крысы, орально: 612,9 мг/кг мыши, орально: 87 мг/кг |
| Токсичность | |
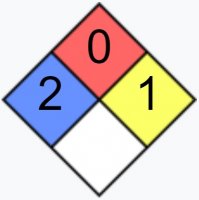
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Медный купорос (медь сернокислая, сульфат меди (II) ) — неорганическое соединение, медная соль серной кислоты с формулой CuSO 4. Нелетучее вещество, не имеет запаха. В безводном виде — белый порошок, очень гигроскопичное. В виде кристаллогидратов — прозрачные негигроскопичные кристаллы различных оттенков синего с горьковато-металлическим вяжущим вкусом, на воздухе постепенно выветриваются (теряют кристаллизационную воду).
Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется голубой пентагидрат CuSO4·5H2O — медный купорос. Токсичность медного купороса для теплокровных животных относительно невысока, в то же время, он высокотоксичен для рыб.
Обладает дезинфицирующими, антисептическими, вяжущими свойствами. Применяется в медицине, в растениеводстве как антисептик, фунгицид или медно-серное удобрение.
Реакция гидратации безводного сульфата меди (II) экзотермическая и проходит со значительным выделением тепла.
Видео:СУЛЬФАТ МЕДИСкачать

Видео:Реакция аммиака с сульфатом меди. Химический опытСкачать

Содержание
- 1 Нахождение в природе
- 2 Получение
- 2.1 В промышленности
- 2.2 В лабораторных условиях
- 2.3 Очистка
- 2.3.1 Глубокая очистка
- 3 Физические свойства
- 3.1 Строение кристаллогидрата
- 3.2 Термическое воздействие
- 3.3 Растворимость
- 4 Химические свойства
- 4.1 Электролитическая диссоциация
- 4.2 Реакция замещения
- 4.3 Реакция с растворимыми основаниями (щелочами)
- 4.4 Сокращённое ионное уравнение (Правило Бертолле)
- 4.5 Реакция обмена с другими солями
- 4.6 Прочее
- 5 Производство и применение
- 6 Токсикология
Видео:Взаимодействие железа с сульфатом медиСкачать

Нахождение в природе
В природе встречается в виде минералов халькантита (CuSO4·5H2O), халькокианита (CuSO4), бонаттита (CuSO4·3H2O), бутита (CuSO4·7H2O) и в составе некоторых других минералов.
Видео:CuSO4 + NaOH Взаимодействие сульфата меди (II) с гидроксидом натрия в водном раствореСкачать

Получение
В промышленности
В промышленности загрязненный сульфат меди(II) получают растворением меди и медных отходов в разбавленной серной кислоте H2SO4 при продувании воздуха:
растворением оксида меди(II) CuO в H2SO4:
сульфатизирующим обжигом сульфидов меди и как побочный продукт электролитического рафинирования меди.
В лабораторных условиях
В лаборатории CuSO4 можно получить действием концентрированной серной кислоты на медь при нагревании:
температура не должна превышать 60 °С, при большей температуре в значительных количествах образуется побочный продукт — сульфид меди(I):
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди(II) серной кислотой, для получения сульфата меди высокой чистоты используют соответственно чистые реактивы:
Чистый сульфат меди может быть получен следующим образом. В фарфоровую чашку наливают 120 мл дистиллированной воды, прибавляют 46 мл химически чистой серной кислоты плотностью 1,8 г/см 3 и помещают в смесь 40 г чистой меди (например, электролитической). Затем нагревают до 70—80 °С и при этой температуре в течение часа постепенно, порциями по 1 мл, прибавляют 11 мл конц. азотной кислоты. Если медь покроется кристаллами, прибавить 10—20 мл воды. Когда реакция закончится (прекратится выделение пузырьков газа), остатки меди вынимают, а раствор упаривают до появления на поверхности пленки кристаллов и дают остыть. Выпавшие кристаллы следует 2—3 перекристаллизовать из дистиллированной воды и высушить.
Очистка
Очистить загрязненный или технический сульфат меди можно перекристаллизацией — вещество растворяется в кипящей дистиллированной воде до насыщения раствора, после чего охлаждается до приблизительно +5 °С. Полученный осадок кристаллов отфильтровывается. Однако даже многократная перекристаллизация не позволяет избавиться от примеси соединений железа, которые являются наиболее распространенной примесью в сульфате меди.
Для полной очистки медный купорос кипятят с диоксидом свинца PbO2 или пероксидом бария BaO2, пока отфильтрованная проба раствора не покажет отсутствия железа. Затем раствор фильтруют и упаривают до появления на поверхности пленки кристаллов, после чего охлаждают для кристаллизации.
По Н. Шоорлю очистить сульфат меди можно так: к горячему раствору CuSO4 прибавить небольшие количества пероксида водорода H2O2 и гидроксида натрия NaOH, прокипятить и отфильтровать осадок. Выпавшие из фильтрата кристаллы дважды подвергаются перекристаллизации. Полученное вещество имеет чистоту не ниже квалификации «ХЧ».
Глубокая очистка
Существует более сложный способ очистки, позволяющий получить сульфат меди особой чистоты, с содержанием примесей около 2·10 -4 %.
Для этого готовится водный, насыщенный при 20°С раствор сульфата меди (вода используются только бидистиллированная). В него добавляют перекись водорода в количестве 2-3 мл 30 % раствора на 1 литр, перемешивают, вносят свежеосаждённый основной карбонат меди в количестве 3-5 грамм, нагревают и кипятят 10 минут для разложения H2O2.
Затем раствор охлаждают до 30—35 °С, фильтруют и приливают 15 мл 3%-ного раствора диэтилдитиокарбамата натрия и выдерживают в мешалке три-четыре часа не понижая температуры. Далее раствор быстро процеживают от крупных хлопьев комплексов и вносят активированный уголь БАУ-А на полчаса при перемешивании. Затем раствор следует отфильтровать вакуумным методом.
Дальше в раствор CuSO4 приливают на 1 л около 200 мл насыщенного раствора NaCl квалификации «Ч» и вносят чистый алюминий в проволоке или обрезках до полного прохождения реакции, выделения меди и просветления раствора (при этом выделяется водород). Выделенную медь отделяют от алюминия взбалтыванием, осадок промывают декантацией сперва водой затем заливают горячим 5—10 % раствором соляной кислоты ХЧ при взбалтывании в течение часа и постоянным подогревом до 70—80 °С, затем промывают водой и заливают 10—15%-ной серной кислотой (ОСЧ 20-4) на час с подогревом при том же интервале температур. От степени и тщательности промывания кислотами, а также квалификации применяемых далее реактивов зависит чистота дальнейших продуктов.
После промывки кислотами медь снова моют водой и растворяют в 15—20%-ной серной кислоте (ОСЧ 20-4) без её большого избытка с добавлением перекиси водорода (ОСЧ 15-3). После прохождения реакции полученный кислый раствор сульфата меди кипятят для разложения избытка перекиси и нейтрализуют до полного растворения вначале выпавшего осадка перегнанным 25%-ным раствором аммиака (ОСЧ 25-5) или приливают раствор карбоната аммония, очищенного комплексно-адсорбционным методом до особо чистого.
После выстаивания в течение суток раствор медленно фильтруют. В фильтрат добавляют серную кислоту (ОСЧ) до полного выпадения голубовато-зелёного осадка и выдерживают до укрупнения и перехода в зелёный основной сульфат меди. Зелёный осадок выстаивают до компактности и тщательно промывают водой до полного удаления растворимых примесей. Затем осадок растворяют в серной кислоте, фильтруют, устанавливают рН=2,5—3,0 и перекристаллизовывают два раза при быстром охлаждении, причем при охлаждении раствор каждый раз перемешивают для получения более мелких кристаллов сульфата меди. Выпавшие кристаллы переносят на воронку Бюхнера и удаляют остатки маточного раствора с помощью водоструйного насоса. Третья кристаллизация проводится без подкисления раствора с получением чуть более крупных и оформленных кристаллов.
Видео:Взаимодействие железа с раствором сульфата меди II. Задание 19. Химия ОГЭСкачать

Физические свойства
Пентагидрат сульфата меди (II) (медный купорос) — синие прозрачные кристаллы триклинной сингонии. Плотность 2,284 г/см 3 . При температуре 110 °С отщепляется 4 молекулы воды, при 150 °С происходит полное обезвоживание.
Строение кристаллогидрата
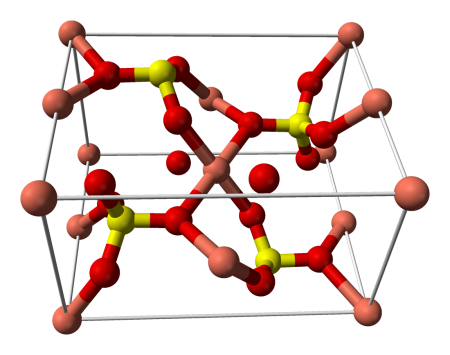
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Термическое воздействие
При нагревании пентагидрат последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4·3H2O (этот процесс, выветривание, медленно идёт и при более низких температурах [в том числе при 20—25 °С]), затем в моногидрат (при 110 °С) CuSO4·H2O, и выше 258 °C образуется безводная соль.
Выше 650 °C становится интенсивным пиролиз безводного сульфата по реакции:
Растворимость
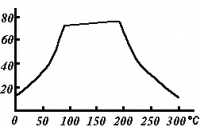
Растворимость сульфата меди (II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80—200 °C). (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди (II) гидролизуется, (степень гидролиза в 0,01 М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5⋅10 −3 .
Видео:Реакция железа с раствором сульфата меди (II)Скачать

Химические свойства
Электролитическая диссоциация
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах сульфат меди(II) так же, как и все растворимые соли, диссоциирует в одну стадию:
Реакция замещения
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов:
Реакция с растворимыми основаниями (щелочами)
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета:
Сокращённое ионное уравнение (Правило Бертолле)
Реакция обмена с другими солями
Сульфат меди вступает также в обменные реакции по ионам Cu 2+ и SO4 2-
Прочее
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Видео:Реакция МЕДИ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Получение СУЛЬФАТА МЕДИ.Опыты по химии.ЭкспериментыСкачать

Сульфат меди Е519: свойства, применение, вред и польза
Сульфат меди – это неорганическое соединение, медная соль серной кислоты, более известно под названием медный купорос. Вещество обладает высокой реакционной способностью и применяется во многих сферах: в растениеводстве как антисептик и удобрение, в фармакологии, в пищевой промышленности, в машиностроении. Сернокислая медь обладает комплексом полезных свойств, ценится в медицине за антибактериальное, противоопухолевое действие. В садоводстве соединение используют для обогащения почвы медью и уничтожения болезнетворных микроорганизмов. Сульфат меди был зарегистрирован как пищевая добавка Е519, но сегодня его не используют в большинстве стран мира.
Видео:Реакция раствора сульфата меди и аммиака #химияСкачать

Что такое сульфат меди?
Сульфат меди – это соль, имеющую в составе двухвалентную медь и кислотный остаток от серной кислоты. Она образуется в ходе взаимодействия серной кислоты с оксидами, гидроксидами меди или с чистым веществом. В нормальных условиях состояние сульфата кристаллическое со средней плотностью, раствор имеет слабокислую реакцию. Внутри молекулы связи ионные.
В виде безводного порошка сернокислая медь не имеет запаха, бесцветна (либо беловатая), очень гигроскопична, обладает неприятным горьким вкусом. Хорошо растворяется в воде, при повышении температуры процесс усиливается. При смешивании с водой образуют пентагидраты – тонкие прозрачные кристаллы насыщенного синего или голубого цвета. Традиционно их называют медным купоросом. Плотность ниже, чем у порошкообразной формы.
Пентагидраты сульфата меди – это наиболее известные кристаллогидраты. Они формируются, т.к. медь более прочно связывается с молекулами воды, чем с сульфатным остатком. В кристаллической решётке на одну сернокислую медь приходится два остатка серной кислоты и пять молекул воды. Они соединены между собой водородными связями. При нагревании до 110 °С пентагидрат начинает распадаться, вода испаряется, при достижении температуры в 150 °С кристаллы полностью обезвоживаются.
Сульфат меди встречается в природе в составе различных минералов. Между собой они отличаются концентрацией воды, которую связывает медь. Так, например, халькантит – наиболее известный и чаще всего встречающийся минерал, содержащий 5 молекул воды, формируется под воздействием естественного выветривания в месторождениях с сухим климатом (Урал, Закавказье).
Видео:Реакция сульфата меди с иодидом калия. Химический опытСкачать

Формула, уравнение, свойства сульфата меди
Медная соль серной кислоты имеет такую химическую формулу:
При температуре свыше 650 °С начинается термическое разложение соединения:
При этом образуется газ кислород, оксид меди (2) и диоксид серы.
Качественная реакция на медный купорос – это взаимодействие с щелочами:
В ходе реакции образуется осадок голубого цвета – гидроксид меди (2), а также растворимая натриевая соль серной кислоты. Добавление к раствору сернокислой меди хлорида бария также является способом идентификации соединения:
Чётко определяется осадок белого цвета, образованный сульфатом бария, что свидетельствует о наличии в растворе сульфат-ионов.
Сульфат меди поддаётся гидролизу, может реагировать с простыми и сложными веществами. Соединение вступает во взаимодействие с щелочами, а также с другими солями, обладает выраженными окислительно-восстановительными свойствами.
Молекула сульфата меди
Видео:Реакция аммиака с раствором сульфата меди. Химия азота для ЕГЭ по химииСкачать

Получение сульфата меди
В лабораторных условиях для получения сернокислой меди чаще всего используют чистую медь, иногда гидроксид. При добавлении к меди раствора серной кислоты необходимо поддерживать постоянную температуру, не превышающую 60 °С, чтобы минимизировать риск получения побочного продукта – сульфида меди (CuS2). Уравнение лабораторного синтеза:
При получении сульфата из гидроксида меди проводят нейтрализацию серной кислотой:
В большинстве случаев сначала получают загрязнённый железом сульфат меди, который требует дополнительной очистки. Получить изначально чистый продукт крайне сложно, для этого используют дорогостоящие химически чистые реагенты, дистиллированную воду, катализаторы, проводят упаривание, весь процесс занимает несколько часов, а выход оказывается небольшим. Поэтому чаще всего используют поверхностную или глубокую очистку, в зависимости от того, для чего впоследствии будет использоваться медная соль серной кислоты.
В лаборатории очистку проводят перекристаллизацией. Для этого готовят насыщенный раствор медного купороса в дистиллированной воде, который охлаждают до 5 °С, выпадает осадок кристаллов, с которыми потом повторяют процедуру. Спустя несколько циклов перекристаллизации смесь кипятят с диоксидом свинца до тех пор, пока в растворе не останется примесей железа (это проверяют отбором проб и проведением качественных реакций). После этого раствор упаривают до выпадения кристаллов сульфата меди. В процессе глубокой очистки получается особо чистая сернокислая медь, в которой содержание примесей абсолютно не влияет на физико-химические свойства.
В промышленном производстве чаще всего используют медные отходы, в частности медный лом. На специализированных заводах химической промышленности выпуск сульфата меди происходит в несколько этапов:
- Переплавка медного лома в пламенной печи 4,5 – 5 часов, подготовка сырья для повышения реакционных способностей, а также очистки от других металлов.
- Медь, присутствующая в ломе, при температуре 1000 -1084 °С окисляется до закиси меди. Это вещество реагирует с примесями (Fe, Zn, Pb, Al), приводит к образованию чистой меди и окисей металлов (FeO, ZnO и др.).
- Побочные продукты не растворяются, а переходят в шлак и удаляются.
- Температуру понижают для того, чтобы остатки меди, находящиеся в растворе в виде сульфидов, доокислились, реакция протекает очень интенсивно с брызгами.
- В отражательной печи происходит гранулирование меди – получение гранул с тонкими стенками и большой площадью поверхности, которые будут хорошо растворяться в серной кислоте. Для этого необходимо наличие в смеси газов (сернистого и кислорода).
- В кипящую смесь дополнительно добавляют немного комковой серы.
- Тонкой струёй раствор вливают в холодную воду в гранулированном бассейне, представленным бетонированной ямой. Этот этап обеспечивает формирование гранул путём резкого охлаждения и выделения газов.
- Гранулы диаметром 1,5 собираются в стальную корзину, через отверстия которой при поднятии стекает лишняя вода.
- Затем смесь загружают в натравочную башню, где происходит растворение в серной кислоте при постоянной продувке воздухом. Большую роль на этой стадии играет кислород, который реагирует с медью, образуя её закись: Cu + O2 → 2Cu2O. Именно это соединение растворяется в серной кислоте:
Cu2O +H2SO4 →CuSO4 +H2O
Формируется сульфат закиси меди, который затем окисляется до сульфата меди. - Свежий насыщенный раствор медного купороса вытекает из натравочной башни, попадает во вращающийся кристаллизатор.
- Внутри установки жидкость охлаждается, образуются кристаллы, которые отделяются на центрифуге.
- Смесь поступает в сушилку, где просушивается от излишней влаги горячим воздухом (110 °С).
- Проводят очистку сульфата меди с помощью многократной перекристаллизации.
Из 300 кг медного лома и 400 кг серной кислоты получают 1 тонну сернокислой меди. Кроме растворения в кислоте в промышленности применяют также электролитический метод. Для этого сначала готовят электролит с соотношением меди к серной кислоте 3:2. Электролиз протекает в специальных ваннах, где на дне расположен медный катод. При постоянной температуре 70-80 °С и продувке воздухом в течение 12-24 часов образуется раствор сульфата меди. Затем его выпаривают, удаляя ненужные примеси (как правило, железо и кальций), охлаждают в кристаллизаторе, получая готовый продукт.
Видео:Взаимодействие сульфата меди (II) с гидроксидом натрия I ЕГЭ по химииСкачать

Реакции с сульфатом меди, соединения
Сульфат меди хорошо гидролизуется, образуя электролитический раствор с кислой средой:
При этом получается довольно сильный электролит. Электролиз протекает с выделением свободного кислорода, меди и серной кислоты:
Соединение взаимодействует с металлами:
Характерна реакция замещения, в ходе чего выпадает чистая медь.
Для сульфата меди характерны взаимодействия ионного обмена с выпадением различных осадков. Чаще всего сернокислая медь реагирует таким образом с другими солями:
В результате выпадают зеленоватые кристаллы ортофосфата меди. Иногда реакция обмена протекает с изменением степеней окисления, тогда речь идёт об окислительно-восстановительных реакциях:
Сульфат седи реагирует с йодидом натрия, выделяется свободный йод.
Медный купорос при нагревании можно восстановить водородом:
Нередко он формирует комплексные соли, например аммиакаты:
Реакция даёт яркий фиолетовый цвет раствора, образуется сульфат тетрааминмеди.
Видео:Реакция сульфата меди с иодидом калия. Химические опыты.Скачать

Сферы применения сульфата меди
Сульфат меди обладает собственными фармакологическими свойствами, поэтому его применяют в медицине. В пищевой промышленности вещество служит консервантом и стабилизатором окраски. Велика его роль в машиностроении и строительстве, а также в садоводстве.
Применение сульфата меди в медицине, ветеринарии
Сернокислая медь используется в медицине для восполнения дефицита меди в организме в составе поливитаминных средств. Общие укрепляющие адаптогенные свойства меди позволяют назначать медный купорос для поднятия иммунитета, для профилактики злокачественных новообразований. Его используют в комплексной терапии следующих заболеваний:
Соединение обладает сильными антисептическими свойствами. Оно негативно влияет на мембраны и генетический материал патогенных микроорганизмов, поэтому подавляет их размножение, рост и развитие. Раствор сульфата меди применяют местно для заживления ожогов, дезинфекции гнойных ран, а также для спринцевания при вагинитах и уретритах. В определённых дозировках его можно использовать для лечения бактериального конъюнктивита, ангины, тяжёлого фурункулёза.
Медная соль серной кислоты применяется в терапии кожных заболеваний. Так, при экземе, он эффективно прижигает поражённый участок, останавливая образование гнойных корочек и выделение сукровицы.
При пероральном приёме сульфат меди способствует рвоте. Он повышает рвотный рефлекс, предотвращая сильную интоксикацию организма. Поэтому его назначают при различных отравлениях.
Фунгицидная активность медного купороса позволяет подавлять грибок стопы и ногтей. Он задерживает развитие микроскопических грибов, останавливая прогрессирование микоза.
Раствором сульфата меди обрабатывают стойла скота. Дезинфекция помещения важна при карантинных ограничениях различных бактериальных инфекций. Кроме того, обработка уничтожает блох, власоедов, клещей и комаров, которые переносят опасные вирусные заболевания и доставляют животным большой дискомфорт.
Сернокислая медь подходит для лечения некоторых заболеваний лошадей, коров, овец: подошвенные язвы, пальцевый дерматит, копытная гниль. Её используют в терапии паразитарных инвазий аквариумных рыбок (оодиноз, ихтиободоза).
Применение сульфата меди в садоводстве
Основное назначение сульфата меди в огородничестве и садоводстве – обработка растений от патогенов, способных сильно снизить их иммунитет и общую урожайность. Благодаря фунгицидным, бактерицидным и бактериостатическим свойствам соединения он эффективно борется с возбудителями самых распространённых грибковых и бактериальных болезней растительных культур:
- мучнистая роса;
- фитофтороз;
- ржавчина;
- пятнистости: септориоз, альтернариоз, филлостиктоз, мериониоз и антракноз;
- гнили;
- сосудистый бактериоз.
Чаще всего медным купоросом обрабатываются плодовые деревья и кустарники. Он способствует заживлению трещин в коре, за счёт чего значительно уменьшается вероятность инфицирования таким путём. Антисептическое воздействие влияет не только на микроорганизмы, но также и на других сельскохозяйственных вредителей, в том числе насекомых (виноградная филлоксера).
Сульфат меди используется в качестве удобрения. Подкормка восполняет дефицит меди в почве, что благотворно сказывается на метаболизме растений. Медь является жизненно необходимым элементом их роста и развития, она участвует во множестве процессов. Недостаток этого микроэлемента вызывает:
- отмирание цветков;
- остановку плодоношения;
- неправильное формирование листьев и побегов;
- потерю тургора;
- нарушение дыхания и фотосинтеза.
Особенно активно удобряются медным купоросом песчаные, торфяные, болотистые почвы. В них отмечается низкое содержание меди. Подкормку проводят преимущественно весной как корневым, так и внекорневым способом в сухом и растворённом виде.
Применение сульфата меди в пищевой промышленности
Сульфату меди присвоен код Е519. Сегодня он запрещён в России и в некоторых других странах мира. Применение этой пищевой добавки ограничено в связи с неприятным горьким вкусом. Она обладает эмульгирующий свойствами, фиксирует окраску и является хорошим консервантом. Ряд государств продолжает использовать Е519 в продуктах питания (Япония, Украина). Его добавляют в основном в рыбную и мясную продукцию, в чипсы, йогурты. Медный купорос является компонентом питательной смеси для роста дрожжей.
Применение сульфата меди в металлургии, машиностроении и строительстве
Сернокислой медью обрабатывается древесина, поверхности стен, кирпич, для предотвращения развития плесени и защиты от гниения. В строительстве она используется для удаления пятен ржавчины и соли, удаления последствий протечки. В машиностроении сульфат меди фиксирует цвет деталей. Благодаря этому краска дольше держится, не бледнеет и не слазит.
Медный купорос способствует выделению цинковых минералов. Добавление кристаллов в процессе обработки вызывает вспенивание и осаждение нужного металла. Он также может применяться в качестве реагента в горнодобывающей промышленности, в частности на обогатительных фабриках медно-цинковых руд.
Обработка воды в бассейнах и водохранилищах с помощью раствора сульфата меди обеззараживает её, предотвращает развитие грибков и микроскопических водорослей, цветение, сохраняет питьевые качества.
Видео:Реакция Роданида Калия и Сульфата Меди. Роданид Меди - Cu(CNS)2. Реакция CuSO4, KSCN.Скачать

Влияние на организм человека, фармакологическое действие
При правильно подобранных дозировках и курсу лечения сульфат меди не оказывает негативного влияния на здоровье. Фармакологическое действие заключается в обеззараживании, заживлении ран, адаптогенности. Это ценное лекарственное средство, которое нужно грамотно применять для достижения лучшего терапевтического эффекта. Поэтому лечение с помощью медного купороса должно контролироваться врачом.
Допустимые нормы приема сульфата меди
Токсическая доза сернокислой меди при пероральном приёме составляет 0,5 г на 1 кг веса. При такой концентрации начинают проявляться первые симптомы отравления. Предельно допустимая норма употребления должна быть обязательно меньше этого значения. Смертельное отравление наступает при одновременном приёме 45-125 г.
Польза сульфата меди
Сульфат меди ценится во многих сферах деятельности. За счёт сильных антисептических свойств он способен подавлять развитие бактериальных инфекций различного генеза, может использоваться для лечения заболеваний полости рта (гингивит, стоматит, воспаление миндалин), а также гинекологических воспалений. Медный купорос эффективно уничтожает патогенов, применяются растворы, порошки и мази на основе этого вещества.
Медная соль серной кислоты необходима в промышленности. Её выгодно отличает высокая реакционная способность, малотоксичность, в связи с чем она может быть использована для обработки жилых помещений, воды и при непосредственной работе с металлическими изделиями. Из-за высокой гигроскопичности безводный порошок сульфата меди способен долгое время удерживать влагу и является компонентом увлажнителей воздуха.
Вред сульфата меди
Сернокислая медь безвредна при правильном применении. При контакте с ней важно соблюдать меры безопасности, не пренебрегать гигиеническими процедурами. В продуктах питания отечественного производства Е519 отсутствует, так что негативное влияние на человека через пищу исключено.
Медный купорос может быть токсичен для рыб, водных растений и беспозвоночных в высоких дозировках. Поэтому перед применением нужно ознакомиться с инструкцией и посоветоваться с ветеринаром.
При дезинфекции помещений вдыхание аэрозоля сульфата меди может привести к ожогу дыхательных путей и сильному отравлению.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Инструкция по применению
В медицине
Для антисептического спринцевания в 1 литре воды разводят 1 столовую ложку кристаллов медного купороса. Затем столовую ложку этого раствора смешивают с 500 мл кипячёной воды, Спринцевание проводят раз в неделю. В зависимости от желаемого результата и симптомов частота может быть иной.
При экземе и грибке используют мазь на основе сернокислой меди. В вазелине растворяют предварительно просеянные несколько раз через марлю кристаллы, затем наносят на поражённый участок кожи и втирают. Применяют по мере появления признаков заболевания.
Для профилактики онкологии средство принимают перорально. Готовят раствор сульфата меди, в котором на 500 мл добавляют щепотку порошка медного купороса, настаивают его и употребляют раз в неделю натощак.
При отравлениях принимают 15-50 мл 1%-го водного раствора сульфата меди однократно. Для промывания ожогов и гнойных ран следует использовать 5%-ый раствор сульфата меди.
Раствор сульфата меди
В садоводстве
Опрыскивание раствором лучше проводить ранним утром или вечером, когда солнечные лучи уже менее активны, чтобы предотвратить ожоги. В качестве антисептика раствор сульфата меди применяется по мере необходимости, дозирование вещества в растворе для различных культур отличается
| Растение | Доза |
| Яблоня, айва, груша. | 100 гр порошка на 10 литров воды. Расход раствора 5-7 литров. |
| Вишня, абрикос, слива, алыча, персик, черешня. | 50 гр порошка на 10 литров воды. Расход раствора 2-5 литров. |
| Ягодные кустарники (смородина, ежевика, малина, крыжовник). | 50 гр порошка на 10 литров воды. Расход раствора 1,5 л. |
| Томаты, картофель | 5-20 гр порошка на 10 литров воды. |
Для обеззараживания и заживления ран и трещин коры следует применять 1% раствор сульфата меди.
Чтобы улучшить всхожесть и выживаемость сеянцев семена перед посадкой предварительно замачивать на 15 минут в 0,1% растворе сульфата меди. Для дезинфекции корней и луковиц декоративных цветков их замачивают на 3 минуты в 1% растворе сернокислой меди.
Внекорневая подкормка проводится очень слабым раствором соединения. Для опрыскивания всех видов культурных растений используется концентрация 0,01% – 0,02% (1-2 гр на 10 литров). Корневое удобрение чаще всего представлено в сухом виде: 1 гр сульфата меди на 1 м 2 . Подкармливают весной, плодовые деревья и кустарники – до распускания листьев, томаты и картофель непосредственно перед посадкой.
На основе сульфата меди готовят бордоскую жидкость. Она продаётся в готовом виде, но можно приготовить её самостоятельно:
- 100 гр негашеной извести разводят в 5 литрах воды.
- В горячей воде растворяют 100 гр сульфата меди, заливают 5 литрами воды.
- Раствор сернокислой меди вливают в негашеную известь при постоянном перемешивании.
Жидкость имеет голубоватый цвет слабощелочную реакцию, обладает сильными фунгицидными и бактерицидными свойствами.
В других сферах
В строительстве для защиты древесины от гниения её обрабатывают 10% раствором сульфата меди. Для того чтобы уберечь воду в бассейне от цветения, нужно знать его объём в кубических метрах. На 1 м 3 добавляют 0,9 г сернокислой меди. Порядок действий при очистке воды:
- Смешать нужное количество медной соли серной кислоты с солью в соотношении 1к 3.
- Залить смесь 3-5 литрами чистой воды, размешать до растворения.
- Мелкими порциями заливают в бассейн вручную или с помощью циркуляторной системы.
- Оставляют настаиваться на сутки.
Процедуру проводят не чаще 1 раза в 2 недели.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Класс опасности и токсичности, хранение
Сульфат меди малотоксичен, относится к 3 классу опасности. При работе с ним следует соблюдать меры личной безопасности: работать в перчатках и маске. Готовый раствор не подлежит хранению, его нужно применять сразу.
Порошок сернокислой меди рекомендуется хранить в тщательно защищённом от влаги месте, при температуре не выше 40 °С, относительной влажности не более 75%, вдали от пищевых продуктов и других лекарств. Срок годности – 2 года.
Видео:Опыты по химии. Получение гидроксида меди (II) и изучение его свойствСкачать

Где купить и сколько стоит сульфат меди
Медный купорос продаётся в магазинах, специализирующихся на садоводстве. Упаковка 100 гр стоит от 65 рублей. Оптом его продают заводы-производители, цена за 1 кг – от 120 рублей. Сульфат меди продаётся в аптеках, стоимость его за упаковку 500 гр составляет 460-640 рублей.
Видео:Реакция сульфата меди и гексацианоферрата калияСкачать

Заключение
Сульфат меди – это неорганическая медная соль серной кислоты, которая обладает выраженными антисептическими, фунгицидными свойствами. Благодаря этому соединение применяется в медицине, ветеринарии, садоводстве, в строительстве и многих других сферах. Ранее сернокислая медь использовалась как пищевая добавка, но из-за горького вкуса утратила значимость.
🔥 Видео
Реакция сульфата меди CuSO4 с цинкомСкачать