Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
- Cпособы получения оксида серы (IV)
- Химические свойства оксида серы (IV)
- SO2 — кислотный оксид
- Взаимодействие с основными оксидами и щелочами
- SO2 — активный восстановитель
- SO2 — окислитель
- H2SO3 — сернистая кислота
- Сульфиты и гидросульфиты
- Гидролиз сульфитов
- Химические свойства сульфитов
- I. Не окислительно-восстановительные реакции
- II. Окислительно-восстановительные реакции
- Оксид серы (IV) SO2, сернистый газ
- Химические свойства сернистого газа
- Получение и применение сернистого газа
- 📹 Видео
Видео:Соединения серы. 9 класс.Скачать

Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
Например , взаимодействие меди с концентрированной серной кислотой:
Видео:Химия 9 класс (Урок№12 - Оксид серы (IV). Сернистая кислота и ее соли.)Скачать

Химические свойства оксида серы (IV)
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

SO2 — кислотный оксид
При растворении SO2 в воде происходит его частичное соединение с молекулами воды — об разуется слабая сернистая кислота.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Взаимодействие с основными оксидами и щелочами
Видео:Оксиды. Химические свойства. 8 класс.Скачать

SO2 — активный восстановитель
SO2 + СаО = CaSO3 сульфит кальция
SO2 + NaOH = NaHSO3 гидросульфит натрия
Диоксид серы окисляется в газовой фазе до SO3:
На свету легко окисляется хлором:
В водных растворах при окислении SO2 образуется серная кислота H2SO4:
Обесцвечивание окрашенных окислителей (КМпO4 и Вr2) — качественная реакция для распознавания SO2 (например, отличие его от СO2, СО, СН4 и многих других газов):
Видео:Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать

SO2 — окислитель
Продуктом восстановления SO2 чаще всего является свободная сера.
H2SO3 — сернистая кислота
В свободном состоянии не выделена. Очень непрочное соединение. Образуется при растворении SO2 в воде. Обладает свойствами слабой кислоты.
Сульфиты и гидросульфиты
2-х основная сернистая кислота образует при взаимодействии со щелочами 2 ряда солей: нормальные (средние) — сульфиты Mex(SO3)y и кислые — гидросульфиты Me(HSO3)x.
Сульфиты щелочных Me и аммония растворимы в воде. Сульфиты остальных Me нерастворимы в воде (или не существуют).
Гидросульфиты Me хорошо растворимы в Н2O, некоторые из них существуют только в растворе, например, Ca(HSO3)2.
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Гидролиз сульфитов
Водные растворы сульфитов вследствие гидролиза имеют щелочную среду (окрашивают лакмус в синий цвет).
Химические свойства сульфитов
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

I. Не окислительно-восстановительные реакции
1. Взаимодействие с сильными кислотами:
Оба типа солей разлагаются сильными кислотами, при этом слабая сернистая кислота вытесняется в виде SO2 и Н2O.
2. Термическое разложение сульфитов:
3. Нормальные сульфиты в водных растворах, содержащих избыток SO2, превращаются в гидросульфиты
Благодаря этой реакции нерастворимые в воде сульфиты превращаются в растворимые гидросульфиты
4. Ионно-обменные реакции с другими солями, приводящие к образованию нерастворимых сульфитов:
Видео:Серная кислота. Химические свойства. Реакции с металлами.Скачать

II. Окислительно-восстановительные реакции
I. Сульфиты как восстановители.
Сульфиты, подобно SO2, могут быть и восстановителями, и окислителями, поскольку атомы серы в анионах SO3 находятся в промежуточной С.О. +4
В водных растворах и сульфиты, и гидросульфиты легко окисляются до сульфатов. Примеры реакций:
Даже твердые сульфиты при хранении на воздухе медленно окисляются до сульфатов:
II. Сульфиты как окислители.
Эти реакции не столь многочисленны. При нагревании сухих сульфитов с такими активными восстановителями, как С, Mg, Al, Zn, они переходят в сульфиды:
III. Диспропорционирование сухих сульфитов.
При нагревании до высоких температур сульфиты медленно превращаются в смесь сульфатов и сульфидов:
Видео:Химические свойства металлов. 9 класс.Скачать

Оксид серы (IV) SO2, сернистый газ
Взаимодействуя с кислородом, сера образует два оксида:
- SO2 (IV) — сернистый газ (сернистый ангидрид, диоксид серы)
- SO3 (VI) — серный ангидрид
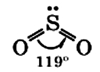
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
Физические свойства сернистого газа:
- бесцветный ядовитый газ с резким запахом;
- в 2 раза тяжелее воздуха;
- хорошо растворим в воде — при н.у. в 1 объеме воды растворяется 40 объемов SO2 (IV) с образованием сернистой кислоты.
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Химические свойства сернистого газа
Сернистый газ является типичным кислотным оксидом.
- сернистый газ реагирует с основаниями с образованием гидросульфитов (кислые соли) и сульфитов (средние соли):
- реакции сернистого газа с основными оксидами:
- с водой образует сернистую кислоту, которая существует только в растворе и относится к двухосновным кислотам:
Ступенчатая диссоциация сернистой кислоты с образованием гидросульфит-иона на первой ступени диссоциации, и сульфит-иона — на второй:
- пример реакции сернистой кислоты в качестве восстановителя:
- пример реакции сернистой кислоты в качестве окислителя:
Сернистая кислота может образовывать средние соли (сульфиты) — Na2SO3, и кислые соли (гидросульфиты) — NaHSO3.
В окислительно-восстановительных реакциях сернистый газ может выступать, как в роли окислителя (восстанавливаясь в S и H2S), так и в роли восстановителя (окисляясь в H2SO4), т.к. сера в этом соединении занимает промежуточную степень окисления +4.
- в реакции с сероводородом сернистый газ является окислителем:
- в реакции с кислородом при нагревании сернистый газ является восстановителем:
Видео:Серная кислота и ее соли. 9 класс.Скачать

Получение и применение сернистого газа
В промышленности сернистый газ получают или сжиганием серы, или как побочный продукт обжига сульфидных руд, например, железного колчедана.
В лабораторных условиях диоксид серы можно получить действием концентрированных кислот на соли сернистой кислоты (гидросульфиты и сульфиты), а также в процессе реакции серной кислоты с тяжелым металлом.
Сернистый газ используют для:
- получения оксида серы (VI);
- получения серной кислоты;
- получения сульфитов и гидросульфитов;
- отбеливания тканей в текстильной промышленности;
- уничтожения вредных микроорганизмов в качестве дезинфицирующего средства при консервировании продуктов питания.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
📹 Видео
Химические свойства ОСНОВАНИЙ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием основанийСкачать

Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

8 класс. Основания.Химические свойства оснований.Скачать

Химия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать

Этот Металл ВЕДЕТ СЕБЯ ОЧЕНЬ СТРАННО!Скачать

Водород/химические свойства водорода/8 классСкачать

Сера: химические свойства, аллотропия и её соединения #сера #химшкола #неметаллы #егэхимияСкачать