Ртуть — элемент побочной подгруппы второй группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80. Обозначается символом Hg (лат. Hydrargyrum). Простое вещество ртуть — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты.
Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии
Исходя из электронного строения, можно сделать вывод, что для в соединениях ртуть будет проявлять степени окисления +2 и +1.
Физические свойства ртути:
- при комнатной температуре — сербристо-серая жидкость , легко переходящая в газообразное состояние ;
- электро- и теплопроводна;
- очень высокая плотность вещества;
Как видите, все вышеперечисленные свойства — характеристики металлического вещества, хотя и в жидком состоянии.
Химические свойства ртути:
1) Реакция с кислородом (при нагревании >300 ° С): 2Hg + O2 = 2HgO (красного цвета);
2) реагирует с водородом, но только с атомарным ( так же при нагревании): Hg + 2H = HgH2 — гидрид ртути;
3) C неметаллами ( при нагревании): Hg + S = HgS
4) Взаимодействие с кислотами: с кислотами-не окислителями не взаимодействует
В ряду активности металлов ртуть стоит после водорода, поэтому в реакциях с кислотами-окислителями водород не выделяется:
Как видно из реакции, чаще всего в соединениях ртуть проявляет степень окисления + 2, но +1 тоже встречается, причем в очень необычном виде:
Степень окисления
Соединения ртути
+1
Оксид — не выделен;
Гидроксид — не выделен
Катион ртути — Hg2 2+ , соответственно, соль — нитрат ртути (I) — Hg2(NO3)2
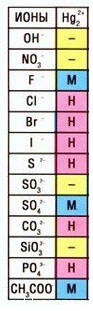
Кстати, таких соединений ртути (I) немало — смотрите таблицу растворимости:
+2
Оксид — HgO (относят к слабым основным или даже амфотерным оксидам);Гидроксид — не выделен
Что касается соединений ртути (II), то не смотря на то, что простое вещество ртуть — металл, в веществах HgS (черные или красные кристаллы) и HgJ2 (желтые кристаллы) cвязь ковалентная.
Связь ртуть-углерод в органических соединениях ртути самая прочная из всех известных металл-органических связей
Соединения ртути чрезвычайно ядовиты, соответственно, как и большинство других ядов, их часто используют в медицине:
- хлорид ртути (I) (каломель) — слабительное;
- меркузал и промеран — сильные мочегонные;
- хлорид ртути (II), цианид ртути (II), амидохлорид ртути и жёлтый оксид ртути(II) — антисептики (в том числе в составе мазей).
- Амальгаму серебра применяют в стоматологии в качестве материала зубных пломб.
Видео:Ртуть - Самый ПОДВИЖНЫЙ Металл на Земле!Скачать

Ртуть (Hg)
Ртуть для очистки золота использовали еще древние греки и римляне. Чистую ртуть впервые в 1735 году выделил швед Георг Брандт, ее принадлежность к металлам была доказана М. В. Ломоносовым в 1759 году, когда российский ученый совместно с Брауном заморозил ртуть и установил ее металлические свойства.
Ртуть является единственным металлом, который находится в жидком состоянии при нормальных условиях.
Ртуть относится к группе редкоземельных металлов (содержание ртути в земной коре 7·10 -6 %), однако, несмотря на это, ртутные руды бывают достаточно концентрированными (до 2,5%) по причине слабого связывания этого металла с другими элементами. 99,98% всей природной ртути находится в рассеянной форме, и только 0,02% — в месторождениях. Современная наука знает порядка 30 ртутьсодержащих минералов, основным из которых является кноварь HgS.
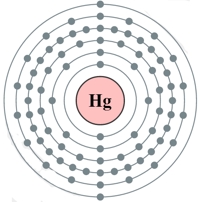
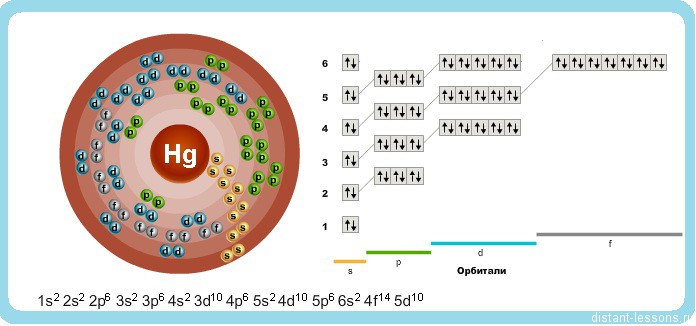
Рис. Строение атома ртути.
Электронная конфигурация атома ртути — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 2 (см. Электронная структура атомов). Как и у цинка, предпоследний электронный слой атома ртути полностью заполнен, а на внешнем слое находится два s-электрона. Однако, в отличие от цинка, ртуть в соединениях может проявлять степень окисления не только +2, но и +1.
| II | I |
| HgO | Hg2O |
| HgCl2 | Hg2Cl2 |
| Hg(NO2)2 | Hg2(NO2)2 |
Ртуть является чрезвычайно токсичным веществом, может вызывать сильное отравление, поскольку, попадая внутрь организма человека вызывает агглютинацию эритроцитов и ингибирование ферментов, что объясняется реагированием ртути с сульфидными группами -SH, которые входят в состав различных белков, аминокислот и ферментов.
Физические свойства ртути:
- при н. у. жидкий металл серебристо-серого цвета;
- диамагнетик;
- со многими металлами образует сплавы, называемые амальгамой.
Химические свойства ртути:
- реагирует с простыми веществами: кислородом, серой, селеном, теллуром, галогенами: 2Hg + O2 = 2HgO; Hg + S = HgS;
- не взаимодействует с N2, P2, Si2, C2;
- реагирует при нагревании с «царской водкой», азотной, концентрированной серной кислотой, образуя нитрат ртути (II):
Hg + 4HNO3(кнц.) = Hg(NO3)2 + 2NO2 + 2H2O; - без нагревания реагирует с азотной кислотой, образуя нитрат ртути (I): 6Hg + 8HNO3(рзб.) = 3Hg2(NO3)2 + 2NO + 4H2O;
- не реагирует со щелочами, разбавленной серной и хлористоводородной кислотами.
Получение ртути:
- чистую ртуть получают электрохимическим рафинированием;
- промышленным способом ртуть получают обжигом руды HgS при высокой температуре (700°C): HgS + O2 = Hg + SO2.
Применение ртути:
- в барометрах, манометрах, термометрах, вакуумных насосах и проч.;
- в ртутных лампах, выпрямителях, переключателях;
- для амальгамации серебра и золота в металлургических процессах;
- в качестве жидкого катода при производстве едких щелочей;
- как катализатор в реакциях синтеза уксусной кислоты;
- как компонент краски морских судов;
- в качестве протравителя семян и гербицида в сельском хозяйстве.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Видео:РТУТЬ, ОСТОРОЖНО!Скачать

Ртуть
(молярная масса)
(первый электрон)
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Содержание
- 1 История
- 1.1 Происхождение названия
- 2 Нахождение в природе
- 2.1 Месторождения
- 3 В окружающей среде
- 4 Изотопы
- 5 Получение
- 6 Физические свойства
- 7 Химические свойства
- 7.1 Характерные степени окисления
- 7.2 Свойства металлической ртути
- 8 Применение ртути и её соединений
- 8.1 Медицина
- 8.2 Техника
- 8.3 Металлургия
- 8.4 Химическая промышленность
- 8.5 Сельское хозяйство
- 9 Токсикология ртути
- 9.1 Гигиеническое нормирование концентраций ртути
- 9.2 Демеркуризация
- 9.3 Запрет использования содержащей ртуть продукции
Видео:🔥 Эксперименты со РТУТЬЮ. Как оживить ртуть и получить из нее ЗОЛОТО.Скачать

История
Ртуть известна с древних времён. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом природной киновари. Древние греки и римляне использовали ртуть для очистки золота (амальгамирование), знали о токсичности самой ртути и её соединений, в частности сулемы. Много веков алхимики считали ртуть главной составной частью всех металлов и полагали, что если жидкой ртути возвратить твёрдость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 году. Для представления элемента как у алхимиков, так и в настоящее время используется символ планеты Меркурий. Но принадлежность ртути к металлам была доказана только трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства в твёрдом состоянии: ковкость, электропроводность и др.
Происхождение названия
Русское название ртути происходит от праслав. *rьtǫtь , связанного с лит. rìsti «катиться». Символ Hg заимствован от латинского алхимического названия этого элемента hydrargyrum (от др.-греч. ὕδωρ «вода» и ἄργυρος «серебро»).
Видео:УРАНОВЫЙ ЛОМ В РТУТИ / классика и оригиналСкачать

Нахождение в природе
Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В обычных условиях киноварь и металлическая ртуть не растворимы в воде, но в присутствии некоторых веществ (Fe2(SO4)3, озон, пероксид водорода) растворимость в воде этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах щелочных металлов с образованием, например, комплекса HgS•nNa2S. Ртуть легко сорбируется глинами, гидроксидами железа и марганца, глинистыми сланцами и углями.
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg4Cl.
Месторождения
Ртуть считается редким металлом.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен), Донбассе (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
Видео:8 класс. Составление уравнений химических реакций.Скачать

В окружающей среде
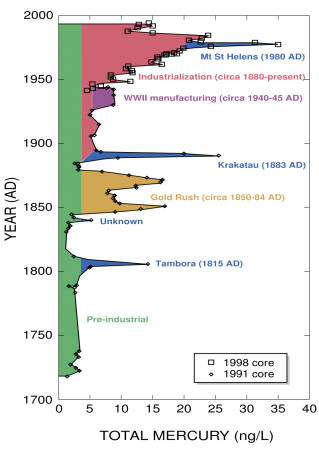
До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограммов на 1 кубический дециметр льда. Природные источники, такие, как вулканы, составляют примерно половину всех выбросов атмосферной ртути. Причиной появления остальной половины является деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля (главным образом в тепловых электростанциях) — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6,8 %, производство цемента — 6,4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1,4 %, ртути (в основном для батареек) — 1,1 %, остальное — 2 %.
Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Изотопы
Природная ртуть состоит из смеси 7 стабильных изотопов: 196 Hg (распространённость 0,155 %), 198 Hg (10,04 %), 199 Hg (16,94 %), 200 Hg (23,14 %), 201 Hg (13,17 %), 202 Hg (29,74 %), 204 Hg (6,82 %). Искусственным путём получены радиоактивные изотопы ртути с массовыми числами 171—210.
Видео:Чем не угодила ртуть правителям землиСкачать

Получение
Ртуть получают обжигом киновари (сульфида ртути II) или металлотермическим методом:
HgS + O2 ⟶ Hg + SO2↑ HgS + Fe ⟶ FeS↓ + Hg
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
На протяжении многих столетий в Европе основным и единственным месторождением ртути был Альмаден в Испании. В Новое время с ним стала конкурировать Идрия во владениях Габсбургов (современная Словения). Там же появилась первая лечебница для поражённых отравлением парами ртути рудокопов. В 2012 г. ЮНЕСКО объявило промышленную инфраструктуру Альмадена и Идрии памятником Всемирного наследия человечества.
В надписях во дворце древнеперсидских царей Ахеменидов (VI—IV века до н. э.) в Сузах упоминается, что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в качестве краски.
🔍 Видео
ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

42. d-металлы. Медь, серебро, золота, цинк, кадмий, ртуть.Скачать

ГАЛЛИЙ и РТУТЬ. Металл-хищник, но у него есть сердце.Скачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Химические свойства алканов. 1 часть. 10 класс.Скачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Проклятая химическая реакция 😜 #shortsСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

РТУТЬ - почему её ЗАПРЕТИЛИ ? 5 фактов о которых молчит наукаСкачать

Химические свойства металлов. 9 класс.Скачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Реакция НИТРАТА РТУТИ и ЭТИЛОВОГО СПИРТА. ФУЛЬМИНАТ РТУТИ. Опыты по химии. Домашние экспериментыСкачать