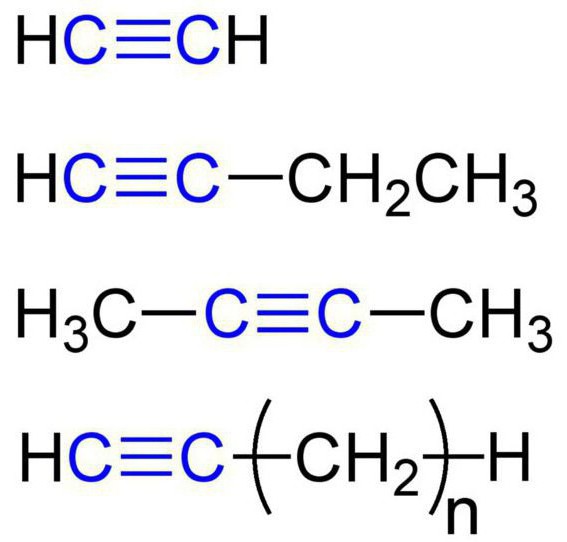Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
- Химические свойства алкинов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкинов
- 1.3. Гидрогалогенирование алкинов
- 1.4. Гидратация алкинов
- 1.5. Димеризация, тримеризация и полимеризация
- 2. Окисление алкинов
- 2.1. Горение алкинов
- 2.2. Окисление алкинов сильными окислителями
- 3. Кислотные свойства алкинов
- Химические свойства алкинов. Строение, получение, применение
- Что это такое?
- Физические свойства алкинов
- Химические свойства алкинов
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Гидратация
- Горение
- Другие реакции
- Получение
- Применение алкинов
- Заключение
- Алкины
- 🔥 Видео
Видео:7 ВАЖНЕЙШИХ РЕАКЦИЙ, которые тебе нужно знать (Алкины)Скачать

Химические свойства алкинов
Алкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов. Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле.
Для алкинов характерны реакции окисления. Окисление алкенов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение).
Видео:Составление уравнений реакций горения. 11 класс.Скачать

1. Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С ≡ С и связи С–Н:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С – С | 348 | 0,154 |
| С ≡ С | 814 | 0,120 |
| С – Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С , поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С ≡ С с разрывом π-связей.
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
| Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан. |
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
| Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1. |
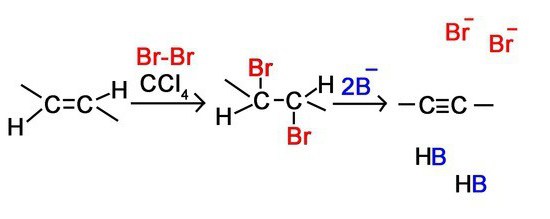
1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь. |
| Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан. |
Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
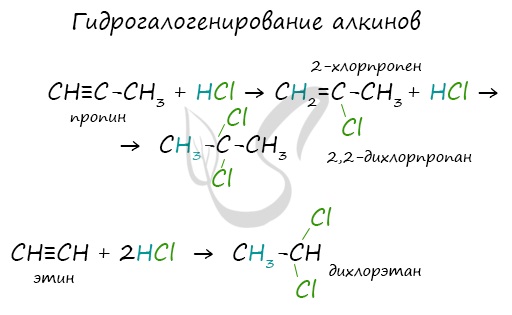
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
| Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан. |
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен. |
1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
| Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид. |
Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
| Например, при гидратации пропина образуется пропанон (ацентон). |
1.5. Димеризация, тримеризация и полимеризация
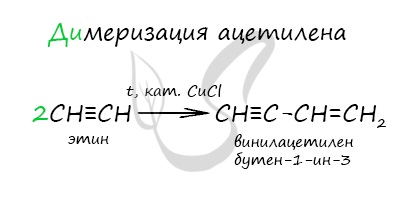
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:
Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):
Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации ацетилена образуется полимер линейного или циклического строения. |
… –CH=CH–CH=CH–CH=CH–…
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

2. Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
Уравнение сгорания алкинов в общем виде:
| Например, уравнение сгорания пропина: |
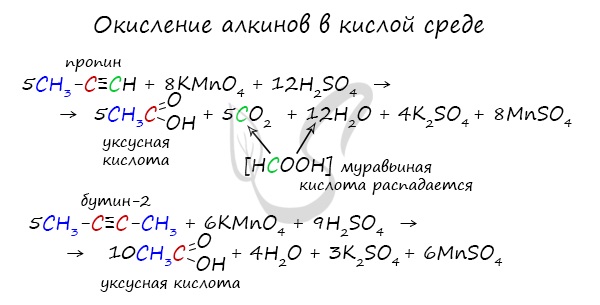
2.2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C ≡ | R-COOH | -COOMe |
| CH ≡ | CO2 | Me2CO3 (MeHCO3) |
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C ≡ , поэтому образуется уксусная кислота:
При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:
При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
| Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C ≡ , поэтому образуется соль уксусной кислоты – ацетат калия |
Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:
Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

3. Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp 2 и sp 3 -гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
| Гибридизация: | sp | sp 2 | sp 3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н + , т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
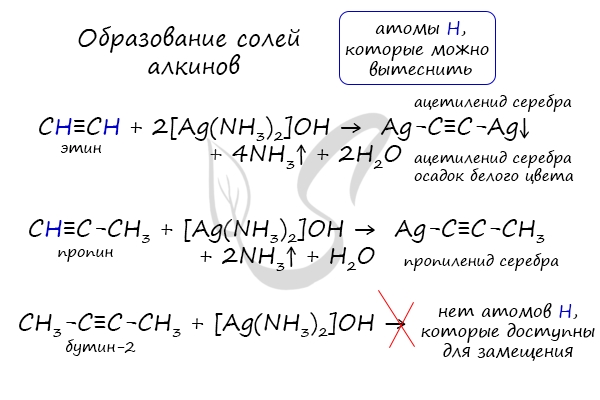
| Ацетилен и его гомологи с тройной связью на конце молекулы R–C ≡ C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов. |
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
| Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия. |
| Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия. |
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):
| Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра или аммиачным раствором хлорида меди (I) с образованием белого или красно-коричневого осадка соответственно. Это качественная реакция на алкины с тройной связью на конце молекулы. |
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические свойства алкинов. Строение, получение, применение
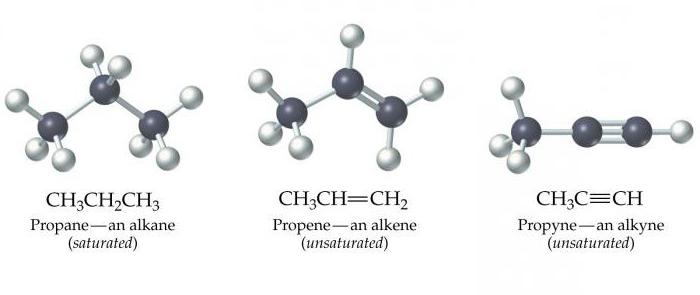
Алканы, алкены, алкины — это органические химические вещества. Все они построены из таких химических элементов, как карбон и гидроген. Алканы, алкены, алкины — это химические соединения, которые принадлежат к группе углеводородов.
В этой статье мы рассмотрим алкины.
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Что это такое?
Эти вещества еще называются ацетиленовыми углеводородами. Строение алкинов предусматривает наличие в их молекулах атомов карбона и гидрогена. Общая формула ацетиленовых углеводородов такая: CnH2n-2. Самым простый простой алкин — этин (ацетилен). Он обладает вот такой химической формулой — С2Н2. Также к алкинам относится пропин с формулой С3Н4. Кроме того, к ацетиленовым углеводородам можно отнести бутин (С4Н6), пентин (С5Н8), гексин (С6Н10), гептин (С7Н12), октин (С8Н14), нонин (С9Н16), децин (С10Н18) и т. д. Все виды алкинов обладают похожими характеристиками. Давайте рассмотрим их подробнее.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Физические свойства алкинов
По своим физическим характеристикам ацетиленовые углеводороды напоминают алкены.
В нормальных условиях алкины, в молекулах которых содержится от двух до четырех атомов карбона, обладают газообразным агрегатным состоянием. Те, в молекулах которых находится от пяти до 16 атомов карбона, при нормальных условиях жидкости. Те, в составе молекул которых от 17 и больше атомов этого химического элемента, — твердые вещества.
Плавятся и кипят алкины при более высокой температуре, чем алканы и алкены.
Растворимость в воде незначительная, но немного выше, чем у алкенов и алканов.
Наиболее широко используемый алкин — ацетилен — обладает такими физическими свойствами:
- не имеет цвета;
- не имеет запаха;
- при нормальных условиях находится в газообразном агрегатном состоянии;
- обладает меньшей плотностью, чем воздух;
- температура кипения — минус 83,6 градусов Цельсия;
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химические свойства алкинов
В этих веществах атомы связаны тройной связью, чем и объясняются основные их свойства. Алкины вступают в реакции такого типа:
- гидрирование;
- гидрогалогенирование;
- галогенирование;
- гидратация;
- горение.
Давайте рассмотрим их по порядку.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Гидрирование
Химические свойства алкинов позволяют им вступать в реакции такого типа. Это вид химического взаимодействия, при котором молекула вещества присоединяет к себе дополнительные атомы водорода. Вот пример такой химической реакции в случае с пропином:
Эта реакция происходит в две стадии. На первой молекула пропина присоединяет два атома гидрогена и на второй — столько же.
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

Галогенирование
Это еще одна реакция, которая входит в химические свойства алкинов. В ее результате молекула ацетиленового углеводорода присоединяет атомы галогенов. К последним относятся такие элементы, как хлор, бром, иод и др.
Вот пример такой реакции в случае с этином:
Такой же процесс возможен и с другими ацетиленовыми углеводородами.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Гидрогалогенирование
Это также одна из основных реакций, которая входит в химические свойства алкинов. Она заключается в том, что вещество взаимодействует с такими соединениями, как НСІ, НІ, HBr и др. Это химическое взаимодействие происходит в две стадии. Давайте рассмотрим реакцию такого типа на примере с этином:
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Гидратация
Это химическая реакция, которая заключается во взаимодействии с водой. Она тоже происходит в два этапа. Давайте рассмотрим ее на примере с этином:
Вещество, которое образуется после первого этапа реакции, называется виниловым спиртом.
В связи с тем, что согласно правилу Эльтекова функциональная группа ОН не может располагаться рядом с двойной связью, происходит перегруппировка атомов, в результате которой из винилового спирта образуется ацетальдегид.
Процесс гидратации алкинов еще называется реакцией Кучерова.
Видео:Химические свойства алкиновСкачать

Горение
Это процесс взаимодействия алкинов с кислородом при высокой температуре. Рассмотрим горение веществ этой группы на примере с ацетиленом:
При избытке кислорода ацетилен и другие алкины горят без образования карбона. При этом выделяются только оксид карбона и вода. Вот уравнение такой реакции на примере с пропином:
Горение других ацетиленовых углеводородов также происходит подобным образом. В результате выделяется вода и углекислый газ.
Видео:65. Что такое реакция гидратации и реакция дегидратацииСкачать

Другие реакции
Также ацетилены способны реагировать с солями таких металлов, как серебро, медь, кальций. При этом происходит замещение гидрогена атомами металла. Рассмотрим такой вид реакции на примере с ацетиленом и нитратом серебра:
Еще один интересный процесс с участием алкинов — реакция Зелинского. Это образование бензола из ацетилена при его нагревании до 600 градусов по Цельсию в присутствии активированного угля. Уравнение этой реакции можно выразить таким образом:
Также возможна полимеризация алкинов — процесс объединения нескольких молекул вещества в одну полимерную.
Видео:Химия с нуля — Химические свойства АлкеновСкачать

Получение
Алкины, реакции с которыми мы рассмотрели выше, получают в лаборатории несколькими методами.
Первый — это дегидрогалогенирование. Выглядит уравнение реакции таким образом:
Для проведения такого процесса необходимо нагреть реагенты, а также добавить этанол в качестве катализатора.
Также есть возможность получения алкинов из неорганических соединений. Вот пример:
Следующий метод получения алкинов — дегидрирование. Вот пример такой реакции:
С помощью реакции подобного типа можно получить не только этин, но и другие ацетиленовые углеводороды.
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

Применение алкинов
Наибольшее распространение в промышленности получил самый простой алкин — этин. Он широко используется в химической отрасли.
- Нужен ацетилен и другие алкины для получения из них других органических соединений, таких как кетоны, альдегиды, растворители и др.
- Также из алкинов можно получить вещества, которые используются при производстве каучуков, поливинилхлорида и др.
- Из пропина можно получить ацетон в результате ракции Кучерова.
- Кроме того, ацетилен используется при получении таких химических веществ, как уксусная кислота, ароматические углеводороды, этиловый спирт.
- Еще ацетилен применяется в качестве топлива с очень высокой теплотой горения.
- Также реакция горения этина используется для сваривания металлов.
- Кроме того, с использованием ацетилена можно получить технический карбон.
- Также это вещество применяется в автономных светильниках.
- Ацетилен и ряд других углеводородов этой группы используются в качестве ракетного топлива благодаря своей высокой теплоте горения.
На этом применение алкинов заканчивается.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Заключение
В качестве завершающей части приводим краткую таблицу о свойствах ацетиленовых углеводородов и их получении.
| Название реакции | Пояснения | Пример уравнения |
| Галогенирование | Реакция присоединения молекулой ацетиленового углеводорода атомов галогенов (брома, иода, хлора и др.) | C4H6 + 2I2 = С4Н6І2 |
| Гидрирование | Реакция присоединения молекулой алкина атомов водорода. Происходит в две стадии. | |
| Гидрогалогенирование | Реакция присоединения молекулой ацетиленового углеводорода гидрогалогенов (НІ, НСІ, HBr). Происходит в две стадии. | |
| Гидратация | Реакция, в основе которой лежит взаимодействие с водой. Происходит в две стадии. | |
| Полное окисление (горение) | Взаимодействие ацетиленовго углеводорода с кислородом при повышенной температуре. В результате образуется оксид карбона и вода. | |
| Реакции с солями металлов | Заключаются в том, что атомы металлов замещают атомы гидрогена в молекулах ацетиленовых углеводородов. |