пропилен или пропен при комнатной температуре и при атмосферном давлении находится в газообразном состоянии и, как и другие алкены, бесцветен. Он имеет запах, похожий на масло, но менее интенсивный. Он имеет дипольный момент, поскольку, хотя ему не хватает сильной полярной связи, его молекула асимметрична.
Также пропилен является структурным изомером циклопропана (они имеют одинаковую химическую формулу C)3H6). Это происходит в природе как следствие процессов вегетации и брожения. Искусственно встречается при переработке ископаемых видов топлива, таких как нефть, природный газ и, в меньшей степени, углерод.
Аналогичным образом, этилен и пропилен являются продуктами переработки нефти в процессе расщепления больших углеводородных молекул с образованием небольших углеводородов, пользующихся высоким спросом..
Пропилен также может быть получен с использованием различных методологий:
— Реагирует обратимо на этилен и бутен, где двойные связи разрываются и переформулируются для получения пропилена.
— Через процесс дегидрирования (потери водорода) пропана.
— В рамках программы по производству олефинов из метанола (МТО), пропилен был произведен из метанола. Это было пропущено через цеолитный катализатор, который способствует его дегидратации и приводит к образованию этилена и пропилена..
- 1 Химическая структура
- 2 свойства
- 2.1 Молекулярный вес
- 2.2 Точка кипения
- 2.3 Точка плавления
- 2.4 Температура вспышки
- 2.5 Растворимость
- 2.6 Растворимость, выраженная как масса
- 2.7 Плотность
- 2.8 Плотность пара
- 2.9 Давление пара
- 2.10 Самовоспламенение
- 2.11 Вязкость
- 2.12 Теплота сгорания
- 2.13 Тепло испарения
- 2.14 Поверхностное натяжение
- 2.15 Полимеризация
- 2.16 Точка замерзания
- 2.17 Порог запаха
- 3 использования
- 3.1 Полипропилен
- 3.2 Акрилонитрил
- 3.3 Пропиленоксид
- 3.4 Для синтеза спиртов и других целей
- 4 Ссылки
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

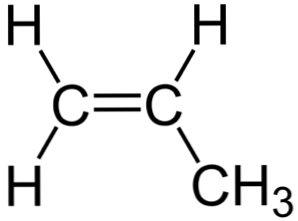
Химическая структура
На изображении выше видна химическая структура пропилена, в которой выделяется его асимметрия (правая сторона отличается от левой). Его углеродный скелет, не считая атомов H, можно наблюдать как бумеранг.
Этот бумеранг представляет ненасыщенность или двойную связь на одной из его сторон (C1) и, следовательно, он плоский из-за sp-гибридизации 2 атомов углерода.
Однако другая сторона занята метильной группой (-CH3), чья гибридизация является sp 3 и он имеет тетраэдрическую геометрию. Таким образом, если смотреть спереди, бумеранг плоский с атомами H, выступающими из этого на 109,5º приблизительно.
В газовой фазе молекула слабо взаимодействует с другими силами дисперсии. Кроме того, метильная группа предотвращает взаимодействие между двойными связями (π-π) двух молекул пропилена..
Это приводит к уменьшению их межмолекулярных сил, что отражается на их физических свойствах. Только при очень низких температурах пропилен может принять твердую структуру, в которой бумеран остается сгруппированным со своими слабыми взаимодействиями.
Видео:Химия с нуля — Химические свойства АлкеновСкачать

свойства
Это бесцветный газ с ароматическим запахом. Он транспортируется в виде сжиженного газа и, когда он выходит из контейнеров, в которых он находится, он делает это в форме газа или жидкости. При низких концентрациях он образует взрывоопасную и легковоспламеняющуюся смесь с воздухом, плотность пропилена выше, чем у воздуха.
Видео:Уравнивание реакций горения углеводородовСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Химические свойства пропилена уравнения реакцийПолучение пропилена в лаборатории Получение пропилена в промышенности Пропилен (пропен) Н3С—СН==СН2 относится к углеводородам ряда этилена (алкены или олефины). Алкены, или олефины (от лат. olefiant — масло — старое название, но широко используемое в химической литературе. Поводом к такому названию послужил хлористый этилен, полученный в XVIII столетии, — жидкое маслянист вещество.) — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь. Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными. Алкены образуют гомологический ряд с общей формулой CnH2n. Непредельный (алкеновый) радикал называют тривиальным названием или по систематической номенклатуре: Н2С==CН—СН2 — аллил (пропенил-2) Пропилен служит сырьем для получения изопропилбензола, ацетона, фенола, полипропилена, глицерина, изопропилового спирта, синтетического каучука и других ценных органических продуктов. Пропилен представляет из себя газообразное вещество с низкой температурой кипения t кип=-47,7 °С и температурой плавления t пл= -187,6 °С, оптическая плотность d204=0,5193. Пропен обладает значительной реакционной способностью. Его химические свойства определяются, главным образом, двойной углерод-углеродной связью. p-связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента.Все реакции присоединения протекают по двойной связи и состоят в расщеплении Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения. Присоединение галогенов (галогенирование): Реакцию галогенирования обычно проводят в растворителе при обычной температуре. Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных. Легче идет присоединение хлора и брома, труднее — иода. Фтор взаимодействует со взрывом. Присоединение водорода (реакция гидрирования): Присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), пропен переходит в предельный углеводород — пропан. Присоединение воды (реакция гидратации): Присоединение галогеноводородов (HHal) и воды происходит по правилу В.В.Марковникова (1869). Водород кислоты Hhal присоединяется к наиболее гидрированному атому углерода при двойной связи. Соответственно остаток Hal связывается с атомом С, при котором находится меньшее число атомов водорода. Горение на воздухе. При поджигании горит на воздухе: 2СН2=СНСН3 + 9О2 С кислородом воздуха газообразные пропилен образует взрывчатые смеси. Пропилен окисляется перманганатом калия в водной среде, что сопровождается обесцвечиванием раствора KMnO4 и образованием гликолей (соединений с двумя гидроксильными группами при соседних атомах С). Окисление кислородом воздуха в пропиленоксид при нагревании в присутствии серебряных катализаторов: Полимеризация– связывание множества молекул пропилена друг с другом. Условия реакции: нагревание, присутствие катализаторов. Соединение молекул происходит путем расщепления внутримолекулярных Получение пропилена в лаборатории Из лабораторных способов получения пропилена можно отметить следующие: 1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи: H2C—CH2 – CH3 = H2C==CH2– CH3 + KCl + H2O | | 2. Гидрирование пропина в присутствии катализатора (Pd): H—C≡C— CH3 + H2 = H2C==CH— CH3 3. Дегидратация пропилового спирта (отщепление воды). В качестве катализатора используют кислоты (серную или фосфорную) или А12O3: Н2С—СН2 — CH3 = Н2С==СН — CH3 + Н2О | | 4. Отщепление двух атомов галогена от дигалогеноалканов, содержащих галогены при соседних атомах С. Реакция протекает под действием металлов (Zn и др.): Получение пропилена в промышенности В природе алкены встречаются редко. Обычно пропилен выделяют из газов нефтепереработки (при крекинге сырой нефти в кипящем слое (процесс фирмы BASF), пиролизе бензиновых фракций) или попутных газов, а также из газов коксования угля. Существует несколько видов пиролиза пропилена: пиролиз в трубчатых печах, пиролиз в реакторе с кварцевым теплоносителем (процесс фирмы Phillips Petroleum Co.), пиролиз в реакторе с коксовым теплоносителем (процесс фирмы Farbewerke Hoechst), пиролиз в реакторе с песком в качестве теплоносителя (процесс фирмы Lurgi), пиролиз в трубчатой печи (процесс фирмы Kellogg), процесс Лавровского — Бродского, автотермический пиролиз по Бартоломе. В промышленности пропилен получают также дегидрированием алканов в присутствии катализатора (Сr2О3, Аl2О3). Промышленным способом получения пропилена наряду с крекингом служит дегидратация пропанола над оксидом алюминия: Пропилен находит свое применение в промышленном синтезе. Полипропилен. Производство полипропилена в промышленности началось в 1954 году благодаря работам Натты, который использовал для полимеризации пропилена каталитическую систему Циглера. Натта впервые получил стереорегулярный полимер, названный им изотактическим; в нем все метильные группы расположены по одну сторону цепи, что способствует благоприятной «упаковке» полимерных молекул и определяет хорошие механические свойства полипропилена: 🎦 ВидеоСоставление уравнений реакций горения. 11 класс.Скачать  ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  Как написать уравнения реакции полимеризации?Скачать  Реакция полимеризации. 9 класс.Скачать  Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать  Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать  29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать  8 класс. Составление уравнений химических реакций.Скачать  Органика. Учимся составлять и читать химические уравнения в органической химии.Скачать  ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать  КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать  Физические и химические свойства алкенов. 1 часть. 10 класс.Скачать  ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать  Правило Марковникова В.В. в реакциях присоединения у алкЕнов и алкИнов.Скачать  ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать  |


 -связи алкена и образовании на месте разрыва двух новых
-связи алкена и образовании на месте разрыва двух новых  -связей.
-связей.



 6СО2 + 6Н2О.
6СО2 + 6Н2О.



