Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
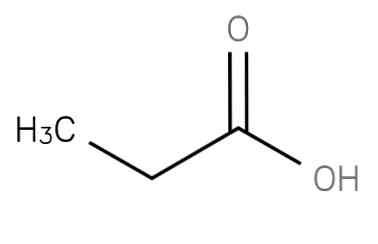
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание Видео:Химические свойства кислот. 7 класс.Скачать  Формула пропановой кислоты, свойства, риски и использованиепропановая кислота представляет собой насыщенную жирную кислоту с короткой цепью, содержащую этан, связанный с атомом углерода карбоксигруппы. Его формула CH3-СН2-COOH. Анион CH3CH2COO-, а также соли и эфиры пропановой кислоты известны как пропионаты (или пропаноаты).. Он может быть получен из отходов древесной массы в процессе ферментации с использованием бактерий рода Propionibacterium. Его также получают из этанола и оксида углерода с использованием катализатора на основе трифторида бора (O’Neil, 2001).. Другим способом получения пропановой кислоты является окисление пропиональдегида в присутствии ионов кобальта или марганца. Эта реакция быстро развивается при температурах до 40-50 ° C: Это соединение естественно присутствует в молочных продуктах на низких уровнях и производится в общем виде вместе с другими короткоцепочечными жирными кислотами в желудочно-кишечном тракте человека и других млекопитающих как конечный продукт микробного переваривания углеводов.. Обладает значительной физиологической активностью у животных (База данных метаболома человека, 2017).
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать  Физико-химические свойстваПропановая кислота представляет собой бесцветную и маслянистую жидкость с резким, неприятным и прогорклым запахом. Его внешний вид показан на рисунке 2 (Национальный центр биотехнологической информации, 2017). Пропановая кислота имеет молекулярную массу 74,08 г / моль и плотность 0,992 г / мл. Температура замерзания и кипения составляет -20,5 ° C и 141,1 ° C соответственно. Пропановая кислота представляет собой слабую кислоту, чья рКа составляет 4,88. Соединение очень хорошо растворяется в воде, способно растворять 34,97 грамма соединения на 100 мл растворителя. Он также растворим в этаноле, эфире и хлороформе (Royal Society of Chemistry, 2015). Пропановая кислота имеет промежуточные физические свойства между свойствами более мелких карбоновых кислот, муравьиной и уксусной кислот и более крупных жирных кислот.. Он показывает общие свойства карбоновых кислот и может образовывать производные амидов, сложных эфиров, ангидридов и хлоридов. Он может подвергаться альфа-галогенированию с бромом в присутствии PBr3 в качестве катализатора (реакция HVZ) с образованием CH3CHBrCOOH. Видео:Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать  Реактивность и опасностиПропановая кислота является легковоспламеняющимся и горючим материалом. Он может воспламениться от жары, искр или пламени. Пары могут образовывать взрывоопасные смеси с воздухом, способные перемещаться к источнику воспламенения и взрываться. Большинство паров тяжелее воздуха. Они будут распространяться по земле и будут собираться в низких или ограниченных областях (канализация, подвалы, резервуары). Опасность взрыва пара в помещении, на улице или в канализации. Вещества, обозначенные (P), могут полимеризоваться взрывоопасно при нагревании или в огне. Контейнеры могут взорваться при нагревании (PROPIONIC ACID, 2016). Смесь следует хранить вдали от источников тепла и источников возгорания. При нагревании до разложения выделяет едкий дым и раздражающие пары. Пропановая кислота раздражает кожу, глаза, нос и горло, но не оказывает острого системного действия и не обладает явным генотоксическим потенциалом. При попадании на кожу следует промыть их большим количеством воды (паспорт безопасности материала Пропионовая кислота, 2013). Видео:Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать  биохимияОснование конъюгата пропановой кислоты, пропионат, образуется в качестве концевого фрагмента из трех атомов углерода (активированного коэнзимом А в виде пропионил-КоА) при окислении нечетных углеродных жирных кислот и окислении боковой цепи холестерин. Эксперименты с радиоактивными изотопами пропионата, введенными крысам натощак, показывают, что он может появляться в гликогене, глюкозе, промежуточных продуктах цикла лимонной кислоты, аминокислотах и белках.. Путь метаболизма пропановой кислоты включает взаимодействие с коферментом А, карбоксилирование с образованием метилмалонил-кофермента А и превращение в янтарную кислоту, которая входит в цикл лимонной кислоты. Пропановая кислота может окисляться без образования кетоновых тел и, в отличие от уксусной кислоты, входит в состав углеводов, а также липидов (Bingham, Cohrssen, & Powell, 2001). Пропионовая ацидурия является одной из наиболее частых органических ацидозов, заболеванием, которое включает в себя множество различных. Результаты пациентов, родившихся с пропионовой ацидурией, имеют слабые паттерны интеллектуального развития: 60% имеют IQ менее 75 и требуют специального образования. Успешные пересадки печени и / или почек у нескольких пациентов привели к улучшению качества жизни, но не обязательно предотвратили неврологические и висцеральные осложнения. Эти результаты подчеркивают необходимость постоянного метаболического мониторинга, независимо от терапевтической стратегии.. Видео:Специфические химические свойства карбоновых кислот | Химия ЕГЭ 10 класс | УмскулСкачать  приложенийПропановая кислота подавляет рост бактерий и плесени на уровне от 0,1 до 1% по весу. В результате большая часть производимой пропановой кислоты потребляется в качестве консерванта для кормов и пищевых продуктов для потребления человеком, таких как зерновые и злаки.. Консервация кормов, зерновых и продуктов питания, а также производство пропионата кальция и натрия, который составляет почти 80% мирового потребления пропановой кислоты в 2016 году, по сравнению с 78,5% в 2012 году.. Приблизительно 51% мирового потребления пропановой кислоты используется для кормления животных и сохранения зерна, в то время как почти 29% используется для производства пропионатов кальция и натрия, которые также используются в пищевой и кормовой промышленности.. Другими важными рынками сбыта пропановой кислоты являются производство гербицидов и диэтилкетона. Области применения с меньшим объемом включают ацетон пропионат целлюлозы, фармацевтические препараты, сложные эфиры растворителей, ароматизаторы и ароматизаторы, пластификаторы, красители и вспомогательные вещества для текстиля, кожу и резину.. Потребность в пропановой кислоте в значительной степени зависит от производства кормов и круп, за которыми следуют фасованные продукты и хлебобулочные изделия.. Перспективы глобального роста пропановой кислоты и ее солей в кормах для животных / зерновых и консервирования продуктов питания являются значительными (IHS Markit, 2016). Другие быстрорастущие рынки включают сложные эфиры пропионата для растворителей, такие как н-бутилпропионат и пентил; Эти сложные эфиры все чаще используются в качестве заменителей растворителей, включенных в список опасных загрязнителей воздуха.. Видео:8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать  Пропановая кислота. Физические и химические свойства. Применение, безопасность при работе.Пропановая кислота (другие названия — метилуксусная кислота, консервант Е280, пропионовая кислота) — это жидкость без цвета с едким неприятным запахом. Имеет следующую химическую формулу: С2Н5-СООН. Физические свойства пропионовой кислоты: 1. Температура плавления равна -21°. 4. Молярная масса равна 74,08 грамм/моль. 5. При стандартных условиях представляет собой бесцветную жидкость. 6. Температура самовоспламенения равна 440°. Химические свойства пропионовой кислоты: 1. Смешивается с водой (H2O) и органическими растворителями. 2. Пропановая кислота — это типичный представитель карбоновых насыщенных кислот. Может образовывать эфиры, галогенагидриды, амиды и другие вещества. История открытия пропановой кислоты Это вещество впервые было описано в 1844 году Готлибом Йоханом, который нашел его среди продуктов разложения сахара. Затем в течение некоторого времени другие ученые-химики получали эту кислоту разными способами, не осознавая при этом, что добывали одно и то же соединение. А в 1847 году Жан-Батист Дюма установил, что полученные ранее вещества были одной и той же кислотой, которую он впоследствии назвал как пропановая кислота, формула которой — С2Н5-СООН. Какие существуют способы получения пропановой кислоты? В природе пропановая кислота найдена в нефти. В промышленности данное вещество получают посредством карбонилирования этилена по реакции Реппе как побочный продукт при окислении углеродов, каталитическим окислением пропанового альдегида в присутствии ионов марганца или кобальта. Также большое количество метилуксусной кислоты можно получить при производстве кислоты уксусной, однако современные способы получения сделали этот способ второстепенным источником пропановой кислоты. Данное вещество можно получить при метаболическом разложении аминокислот и жирных кислот, которые содержат нечетное число атомов углерода. Также пропановую кислоту производят бактерии рода Propionibacterium (как конечный продукт своего метаболизма). Эти бактерии встречаются в пищеварительной системе жвачных животных, и именно из-за их деятельности у швейцарского сыра есть свой неповторимый аромат. Производные пропионовой кислоты Это эфиры и соли. Щёлочноземельные и щёлочные соли хорошо растворяются в воде (H2O), не растворяются в органических растворителях. Эфиры этого вещества плохо растворимы в (H2O) воде, но смешиваются с органическими растворителями. Применение Эта кислота используется в следующих случаях: — производство гербецидов (например, дихлорпрол, пропанол), лекарственных препаратов (феноболин, ибупрофен), некоторых душистых веществ (линалоил-, фенил-, геранил-, бензил- пропионаты), растворителей (бутил-, пентил-, пропилпропионата), пластмасс (поливинилпропионат), ПАВ (эфиры гликолевые) и винилпластификаторов; — так как пропановая кислота препятствует росту некоторых бактерий и плесени, то большая ее часть используется в качестве консерванта в продуктах питания как для человека, так и для животных. В продуктах для животных используется непосредственно пропионовая кислота или ее соль (аммония пропионат), а в продуктах, которые производятся для человека, используется кальциевая (кальция пропионат) или натриевая (пропионат натрия) или соли. Безопасность при работе Основная опасность при работе с пропионовой кислотой — это химические ожоги различной степени тяжести. В исследованиях, которые проводились на лабораторных животных, единственным негативным эффектом, связанным с долговременным потреблением небольших доз пропановой кислоты, было появление язвочек в пищеводе и желудке, что обусловлено разъедающими свойствами вещества. В ходе эксперимента не было обнаружено, что пропановая кислота мутагенна, канцерогенна, токсична и плохо влияет на репродуктивные органы. Попадая в организм, рассматриваемое нами вещество быстро окисляется, метаболизируется и затем выводится в виде углекислого газа. 📸 Видео11.1. Карбоновые кислоты: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать  11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать  Карбоновые кислоты | Органическая химия | Химия ЕГЭ, ЦТСкачать  Свойства карбоновых кислот | Химия ЕГЭ 10 класс | УмскулСкачать  ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать  47. Химические свойства кислотСкачать  Свойства кислот с точки зрения теории электролитической диссоциации. 9 класс.Скачать  Все о получении карбоновых кислот за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать  Свойства кислот и их применение. 8 класс.Скачать  СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать  ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать  ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать  Оксиды. Химические свойства. 8 класс.Скачать  Карбоновые кислоты. Химические свойства (часть 2). Химия 10 классСкачать  |