- Фтороводород, плавиковая кислота (HF)
- Способы получения фтороводорода
- Физические свойства и строение фтороводорода
- Химические свойства фтороводорода
- Фторноватистая кислота (фтороксигенат(0) водорода) HOF
- Получение фторноватистой кислоты
- Химические свойства фторноватистой кислоты
- Плавиковая кислота
- Содержание
- Свойства
- Физические
- Химические
- Техническая плавиковая кислота
- Применение
- Токсичные свойства
- Фторид калия: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- 📽️ Видео
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Фтороводород, плавиковая кислота (HF)
Способы получения фтороводорода
- Из простых веществ:
- Действие концентрированной H2SO4 на фториды металлов:
Физические свойства и строение фтороводорода
Фтороводород HF — бесцветная легкоподвижная и легкоиспаряющаяся жидкость с резким, удушающим запахом.
По сравнению с другими галогенводородами HF имеет аномально высокие Тпл. (
83°С) и Ткип. (19,5°С), т.к. молекулы HF объединяются водородными связями в прочные ассоциаты (HF)n :
Плавиковая кислота
Фтороводород неограничено растворяется в воде с образованием раствора слабой кислоты (Кдисс = 6,8-10 -4 ). Плавиковая кислота растворяет кварц, стекло и все силикаты, по причине чего и получила такое название.
Химические свойства фтороводорода
Общие свойства кислот
Проявляет все свойства кислот.
- Взаимодействие с металлами:
Металлы легко окисляются плавиковой кислотой, однако некоторые металлы образуют на поверхности малорастворимую защитную пленку фторидов, поэтому в кислоте не растворяются (например, Pb).
На платину и золото плавиковая кислота не действует.
Эффективным растворителем металлов является смесь HF и HNО3:
- Взаимодействие с неметаллами:
HF и смесь HF + HNО3 взаимодействуют с кремнием:
- медленно растворяет оксид кремния SiО2 :
Видео:Плавиковая кислота. Химические и физические свойства.Скачать

Фторноватистая кислота (фтороксигенат(0) водорода) HOF
HOF — бесцветные жидкость и газ (выше 0ºС). Соединение весьма летучее и термически неустойчивое. Кислотных свойств не проявляет, солей не образует. Однако ковалентные производные формального замещения водорода называют гипофторитами.
Получение фторноватистой кислоты
- Получают при фторировании льда при температуре −40 C:
Химические свойства фторноватистой кислоты
- Разлагается при температуре 19 °С:
Разложение часто сопровождается взрывом
HOF + 2NaOH = NaF + NaHO2 + H2O
Видео:8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

Плавиковая кислота
| Плавиковая кислота | |
|---|---|
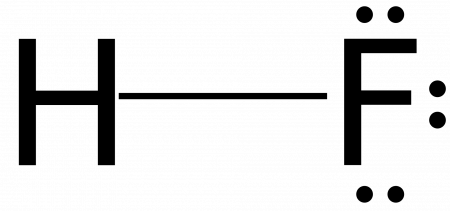  | |
 | |
| Систематическое наименование | фтороводород |
| Традиционные названия | плавиковая кислота |
| Хим. формула | HF |
| Состояние | бесцветная жидкость |
| Молярная масса | 20.0063 г/моль |
| Плотность | 1,258 (70 %) |
| Температура | |
| • плавления | −75 (70 %) |
| • кипения | 85,8 (70 %) °C |
| • вспышки | негорючая °C |
| Константа диссоциации кислоты pKa | 3,17 |
| Растворимость | |
| • в воде | смешивается |
| ГОСТ | ГОСТ 10484-78 |
| Рег. номер CAS | 7664-39-3 |
| Рег. номер EINECS | 231-634-8 |
| RTECS | MW7875000 |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Плавиковая кислота (фтороводородная кислота, фтористоводородная кислота, гидрофторидная кислота) — водный раствор фтороводорода (HF). Промышленностью выпускается в виде 40 % (чаще), а также 50 % и 72 % растворов. Название «плавиковая кислота» происходит от плавикового шпата, из которого получают фтороводород. Соли плавиковой кислоты называют фторидами, все растворимые в воде фториды токсичны.
Видео:Химические свойства кислот. 7 класс.Скачать

Содержание
- 1 Свойства
- 1.1 Физические
- 1.2 Химические
- 2 Техническая плавиковая кислота
- 3 Применение
- 4 Токсичные свойства
Видео:ПЛАВИКОВАЯ КИСЛОТАСкачать

Свойства
Физические
Бесцветная легкоподвижная жидкость с резким запахом и обжигающим «уксусным» вкусом. Растворение фтористого водорода в воде сопровождается довольно значительным выделением тепла (59,1 кДж/моль). Для него характерно образование содержащей 38,6 % HF и кипящей при 114 °C азеотропной смеси (по другим данным 37,5 % и tкип 109 °C). Такая азеотропная смесь получается в конечном счёте при перегонке как концентрированной, так и разбавленной кислоты.
При низких температурах фтористый водород образует нестойкие соединения с водой состава H2O·HF, H2O·2HF и H2O·4HF. Наиболее устойчиво из них первое (tпл −35 °C), которое следует рассматривать как фторид гидроксония — [H3O]F. Второе является гидрофторидом гидроксония [H3O][HF2].
Химические
Плавиковая кислота — кислота довольно слабая (средней силы) (константа диссоциации составляет 6,8⋅10 −4 , степень диссоциации 0,1 н. раствора 9 %), однако она разъедает стекло и другие силикатные материалы, поэтому плавиковую кислоту хранят и транспортируют в полиэтиленовой таре.
Реакция идёт с выделением газообразного фторида кремния (SiF4):
Реагирует со многими металлами с образованием фторидов (свинец не растворяется в плавиковой кислоте, так как на его поверхности образуется нерастворимый фторид PbF2; платина, палладий и золото также не растворяются), не действует на парафин, который используют при хранении этой кислоты.
Видео:Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать

Техническая плавиковая кислота
Техническая плавиковая кислота обычно содержит ряд примесей — Fe, Rb, As, кремнефтористоводородную кислоту H2SiF6, SO2 и др.
Для грубой очистки её перегоняют в аппаратах из платины или свинца, отбрасывая первые порции дистиллята.
Для получения более чистой кислоты техническую кислоту переводят в гидрофторид калия, затем разлагают его нагреванием, растворяя фтористый водород в дистиллированной воде.
Крепкая плавиковая кислота (более 60 % HF) может сохраняться и транспортироваться в стальных ёмкостях, но разъедает стекло. Для хранения плавиковой кислоты и работы с ней в лабораторных условиях требуются сосуды из тефлона, полиэтилена и других пластмасс.
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Применение
Крупный потребитель фтороводородной кислоты — алюминиевая промышленность.
- Раствор фтороводорода применяется для прозрачного травления силикатного стекла (например — нанесение надписей — для этого стекло покрывают парафином, прорезая отверстия для травления). Матовое травление получают в парах фтороводорода.
- Для травления кремния в полупроводниковой промышленности.
- В составе травильных, травильно-полировальных смесей, растворов для электрохимической обработки нержавеющей стали и специальных сплавов.
- Получение фторидов, кремнефторидов и борфторидов, фторорганических соединений, а также соответствующих кислот (кремнефтороводородная кислота и борфтороводородная кислота), синтетических смазочных масел и пластических масс.
- Для растворения силикатов при различного рода анализах.
- В процессе алкилирования, в качестве катализатора в реакции изобутана и олефина.
Видео:Химия. 9 класс. Химические свойства кислот с точки зрения теории электролитической диссоциацииСкачать

Токсичные свойства

Обладает выраженным эффектом при вдыхании, раздражающим действием на кожу и слизистые оболочки глаз (вызывает болезненные ожоги и изъязвления); кожно-резорбтивным, эмбриотропным, мутагенным и кумулятивным действием. Ей присвоен второй класс опасности для окружающей среды; чистый фтороводород также принадлежит ко второму классу опасности.
При попадании на кожу в первый момент не вызывает сильной боли, легко и незаметно всасывается, но через короткое время вызывает отёк, боль, химический ожог и общетоксическое действие. Симптомы от воздействия слабо концентрированных растворов могут появиться через сутки и даже более после попадания их на кожу.
При попадании в кровь через кожу связывает кальций крови и может вызвать нарушение сердечной деятельности. Ожоги площадью более чем 160 см 2 опасны возможными системными токсическими проявлениями.
Токсичность плавиковой кислоты и её растворимых солей предположительно объясняется способностью свободных ионов фтора связывать биологически важные ионы кальция и магния в нерастворимые соли ( отравление фторидами ). Поэтому для лечения последствий воздействия плавиковой кислоты часто используют глюконат кальция, как источник ионов Ca 2+ . Пострадавшие участки при ожогах плавиковой кислотой промываются водой и обрабатываются 2,5 % гелем глюконата кальция. Тем не менее, поскольку кислота проникает сквозь кожу, простого промывания недостаточно и необходимо обращение к врачу для проведения лечения. Высокую эффективность показали внутриартериальные инфузии хлорида кальция.
Предельно допустимая концентрация (ПДК) плавиковой кислоты:
Видео:Химия | КислотыСкачать

Фторид калия: способы получения и химические свойства
Фторид калия KF — соль щелочного металла калия и плавиковой кислоты. Белое вещество, плавится без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 58,10; относительная плотность для тв. и ж. состояния d = 2,48; tпл = 857º C
Видео:Растворение стекла в плавиковой кислотеСкачать

Способ получения
1. Фторид калия можно получить путем взаимодействия при комнатой температуре калия и фтора:
2K + F2 = 2KF
2. В результате взаимодействия разбавленной плавиковой кислоты и разбавленного раствора гидроксида калия, образуется фторид калия и вода:
KOH + HF = KF + H2O
3. Карбонат калия взаимодействует с разбавленной плавиковой кислотой, образуя фторид калия, воду и углекислый газ:
4. При 310–400º C гидродифторид разлагается на фторид калия и фтороводородную кислоту:
K(HF2) = KF + HF
Видео:Хлороводородная кислота. 9 класс.Скачать

Качественная реакция
Качественная реакция на фторид калия — взаимодействие его с хлоридом кальция, в результате реакции происходит выпадение белого осадка:
1. При взаимодействии с хлоридом кальция , фторид калия образует фторид кальция и хлорид калия:
2KF + CaCl2 → 2KCl + CaF2↓
Видео:Свойства кислот с точки зрения теории электролитической диссоциации. 9 класс.Скачать

Химические свойства
1. Фторид калия вступает в реакцию со сложными веществами :
1.1. Фторид калия вступает во взаимодействие с кислотами:
1.1.1. При кипении в результате взаимодействия с концентрированной серной кислотой фторид калия образует сульфат калия и газ фтороводород:
1.1.2. В реакции с концентрированной фтороводородной кислотой фторид калия образует гидродифторид калия:
KF + HF = K(HF2)
1.2. Фторид калия реагирует с основаниями :
1.2.1. При кипении насыщенный раствор гидроксида лития реагирует со фторидом калия с образованием гидроксида калия и осадка фторида лития:
📽️ Видео
Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Химия 8 класс (Урок№20 - Получение и химические свойства кислот.)Скачать

КИСЛОТЫ ХИМИЯ // Урок Химии 8 класс: Кислоты, Кислотный Остаток, Классы Неорганических СоединенийСкачать

ПОЛУЧЕНИЕ ФТОРОВОДОРОДА. Получение Кислоты Разъедающая Стекло. Получение Плавиковой Кислоты.Скачать

Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать



