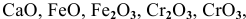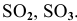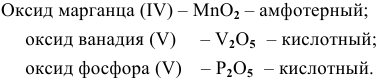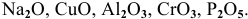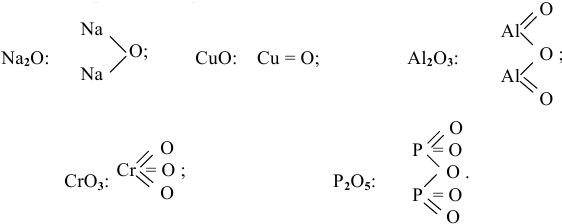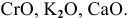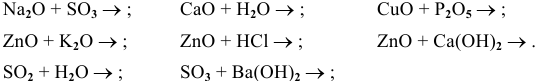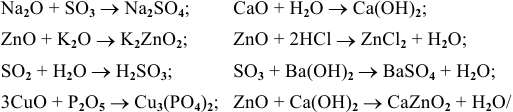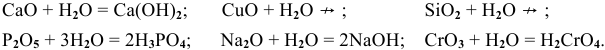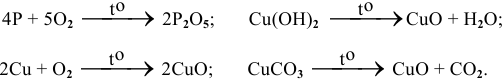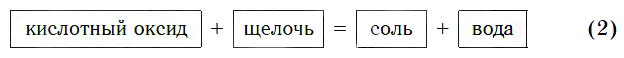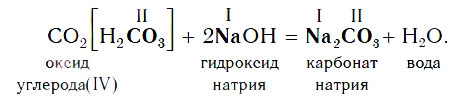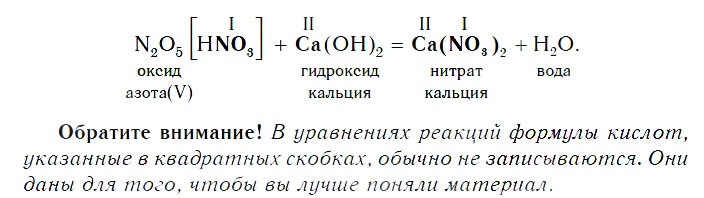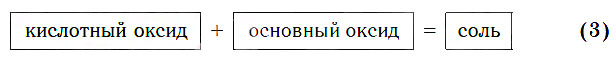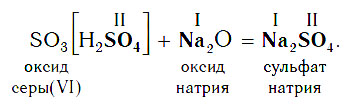Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
- Классификация оксидов
- Получение оксидов
- Химические свойства оксидов
- Химические свойства основных оксидов
- Задачи с решениями по оксидам
- Типовые задачи с решениями по оксидам
- Задача 1
- Задача 2
- Задача 3
- Задача 4
- Задача 5
- Задача 6
- Задача 7
- Задача 8
- Урок 32. Химические свойства оксидов
- 1. Химические свойства кислотных оксидов
- 2. Химические свойства основных оксидов
- 📽️ Видео
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Классификация оксидов
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом :
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например , алюминий взаимодействует с кислородом с образованием оксида:
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
Железо также горит с образованием железной окалины — оксида железа (II, III):
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например , фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
Но есть некоторые исключения .
Например , сера сгорает только до оксида серы (IV):
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например , при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
4. Еще один способ получения оксидов — разложение сложных соединений — солей .
Например , нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Видео:8 класс химические свойства оксидов, оснований, кислот, солей и ионные уравненияСкачать

Задачи с решениями по оксидам
Типовые задачи с решениями по оксидам
Задача 1
Назвать следующие оксиды:
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 2
Найти эмпирические формулы следующих оксидов: оксид марганца (IV), оксид ванадия (V), оксид фосфора (V). К какой группе оксидов относится каждый из них?
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 3
Привести графические формулы следующих оксидов:
Решение:
Графическая формула показывает порядок, в котором атомы соединены в молекуле. В графической формуле единица химической связи (валентности) изображается черточкой:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 4
К каким типам относятся следующие оксиды: 
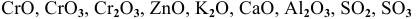
Решение:
К основным оксидам относятся оксиды металлов с ярко выраженными металлическими свойствами, проявляющими низкие валентности, в основном I и II:
К амфотерным оксидам относятся оксиды металлов со слабо выраженными металлическими свойствами. Обычно эти металлы находятся в каждом периоде на границе между неметаллами и металлами с ярко выраженными металлическими свойствами:
К кислотным оксидам относятся оксиды неметаллов, а также оксиды металлов, проявляющих высокие валентности, в основном V, VI, VII: 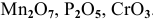
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 5
Составить уравнения следующих химических реакций:
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 6
Какие из перечисленных оксидов будут взаимодействовать с водой: 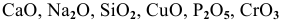
Решение:
С водой взаимодействуют кислотные оксиды, за исключением 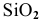
оксид щелочного или щелочно-земельного металла + 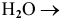
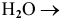
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 7
Какие из оксидов будут реагировать попарно: 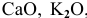
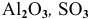
Решение:
Рекомендую самостоятельно составить подобную задачу и решить ее.
Задача 8
Как можно получить следующие оксиды: 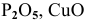
Решение:
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Урок 32. Химические свойства оксидов
В уроке 32 «Химические свойства оксидов» из курса «Химия для чайников» узнаем о всех химических свойствах кислотных и основных оксидов, рассмотрим с чем они реагируют и что при этом образуется.
Так как химический состав кислотных и основных оксидов различен, они отличаются своими химическими свойствами.
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

1. Химические свойства кислотных оксидов
а) Взаимодействие с водой
Вы уже знаете, что продукты взаимодействия оксидов с водой называются «гидроксиды»:
Поскольку оксиды, вступающие в эту реакцию, делятся на кислотные и основные, то и образующиеся из них гидроксиды также делятся на кислотные и основные. Таким образом, кислотные оксиды (кроме SiO2) реагируют с водой, образуя кислотные гидроксиды, которые являются кислородсодержащими кислотами:
Каждому кислотному оксиду соответствует кислородсодержащая кислота, относящаяся к кислотным гидроксидам. Несмотря на то что оксид кремния SiO2 с водой не реагирует, ему тоже соответствует кислота H2SiO3, но ее получают другими способами.
б) Взаимодействие с щелочами
Все кислотные оксиды реагируют со щелочами по общей схеме:
В образующейся соли валентность атомов металла такая же, как и в исходной щелочи. Кроме того, в состав соли входит остаток той кислоты, которая соответствует данному кислотному оксиду.
Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — CO3, валентность которого, как вы уже знаете, равна II:
Если же в реакцию вступает кислотный оксид N2О5, которому соответствует кислота HNO3 (указана в квадратных скобках), то в составе образующейся соли будет остаток этой кислоты — NO3 с валентностью, равной I:
Поскольку все кислотные оксиды реагируют со щелочами с образованием солей и воды, этим оксидам можно дать другое определение.
Кислотными называются оксиды, реагирующие со щелочами с образованием солей и воды.
в) Реакции с основными оксидами
Кислотные оксиды реагируют с основными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид SO3, которому соответствует кислота H2SO4 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — SO4, валентность которого равна II:
Если же в реакцию вступает кислотный оксид Р2О5, которому соответствует кислота Н3РО4, то в составе образующейся соли будет остаток этой кислоты — РO4 с валентностью, равной III.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

2. Химические свойства основных оксидов
а) Взаимодействие с водой
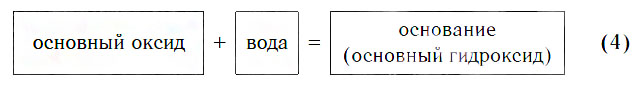
Вы уже знаете, что в результате взаимодействия основных оксидов с водой образуются основные гидроксиды, которые иначе называются основаниями:
К таким основным оксидам относятся оксиды: Li2O, Na2O, K2O, CaO, BaO.
При написании уравнений соответствующих реакций следует помнить, что валентность атомов металла в образующемся основании равна его валентности в исходном оксиде.
Основные оксиды, образованные такими металлами, как Cu, Fe, Cr, с водой не реагируют. Соответствующие им основания получают другими способами.
б) Взаимодействие с кислотами
Практически все основные оксиды реагируют с кислотами с образованием солей по общей схеме:
Следует помнить, что в образующейся соли валентность атомов металла такая же, как в исходном оксиде, а валентность кислотного остатка такая же, как в исходной кислоте.
Поскольку все основные оксиды реагируют с кислотами с образованием солей и воды, этим оксидам можно дать другое определение.
Основными называются оксиды, реагирующие с кислотами с образованием солей и воды.
в) Взаимодействие с кислотными оксидами
Основные оксиды реагируют с кислотными оксидами с образованием солей в соответствии с общей схемой:
В образующейся соли валентность атомов металла такая же, как и в исходном основном оксиде. Кроме того, следует запомнить, что в состав соли входит остаток той кислоты, которая соответствует кислотному оксиду, вступающему в реакцию. Например, если в реакцию вступает кислотный оксид N2O5, которому соответствует кислота HNO3, то в состав соли будет входить остаток этой кислоты — NO3, валентность которого, как вы уже знаете, равна I.
Поскольку рассмотренные нами кислотные и основные оксиды в результате различных реакций образуют соли, их называют солеобразующими. Существует, однако, небольшая группа оксидов, которые в аналогичных реакциях не образуют солей, поэтому их называют несолеобразующими.
Краткие выводы урока:
- Все кислотные оксиды реагируют со щелочами с образованием солей и воды.
- Все основные оксиды реагируют с кислотами с образованием солей и воды.
- Кислотные и основные оксиды являются солеобразующими. Несолеобразующие оксиды — CO, N2О, NO.
- Основания и кислородсодержащие кислоты являются гидроксидами.
Надеюсь урок 32 «Химические свойства оксидов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
📽️ Видео
Оксиды. Химические свойства оксидов. Урок 8. Химия 8 класс.Скачать

Характеристика и химические свойства оксидов | Химия ЕГЭ 10 класс | УмскулСкачать

Химия 8 Химические свойства оксидовСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Кислотный оксид + вода = ??? Основной оксид + вода = ???Скачать

Химические свойства основных и кислотных оксидовСкачать

Химические свойства оксидов | ЕГЭ ХИМИЯ 2022 | СОТКАСкачать

Химия 8 класс (Урок№16 - Свойства, получение, применение оксидов.)Скачать

8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

45. Химические свойства оксидов. (часть 1)Скачать

Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать