Оксид магния MgO — бинарное неорганическое вещество . Белый, тугоплавкий, термически устойчивый, не реагирует с водой. Проявляет основные свойства.
Относительная молекулярная масса Mr = 40,3; относительная плотность для тв. и ж. состояния d = 3,62; tпл ≈ 2825º C; tкип = 3600º C.
Видео:Получение оксида магния. Опыт 1Скачать

Способ получения
1. Оксид магния получается при разложении карбоната магния при температуре 350 — 650º C. В результате разложения образуется оксид магния и углекислый газ:
2. В результате разложения нитрата магния при температуре выше 300º С образуется оксид магния, оксид азота (IV) и кислород:
3. Гидроксид магния разлагается при 350-480º С с образованием оксида магния и воды:
4. Оксид магния можно получить путем разложения сульфата магния при температуре выше 1200º C, образуется оксид магния, кислород и оксид серы (IV):
5. Оксид магния можно получить сжиганием магния в в кислороде при 600 — 650º С:
2Mg + O2 = 2MgO
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства
1. Оксид магния реагирует с простыми веществами :
1.1. В результате реакции между оксидом магния и кальцием при температуре выше 400º С образуется магний и оксид кальция:
MgO + Ca = CaO + Mg
1.2. Оксид магния реагирует с углеродом при температуре выше 2000º С и образует магний и угарный газ:
MgO + C = Mg + CO
2. Оксид магния взаимодействует со сложными веществами:
2.1. Оксид магния взаимодействует с кислотами . При этом образуются соль и вода.
2.1.1. О ксид магния с разбавленной соляной кислотой образует хлорид магния и воду:
MgO + 2HCl = MgCl2 + H2O
2.3. Оксид магния взаимодействует с водой при 100 — 125º С, образуя гидроксид магния:
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

В какие реакции вступает оксид магния
Всё о химических свойствах оксида магния
Оксид магния — порошкообразное вещество, которое в природе встречается в форме минерала периклаз. Порошок этот очень тугоплавкий (расплав образуется при температуре свыше 2650 ⁰С).
Оксид магния легко впитывает влагу, благодаря чему он нашел широкое применение. Оксид магния применяется в пищевой промышленности (кодируется как пищевая добавка Е 530) против комкообразования и слеживания.
В медицине MgO используется как антацид (средство против повышенной кислотности в желудке), как слабительное или как вспомогательное вещество во многих лекарствах, которые выпускаются в форме таблеток.
Нашел MgO широкое распространение и как наполнитель в производстве резины, огнеупоров, цемента, а также в качестве мелкого абразива в электронной промышленности.
Интересное оптическое свойство порошка оксида магния обуслаливает его применение в качестве эталонного отражателя: в широком спектре его коэффициент отражения равен 1.
Одно из названий MgO — жженая магнезия, так как он получается при обжиге минералов магнезита и доломита:
Получить это вещество можно простым способом — взаимодействием магния и кислорода:
Будучи основным оксидом, MgO вступает в реакции с:
- водой, образуя гидроксид магния (о нюансах этой реакции расскажем чуть позже);
- с кислотами, образуя соли и воду;
- с кислотными оксидами, образуя сложные соли;
- c амфотерным оксидами при сплавлении образует сложные вещества — двойные оксиды.
Видео:Получение оксида магния. Опыт 1Скачать

Примеры реакций оксида магния
Растворение в кислотах:
- MgO + HCl (разб) → MgCl₂ + H₂O (для протекания реакции нужны неконцентрированные кислоты)
- MgO + H₂SO₄ → MgSO₄ + H₂O В реакциях с кислотами MgO показывает общие свойства оксидов (образуя соль и воду).
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Реакции MgO с кислотными оксидами
MgO + SO₃ → MgSO₄ — образуется сульфат магния
MgO + СO₃ → MgСO₃ — образуется карбонат магния
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Реакции с амфотерным оксидами:
Al₂O₃ + MgO → MgAl₂O₄
В этой реакции оксида магния с оксидом алюминия образуется алюминат магния (двойной оксид магния и алюминия). Реакция протекает при высокой температуре (свыше 1500 ⁰С).
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Как MgO реагирует с водой?
Являясь основным оксидом, MgO взаимодействует с водой, образуя основание — гидроксид магния.
С холодной водой оксид магния реагирует очень медленно, но если реакцию проводить с водяным паром, реакция пойдет быстрее.
MgO + H₂O (вода в виде горячего пара) → Mg(OH)₂
В результате этой реакции образуется гидроксид магния
А вот если у экспериментатора есть полоска магния, можно провести очень зрелищный опыт:
- полоску металла частично опустить в стакан с водой;
- поджечь оставшуюся часть магния.
Mg + 2H₂O = Mg(OH)₂ + H₂↑
Горение магния продолжается даже в воде. При этом выделяющийся водород тоже вступает в реакцию горения.
Внимание! Не пытайтесь повторить этот опыт самостоятельно!
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Оксид магния
| Оксид магния | |
|---|---|
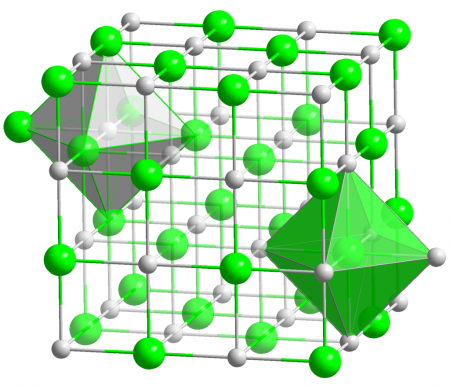 | |
| Систематическое наименование | Оксид магния |
| Традиционные названия | Жжёная магнезия, периклаз, асбест |
| Хим. формула | MgO |
| Рац. формула | MgO |
| Состояние | твёрдое |
| Молярная масса | 40,3044 г/моль |
| Плотность | 3,58 г/см³ |
| Т. плав. | 2825 °C |
| Т. кип. | 3600 °C |
| Энтальпия образования | -601,8 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость в воде | 0,86 г/100 мл |
| ГОСТ | ГОСТ 844-79 ГОСТ 4526-75 |
| Рег. номер CAS | 1309-48-4 |
| PubChem | 14792 |
| Рег. номер EINECS | 215-171-9 |
| SMILES | |
| Кодекс Алиментариус | E530 |
| RTECS | OM3850000 |
| ChEBI | 31794 |
| ChemSpider | 14108 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Оксид магния (жжёная магнезия) — химическое соединение с формулой MgO, белые кристаллы, малорастворимые в воде, пожаро- и взрывобезопасен.
Основная форма — минерал периклаз.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Применение
Видео:Химия 8 Химические свойства оксидовСкачать

Физические свойства
Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике: нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда. Температура плавления — 2825 °C. Температура кипения — 3600 °C. Плотность=3,58 г/см3.
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Химические свойства
Реагирует с разбавленными кислотами с образованием солей, плохо — с холодной водой, образуя Mg(OH)2:
С горячей водой реагирует лучше, реакция идет быстрее.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Получение
Оксид магния получают обжигом минералов магнезита и доломита.
CaCO3 ∗ MgCO3 → MgO + CaO + 2CO2 MgCO3 → MgO + CO2
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Применение
В промышленности применяется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины, наполнитель в ТЭНах. Сверхлегкий оксид магния применяется как очень мелкий абразив для очистки поверхностей, в частности, в электронной промышленности.
В медицине применяют при повышенной кислотности желудочного сока, так как она обусловливается избыточным содержанием соляной кислоты. Жжёную магнезию принимают также при случайном попадании в желудок кислот.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E530.
Является абсолютным отражателем — веществом с коэффициентом отражения, равным единице в широкой спектральной полосе. Может применяться как доступный эталон белого цвета.
🔥 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства оксидовСкачать

Химия 9 класс (Урок№23 - Щелочные металлы. Физические и химические свойства. Оксиды и гидроксиды.)Скачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Типы химических реакций. 1 часть. 8 класс.Скачать

45. Химические свойства оксидов. (часть 1)Скачать

Оксиды. Химические свойства оксидов. Урок 8. Химия 8 класс.Скачать



