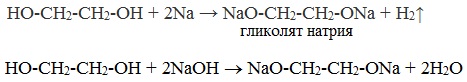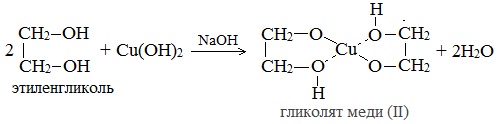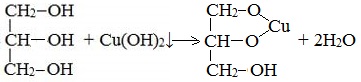Напомним, что многоатомные спирты – это органические соединения, в молекулах которых содержится несколько гидроксильных групп. Общая формула многоатомных спиртов — CnH2n+1(OH)k, где n и k – целые числа более 2. Классификация, строение, изомерия и номенклатура спиртов рассмотрены раннее в соответствующем разделе. В настоящем разделе рассмотрим свойства и получение многоатомных спиртов.
Важнейшие представители многоатомных спиртов содержат от двух до шести гидроксильных групп. Двухатомные спирты (гликоли) или алкандиолы, содержащие две гидроксильные группы в своей молекуле, трехатомные спирты (алкантриолы) – три гидроксильные группы. Четырех-, пяти- и шестиатомные спирты (эритриты, пентиты и гекситы) содержат 4, 5 и 6 ОН-групп соответственно.
Видео:8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химииСкачать

Физические свойства многоатомных спиртов
Многоатомные спирты хорошо растворяются в воде и спиртах, хуже в других органических растворителях. Спирты с небольшим числом углеродных атомов представляют собой вязкие сладковатые на вкус жидкости. Высшие члены ряда — твердые вещества. По сравнению с одноатомными спиртами они имеют более высокие плотности и температуры кипения. Тривиальные названия, названия по систематической номенклатуре и физические свойства некоторых спиртов представлены в таблице:
Видео:Многоатомные спирты. 1 часть. 10 класс.Скачать


Получение многоатомных спиртов
Получение гликолей
Гликоли могут быть получены практически всеми способами получения одноатомных спиртов. Выделим основные:
- Гидролиз дигалогенпроизводных алканов :
- Гидролиз хлоргидринов протекает следующим образом:
- Восстановление сложных эфиров двухосновных кислот по методу Буво:
- Окисление алкенов по Вагнеру:
- Неполное восстановление кетонов под действием магния (в присутствии йода). Таким образом получают пинаконы:
Получение глицерина
- Хлорирование пропилена по Львову:
- Способ Береша и Якубовича состоит в окислении пропилена в акролеин, который затем восстанавливают до аллилового спирта с последующим его гидроксилированием:
- Каталитическое гидрирование глюкозы приводит к восстановлению альдегидной группы и одновременно разрыв С3-С4 связи:
За счет разрыва С2-С3 связи образуется небольшое количество этиленгликоля и треита (стереоизомер эритрита).
Помимо глюкозы каталитическому гидрированию можно подвергнуть и другие полисахариды, содержащие глюкозные звенья, например, целлюлозу.
4. Гидролиз жиров щелочью проводят с целью получения мыла (калиевые или натриевые соли сложных карбоновых кислот): Такой процесс называется омылением.
Получение четырехатомных спиртов (эритритов)
В природе эритрит (бутантетраол-1,2,3,4) содержится как в свободном виде, так и виде сложных эфиров в водорослях и некоторых плесневых грибах.
Искусственно его получают из бутадиена-1,4 в несколько стадий:
Пентаэритрит (тетраоксинеопентан) в природе не встречаются. Синтетически можно получить при взаимодействии формальдегида с водным раствором ацетальдегида в щелочной среде:
Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

Химические свойства многоатомных спиртов
Химические свойства многоатомных спиртов сходны со свойствами одноатомных спиртов. Однако наличие в молекулах многоатомных спиртов нескольких гидроксильных групп увеличивает их кислотность. Поэтому они могут вступать в реакции с щелочами и с гидроксидами тяжелых металлов, образуя соли.
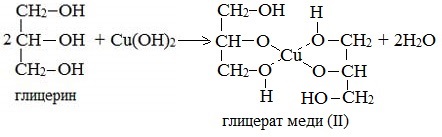
- Взаимодействие с гидроксидом меди Cu(OH)2 является качественной реакцией на многоатомные спирты. В результате реакции образуется раствор гликолята или глицерата меди, окрашенного в синий цвет:
- Взаимодействие с натрием и гидроксидом натрия :
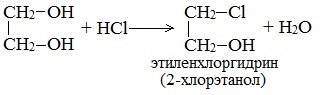
- Взаимодействие с галогенводородами происходит довольно легко. При этом образуются соответствующие хлоргидрины:
Замещение второй гидроксогруппы этиленгликоля происходит труднее (под действием РСl5 или SOCl2 – замещение происходит легче).
- Взаимодействие с кислотами ведет к образованию сложных эфиров:
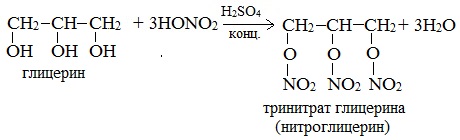
Взаимодействие с азотной кислотой
Данные соединения являются взрывчатыми веществами. Тринитроглицерин, кроме этого, используют в медицине в качестве лечебного препарата.
Взаимодействие с уксусной кислотой
Если в реакции этерификации этиленгликоля участвует двухосновная кислота, то возможно получение полиэфира (реакция поликонденсации):
Обычно в качестве R выступает терефталевая кислота. Продуктом такой реакции является терилен, лавсан:
- Реакции дегидратации многоатомных спиртов:
При дегидратации этиленгликоля получается соединение, имеющее 2 таутомерные формы (кето-енольная таутомерия):
Дегидратация этиленгликоля может происходить с одновременной его димеризацией:
Диэтиленгликоль далее может опять вступить в реакцию с этиленгликолем, в результате чего образуется 1,4-диоксан (сильнейший печеночный яд!):
При дегидратации 1,4-бутандиола можно получить тетрагидрофуран (оксолан):
Дегидратация других гликолей сопровождается процессом пинаколиновой перегруппировки:
- Окисление многоатомных спиртов приводит к образованию альдегидов или кетонов.
При окислении этиленгликоля вначале получается гликолевый альдегид, далее глиоксаль, который при дальнейшем окислении переходит в дикарбоновую кислоту:
При окислении глицерина образуется смесь соответствующего альдегида и кетона:
Видео:Все химические свойства спиртов за 45 минут | Химия 10 класс | УмскулСкачать

Химические свойства многоатомных спиртов уравнения
Многоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Если в многоатомных спиртах ОН-группы находятся при соседних атомах углерода, то вследствие взаимного влияния этих групп (–I-эффект одной ОН-группы по отношению к другой), разрыв связи О-Н происходит легче, чем в одноатомных спиртах.
Кислотные свойства
1. С щелочными металлами
Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов.
Видеоопыт «Взаимодействие глицерина с металлическим натрием»
2. С гидроксидом меди(II) — качественная реакция!
Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Cu (OH)2).
Продуктами этих реакций являются комплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Ме–О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи Ме←О за счет неподеленных пар атомов кислорода других ОН-групп.
При взаимодействии многоатомного спирта с гидроксидом меди (II) в щелочной среде образуется темно-синий раствор (гликолят меди и глицерат меди). Эта реакция является качественной реакцией на многоатомные спирты.
Видеоопыт «Взаимодействие многоатомных спиртов с гидроксидом меди (II)»
Гликолят меди
Глицерат меди
По аналогии с алкоголятами соли двухатомных спиртов называются гликолятами, а трехатомных — глицератами.
Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН).
Основные свойства
1. С галогенводородными кислотами
При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген:
Вторая гидроксогруппа замещается труднее, под действием РСl5.
2. Реакция этерификации (с органическими и неорганическими кислотами)
Многоатомные спирты взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров.
С карбоновыми кислотами глицерин образует сложные эфиры – жиры и масла.
При взаимодействии глицерина с азотной кислотой в присутствии концентрированной серной кислоты образуется нитроглицерин (тринитрат глицерина):
Тринитрат глицерина (тривиальное название – нитроглицерин) – тяжелая маслянистая жидкость, известное взрывчатое вещество (взрывается от легкого сотрясения и нагревания). И одновременно лекарственный препарат (спиртовые растворы его не взрываются): 1% спиртовой раствор нитроглицерина применяется в медицине в качестве средства расширяющего сосуды сердца.
3. Окисление
Видеоопыт «Взаимодействие глицерина с кристаллическим перманганатом калия»
Какая разница между третичным и трехатомным спиртом?
Третичным называется спирт, в котором функциональная группа -ОН связана с третичным атомом углерода. Трехатомным называют спирт, в котором имеется три функциональных группы – ОН.
Видео:8.2. Многоатомные спирты (этиленгликоль, глицерин): Способы получения. ЕГЭ по химииСкачать

Спирты
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH. Общая формула их гомологического ряда — CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы OH — глицерины) и т.д.
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором щелочи образуются спирты.
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
Получение этанола брожением глюкозы
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль).
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены.
Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
💡 Видео
7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать

Химические свойства предельных одноатомных спиртов | Химия 10 класс #24 | ИнфоурокСкачать

7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

Многоатомные спирты | Химия 10 класс #26 | ИнфоурокСкачать

Многоатомные спирты | Химия 10 класс | УмскулСкачать

Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

8.1. Многоатомные спирты (этиленгликоль, глицерин): Номенклатура, физические свойства. ЕГЭ по химииСкачать

Взаим-вие многоатомных спиртов с гидроксидом медиСкачать

Химия 10 класс (Урок№6 - Одноатомные предельные спирты.)Скачать

Спирты и фенолы. Тема 21. Химические свойства, получение и применение спиртовСкачать

Классификация и химические свойства спиртов. Практическая часть. 10 класс.Скачать

Одноатомные спирты. Химические свойства и получение | Органическая химия ЕГЭ, ЦТСкачать

Многоатомные спирты: этиленгликоль и глицерин | Органическая химия ЕГЭ, ЦТСкачать

7.2. Спирты: Строение, физические свойства. ЕГЭ по химииСкачать

Вся теория по спиртам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать