Лизин — эта незаменимая аминокислота жизненно важна для построения критических белков организма, необходима для роста, восстановления тканей, производства антител, гормонов, ферментов, альбуминов.
Лизин входит в триаду аминокислот, особо учитываемых при определении общей полноценности питания (лизин, триптофан, метионин).
Недостаточное содержание лизина в широко распространенных зерновых продуктах и сравнительно высокая потребность в нем делают его одной из наиболее важных незаменимых аминокислот.
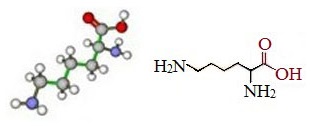
Лизин — 2,6-диаминогексановая или α, Ɛ-диаминокапроновая) кислота – незаменимая основная алифатическая аминокислота.
Лизин (Лиз, Lys, K) является представителем диаминомонокарбоновых кислот HO2CCH (NH2)(CH2)4NH2.
Лизин выделен в 1889 г. Drechsel из гидролизата казеина. Синтез лизина осуществлен в 1902 г. Fischer и Weigert.
Суточная потребность в лизине 3-5 грамм.
Физические свойства
Лизин кристаллизуется в виде бесцветных игл или пластинок и плавится с разложением при температуре 224 0 С. Хорошо растворим в воде, в кислотах и основаниях, трудно растворим в спирте и нерастворим в эфире.
Химические свойства
Аминокислоты проявляют свойства оснований за счет аминогрупп и свойства кислот за счет карбоксильных групп, то есть являются амфотерными соединениями. Молекулы аминокислот в растворах существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Благодаря наличию карбоксильной и аминных групп, лизин может участвовать в специфических химических реакциях. Он образует соли, сложные эфиры, гидразиды, азиды, тиоэфиры, галогенатгидриды. Например, с соляной кислотой лизин образует гидрохлориды.
Жизненно важными для человека являются реакции образования пептидов и белков с участием лизина.
Биологическая роль
Лизин содержится во всех белках, обеспечивает рост костной ткани, стимулирует митозы, является составной частью коллагена, участвует в транспорте жирных кислот в клетке.
Лизин необходим для роста, восстановления тканей, производства антител, гормонов и ферментов.
Введение лизина способствует резкому увеличению количества ретикулоцитов с увеличением очагов кроветворения в костном мозге.
Лизин участвует в утилизации жирных кислот, необходимых для производства энергии.
Принимает участие в обмене белков и углеводов, способствует улучшению сосредоточения.
Способствует абсорбции кальция и поддерживает баланс азота во взрослом организме, способствует образованию коллагена и восстановлению тканей.
Он снижает повышенный уровень триглицеридов в сыворотке крови, усиливает иммунитет к вирусным инфекциям. Лизин способен предупреждать герпесную инфекцию.
Использование лизина в пищевых, биологически активных добавках и лекарственных препаратах
Лизин широко используется при изготовлении качественных, хорошо сбалансированных комбикормов.
Лизин используется как добавка, увеличивающая питательную ценность хлеба. Его добавляют в муку в количестве 0,2 – 0,3 %.
Хлеб и хлебопродукты являются основными источниками энергии и пищевых веществ. Они обеспечивают до 25 – 30 % потребности человека в белках.
Хлебная корка является богатым источником антиоксидантов и дает гораздо больше пользы здоровью (даже предотвращает рак кишечника), чем остальная часть хлеба.
Медпрепарат лизин гидрохлорид является «усилителем вкуса и аромата» пищевых продуктов (Е64). Его добавляют для улучшения аромата к кофе. Специфический запах длительно хранящегося риса можно удалить, добавляя лизин.
При достаточно высокой общей калорийности питания дополнительная добавка лизина приводит к существенному увеличению мышечной массы, особенно физически нагружаемых мышц. При достаточном количестве лизина в организме происходит утилизации жировых тканей.
Лизин является важнейшей незаменимой аминокислотой, потери которой в процессе метаболизма (обмен веществ) не восполняются. Лизин связан с метаболизмом кальция – присутствие лизина способствует всасыванию кальция из кишечника и отложению его в костях.
Лизин повышает иммунитет, является средством профилактики и лечения вирусного заболевания – герпеса.
Кислота аскорбиновая (витамин С), ускоряя образование оксилизина из лизина, активирует синтез коллагена, поддерживает нормальную функцию нервной ткани, необходима для всасывания железа и синтеза гемоглобина, для сохранения восстановительной формы фолиевой кислоты (витамин В0), участвующей в синтезе нуклеиновых кислот и белка.
Аскорбиновая кислота участвует в осуществлении углеводного обмена, активирует синтез антител, интерферона, способствует синтезу гормонов, уменьшает воспалительные и аллергические процессы, ускоряет превращение холестерина. Являетсямощным антиоксидантом, нормализует окислительно-восстановительные процессы.
Организм человека не способен синтезировать аскорбиновую кислоту, поэтому витамин С должен поступать вместе с пищей или применяться в виде витаминного лекарственного средства.
Для восполнения дефицита витамина С требуется регулярное употребление достаточно большого количества свежих овощей и фруктов.
Природные источники
Высоким содержанием лизина отличаются все молочные продукты, однако наибольшую ценность по содержанию лизина представляют творог и обрат, получаемый в результате сепарирования молока.
Важным источником лизина являются сычужные сыры. При свертывании молока сычужным ферментом образующийся сгусток в большей степени обогащен лизином, чем сгусток, образующийся в результате молочнокислого брожения.
Особенностью содержания лизина в мясе является то, что он содержится и в соединительнотканных белках (4% от веса белка). Наиболее богат лизином белок мышечной ткани – миозин и белок крови – гемоглобин. В них лизина в 2,5 раза больше, чем в соединительнотканном белке коллагене.
Яйца в качестве источника лизина представляют меньшую ценность по сравнению с мясом и творогом. Они содержат наполовину меньше лизина. В частях яйца лизин распределен неравномерно. В наибольшем количестве лизин представлен в яичном белке, в котором лизина в 2 раза больше, чем в белке желтка.
Недостаточно лизина в белках зерновых культур. С удалением зародыша и наружных оболочек продукт (мука сортовая, манная крупа и др.) еще в большей степени обедняется лизином.
Высокое содержание лизина в бобовых культурах – соя, горох, фасоль. Это продукты, как бы самой природой предназначенные для компенсации недостающего лизина в хлебных злаках. В соевой муке количество лизина более чем в 10 раз превышает его содержание в пшеничной муке, в гороховой муке – в 5 раз.
Дефицит лизина вызывает у людей головную боль, головокружение, повышенную чувствительность к шуму, понижение аппетита, тошноту, рвоту, ферментные нарушения, анемию, лейкемию, истощение, нарушение репродуктивной функции.
Недостаточность лизина может проявляться в покраснении глаз, выпадении волос, неспособности к концентрации, раздражительности, недостатке энергии, замедлении роста.
При недостатке лизина нарушается азотистое равновесие, наблюдается истощение мышц и нарушение кальцификации костей, а также ряд изменений в печени и легких.
В случае повышенной усталости, несконцентрированности, если глаза склонны наливаться кровью, присутствует тошнота, головокружения, выпадения волос, и анемии, в этом случае у человека может быть дефицит лизина.
Области применения
Лизин помогает устранять некоторые проблемы связанные с бесплодием.
Лизин вводят в пищу детей для повышения аппетита, при лечении тяжелых отравлений.
С возрастом людям, особенно мужчинам, требуется больше лизина, чем в молодости.
Добавки лизина в хлебные продукты улучшают качество их белков.
При герпесе определенно показаны лизиновые добавки по 3-6 грамм ежедневно плюс пища, богатая лизином.
Более 95% лизина используется для добавления к кормам в свиноводстве и птицеводстве. Это связано с тем, что для свиней лизин является первостепенной аминокислотой, а для птиц следует по важности сразу после метионина.
Лизин входит в состав многих биологически активных добавок.
Биологически активная добавка для профилактики гриппа — препарат «Асколизин», содержащий L-лизин, кислоту аскорбиновую и фруктозу.
Фруктоза улучшает вкус Асколизина.
Асколизин-1 рекомендуется для общего укрепления организма, повышения его защитных сил, а также устойчивости к длительным физическим и умственным нагрузкам, при повышенной утомляемости. Также он защищает организм от свободных радикалов.
Необходим людям, работающим с компьютером, имеющим в анамнезе сердечно-сосудистые заболевания, заболевания пищеварительной системы, печени. Особенно рекомендуется лицам с пониженным иммунитетом, а также проживающим в экологически неблагоприятных регионах.
Асколизин-1 рекомендуется применять в зимний и весенний периоды времени.
Асколизин-2 рекомендуется для общего укрепления организма, повышения его защитных сил, а также устойчивости к длительным физическим и умственным нагрузкам, при повышенной утомляемости.
Полезен в зрелом возрасте, при занятиях спортом, в программах по коррекции мышечной массы. Особенно рекомендуется лицам с пониженным иммунитетом, а также проживающим в экологически неблагоприятных регионах и крупных городах.
Асколизин-2 рекомендуется применять в период интенсивных физических тренировок и спортивных состязаний, а также в зимний и весенний периоды времени.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические свойства лизина уравнения реакций



| Лизин | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | |
| Сокращения | Лиз, Lys, K AAA, AAG |
| Традиционные названия | Лизин |
| Хим. формула | HO2CCH(NH2)(CH2)4NH2 |
| Рац. формула | C6H14N2O2 |
| Молярная масса | 146,19 г/моль |
| Химические свойства | |
| pKa | 3.12 (при 0 °C) |
| Растворимость в воде | 1000000 mg/L (при 20 °C) |
| Изоэлектрическая точка | 3,21 |
| Классификация | Рег. номер CAS | 56-87-1 |
| PubChem | 5962 |
| InChI | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Лизин был выделен из гидролизата казеина Дрекселем в 1889 г. Дрексель предполагал, что лизин представляет собой диамин; правильная структура была установлена в 1902 г. Фишером и Вайгертом, которые синтезировали лизин и показали, что синтезированный продукт идентичен рацемизированному природному материалу. Содержание лизина в белках варьирует в широких пределах; он часто входит в состав животных белков, но может отсутствовать или содержаться в очень малых количествах в белках растительного происхождения (например, в зеине и глиадине). При обработке белков азотистой кислотой свободные е-аминогруппы лизина превращаются в гидроксильные группы; по-видимому, у лизина, связанного в белках, большинство е-аминогрупп, если не все, находятся в свободном состоянии. Лизин, связанный по S-NH2-Tpynne, содержится в биоцитине [1].
Содержание
В зависимости от назначения из КЖ можно получить различные микробиологические препараты: жидкий концентрат лизина (ЖКЛ), сухой кормовой концентрат лизина (ККЛ), кристаллический лизин.
Кристаллический лизин выделяют из КЖ после отделения биомассы.
Для получения кормовых продуктов пригодны препараты лизина с содержанием основного вещества (лизинмонохлоргидрата) от 70 % и выше. При этом допускается окраска кристаллов в желтый и светло-коричневый цвета. К препаратам медицинского назначения предъявляются более жесткие требования; для парентерального питания содержание основного вещества должно быть не ниже 99 %.
При нормальном течении процесса доля побочных аминокислот не превышает 3 % от содержания лизина, доля микробных клеток — 1,5 %. Для отделения биомассы от КЖ используют саморазгружающиеся сепараторы, а также фильтрование с намывным слоем либо на барабанном вакуум-фильтре, либо на рамных фильтр-прессах с последующей промывкой осадка водой.
Растворы, содержащие лизин, после подкисления соляной кислотой (рН = 5,0÷5,2) и введения стабилизатора (NaHSO3) концентрируют выпариванием в вакууме до 45–50 % СВ. Полученный концентрат подвергают кристаллизации, которую проводят при 5–12 °С в течение 1–2 сут. Осадок отделяют от маточника в проточных промышленных центрифугах и далее высушивают в распылительной сушилке или в кипящем слое. Готовый продукт, как правило, окрашен в коричневый цвет и содержит не менее 70 % основного вещества.
Другим способом выделения лизина является ионообменный процесс. Для этого раствор продукта подкисляют H2SO4 до рН = 1,6÷2,0, в результате чего образуется дикатион аминокислоты. После хемосорбции на катионите (КУ-2х8), используемом в Н+ или форме, отделяются примеси нейтральной и кислотной природы. Аминокислоты элюируют из катионита 0,5–5 % гидроксида аммония, раствор упаривают, подкисляют HCl до рН = 4,9÷5,0, а концентрат кристаллизуют при 5–12 °С, получая кристаллы монохлоргидрата лизина светло-желтого или светло-коричневого цвета, которые после высушивания содержат 90–95 % основного вещества и 1,0–12,5 % золы. Для получения препарата более высокой степени чистоты в схему очистки включают стадию обработки раствора активным углем, перекристаллизацию из 50% этанола и др.
Энзиматический синтез L-лизина
Производство L-лизина посредством энзиматического синтеза основано на предварительном химическом синтезе DL-α-амино-ε-капролактама (АКЛ), который далее используют для селективного ферментативного гидролиза L-АКЛ до L-лизина; D-АКЛ подвергается ферментативной рацемизации и вновь используется как субстрат для гидролиза. Гидролизующий фермент получают из клеток Cryptococcus laurendii, а фермент, катализирующий рацемизацию, — из клеток Achromobacter obae. При получении L-лизина целесообразно использовать совместное действие на субстрат двух ферментов. Для этого в водный раствор DL-α-амин-ε-капролактама вводят необходимое количество дрожжевых и бактериальных клеток, проявляющих гидролазную и бактериальную активности. Оптимальные условия для действия обоих ферментов следующие: рН = 8,0÷8,5; температура 30–50 °С. Выход L-лизина в этом процессе составляет 99,8 % (мольных) от субстрата [ 6 ] .
По химическим свойствам лизин – α-аминокислота с сильными основными свойствами, обусловленными ε-аминогруппой. С кислотами дает два ряда солей, например с соляной кислотой – гидрохлорид и дигидрохлорид. Образует нерастворимые соли с пикриновой и фосфорномолибденовой кислотами.
Далее можно видеть визуализацию форм лизина в соответствие с данными, полученными при титровании
Лизин — незаменимая аминокислота, т.е. в организме человека лизин не синтезируется, поэтому он должен поступать с пищей. У растений и большинства бактерий лизин образуется из аспарагиновой кислоты через диаминопимелиновую кислоту (ДАП-путь). Сначала происходит фосфорилирование L-аспарагиновой кислоты с образованием L-аспартил-4-фосфата и восстановление аспартилфосфата до аспартил-4-семиальдегида. Эти же реакции происходят на начальных этапах биосинтеза треонина, изолейцина и метионина. Последующая конденсация пирувата и аспартил-4-семиальдегида с образованием дигидродипиколината является первой реакцией, специфической для биосинтеза лизина. Дальнейшие превращения, следующие за восстановлением дигидропиколината до тетрагидродипиколината (ТГДП), могут происходить по-разному:
А. Сукцинилазный путь. У большинства бактерий происходит сукцинилирование ТГДП и образуется N-сукцинил-2-амино-6-кетопимелат.
Б. Ацетилазный путь. Некоторые бактерии рода Bacillus вместо сукцинильной группы используют ацетильную и соответственно продуктом реакции является N-ацетил-2-амино-6-кетопимелат.
В. Дегидрогеназный путь. Немногие бактерии способны к превращению ТГДП сразу в мезо-диаминопимелат благодаря наличию фермента ДАП-дегидрогеназы.
В случае сукцинилазного и ацетилазного путей после ацилирования следуют реакции аминирования (с образованием N-ацилдиаминопимелата, где в качестве ацила выступает либо сукцинил, либо ацетил), деацилировании и эпимеризации образовавшейся LL-ДАП в мезо-диаминопимелат.
Схема сукцинилазного пути представлена ниже.
| Схема сукцинилазного пути биосинтеза лизина через диаминопимелиновую кислоту |
Лизин – кетогенная аминокислота, т.е. она может превратиться в печени в кетоновые тела – β-гидроксибутират, ацетон, ацетоацетат. Деградация лизина в организме человека включает в себя несколько стадий:
1) конденсация лизина и α-кетоглутарата с образованием шиффова основания, которое восстанавливается до L-сахаропорина
2) окисление L-сахаропорина до L-2-аминоадипата через стадию семиальдегида
3) трансаминирование L-2-аминоадипата с α-кетоглутаратом, приводящее к образованию 2-оксоадипата
4) окислительное декарбоксилирование 2-оксоадипата с образованием ацетил-КоА
При мутации в гене α-аминоадипатсемиальдегидсинтазы (AASS) – фермента, катализирующего первые две стадии катаболизма (окисление до семиальдегида), возникает гиперлизинемия, приводящая к повышению содержания лизина в крови и в моче. При соблюдении диеты заболевание не имеет серьезных последствий.
| Схема деградации лизина [ 2 ] |
Роль в метаболизме
Лизин играет важную роль во взаимодействии различных белков (например, гистонов) с ДНК благодаря электростатическим взаимодействиям положительно заряженной ε-аминогруппы и отрицательно заряженными остатками фосфорной кислоты в ДНК. Он также необходим для биосинтеза карнитина – вещества, участвующего в переносе жирных кислот через мембраны митохондрий.
Лизин может посттрансляционно подвергаться различным модификациям, например:
а) ацетилирование и метилирование (эти модификации лизина в гистонах играют важную роль в регуляции доступности ДНК для ферментов транскрипции)
Ацетилирование гистонов играет важную роль в модуляции структуры хроматина при активации транскрипции, увеличивая доступность хроматина для транскрипционного аппарата. Известно что ацетилированные гистоны признак транскрипционно активного хроматина. Но является ли ацетилирование причиной или следствием активации транскрипции? Сейчас более склонны думать, что это одна из причин. Гистоны целенаправленно модифицируются на тех промоторах, которые требуется активировать. При этом определенные остатки лизинов подвергаются ацетилированиям и деацетилированиям с помощью ферментов ацетилтрансфераз и деацетилаз .Полагают, что ацетилированные гистоны менее прочно связаны с ДНК и поэтому транскрипционной машине легче преодолевать сопротивление упаковки хроматина. В частности ацетилирование может облегчать доступ и связывание факторов транскрипции к их элементам узнавания на ДНК. Сейчас идентифицированы ферменты, которые осуществляют процесс ацетилирования и деацетилирования гистонов, и, наверное, скоро мы узнаем больше о том, как это увязывается с активацией транскрипции. В дрожжах с процессами ацетилирования гистонов связан сложный ацетилтрансферазный комплекс SAGA.
В него входит более 20 различных белков, в том числе и гистоноподобные TAF . Уровень ацетилирования необходимый для облегчения транскрипции низок. 12 ацетилированных лизинов на гистоновый октамер усиливает транскрипцию хроматина in vitro на порядок. Помимо ослабления структуры хроматина, ацетилирование, возможно облегчает взаимодействие ацетилированных нуклеосом с другими факторами, участвующими в ремоделировании хроматина или с компонентами транскрипционного аппарата. Таким образом осуществляется комбинаторный эффект: с одной стороны ацетилирование-деацетилирование прямо влияет на структурную подвижность хроматина, а сдругой стороны оно влияет на белок-белковые взаимодействия разных факторов с белками хроматина. Ацетилирование остатков лизина в N-концевых «хвостиках» (tails) гистонов H2A , H2B , HЗ и H4 нейтрализует их положительный заряд и соответственно блокирует ассоциацию с витками нуклеосомной ДНК. Это, в свою очередь, декомпактизует структуру как самой нуклеосомы , так и хроматина в целом и, кроме того, освобождает внешнюю поверхность витков ДНК для взаимодействий с регуляторными факторами. Степень ацетилирования гистонов определяется активностью двух типов ферментов — гистонацетилтрансфераз HAT , (histone acetyl-transferases) и деацетилаз HDAC , (histone deacetylases). Ряд активаторов и коактиваторов транскрипции (в частности, такой важный, как CBP/300 , участвующий в регуляции клеточного роста, дифференцировки, репарации ДНК и апоптоза), а также некоторые субъединицы базального аппарата транскрипции ( ТАF11250 ) обладают гистонацетилтрансферазной активностью. Напротив, репрессоры транскрипции (такие, как Mad и ядерные рецепторы ) ассоциированы с деацетилазной активностью. В регуляцию транскрипции вовлекается также и ковалентная модификация ДНК. И эти две модификации белков и ДНК тесно переплетаются.
b) убиквитинирование, т.е. присоединение регуляторного белка убиквитина, в результате чего может измениться внутриклеточная локализация белка, белок может быть направлен на деградацию в протеасомах, и т.д.
c) гидроксилирование (например, в коллагене)
Лизин благодаря своей способности к образованию шиффовых оснований при взаимодействии с альдегидами может играть важную роль в ферментативном катализе. В качестве примера на схеме ниже показан механизм реакции, катализируемой фруктозодифосфатальдолазой — ферментом гликолиза и глюконеогенеза, катализирующем альдольную конденсацию дигидроксиацетофосфата и глицеральдегид-3-фосфата и обратную ей реакцию. [ 5 ]
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства лизина уравнения реакций
Аминокислоты – гетерофункциональные соединения, содержащие карбоксильную и аминогруппы. По взаимному расположению функциональных групп различают a -, b -, g — и т.д. аминокислоты. Аминокислоты, содержащие аминогруппу на конце цепи, называют w -аминокислотами.
!) Аммонолиз галогензамещенных кислот.
Метод используется для синтеза a -аминокислот из доступных a -галогензамещенных кислот.
2) Метод Штеккера- Зелинского
Включает стадии образования аминонитрила при взаимодействии альдегида с HCN и NH3 c последующим гидролизом его в аминокислоту. В качестве реагента применяют смесь NaCN и NH4Cl.
Метод применим для синтеза только a -аминокислот.
3) Алкилирование N-фталимидмалонового эфира
4) Присоединение аммиака к a , b -непредельным карбоновым кислотам.
Метод применим для синтеза b -аминокислот.
5) Из оксимов циклических кетонов перегруппировкой Бекмана.
Метод используется для синтеза w -аминокислот.
Аминокислоты дают реакции, характерные для карбоксильной и аминогрупп, и, кроме того, проявляют специфические свойства, которые определяются наличием двух функциональных групп и их взаимным расположением.
2.1. Кислотно-основные свойства
Аминокислоты содержат кислотный и основный центры и являются амфотерными соединениями. В кристаллическом состоянии они существуют в виде внутренних солей (биполярных ионов), которые образуются в результате внутримолекулярного переноса протона от более слабого основного центра (СОО — ) к более сильному основному центру (NH2).
Ионное строение аминокислот подтверждается их физическими свойствами. Аминокислоты – нелетучие кристаллические вещества с высокими температурами плавления. Они нерастворимы в неполярных органических растворителях и растворимы в воде. Их молекулы обладают большими дипольными моментами.
Форма существования аминокислот в водных растворах зависит от рН. В кислых растворах аминокислоты присоединяют протон и существуют преимущественно в виде катионов. В щелочной среде биполярный ион отдает протон и превращается в анион.
При некотором значении рН, строго определенном для каждой аминокислоты, она существует преимущественно в виде биполярного иона. Это значение рН называют изоэлектрической точкой (рI). В изоэлектрической точке аминокислота не имеет заряда и обладает наименьшей растворимостью в воде. Катионная форма аминокислоты содержит два кислотных центра (COOH и NH3 + ) и характеризуется двумя константами диссоциации рКа1 и рКа2. Значение рI определяется по уравнению:
2.2. Реакции по аминогруппе
Аминокислоты содержат первичную аминогруппу и подобно первичным аминам взаимодействуют с азотистой кислотой с выделением азота. При этом происходит замещение аминогруппы на гидроксильную.
Реакция используется для количественного определения аминокислот по объему выделившегося азота (метод Ван-Слайка).
Алкилирование и арилирование
При взаимодействии аминокислот с избытком алкилгалогенида происходит исчерпывающее алкилирование аминогруппы и образуются внутренние соли.
Аминокислоты арилируются 2,4-динитрофторбензолом (ДНФБ) в щелочной среде. Реакция протекает как нуклеофильное замещение в активированном ароматическом кольце.
Реакция используется для установления аминокислотной последовательности в пептидах.
Аминокислоты взаимодействуют с ангидридами и хлорангидридами с образованием N-ацильных производных.
Реакция используется для защиты аминогруппы в синтезе пептидов. Такая защита должна легко сниматься, а амиды, как известно, гидролизуются в жестких условиях. При разработке методов синтеза пептидов были найдены защитные группы, которые легко удаляются путем гидролиза или гидрогенолиза.
трет-Бутоксикарбонильная защита (БОК-защита).
Легкость снятия защиты обусловлена устойчивостью бензил- и трет-бутил-катионов, которые образуются в качестве интермедиатов.
2.3. Реакции по карбоксильной группе
При сухой перегонке в присутствии гидроксида бария аминокислоты декарбоксилируются с образованием аминов.
Аминокислоты взаимодействуют со спиртами в присутствии газообразного HCl как катализатора с образованием сложных эфиров.
В отличие от самих аминокислот, их сложные эфиры – легко летучие соединения и могут быть разделены путем перегонки или газожидкостной хроматографии, что используется для анализа и разделения смесей аминокислот, полученных при гидролизе белков.
Получение галогенангидридов и ангидридов
При действии на защищенные по аминогруппе аминокислоты галогенидов фосфора или серы образуются хлорангидриды.
Реакция используется для активации карбоксильной группы при нуклеофильном замещении. Чаще для этой цели получают смешанные ангидриды, которые являются более селективными ацилирующими реагентами.
Реакция используется для активации аминогруппы в синтезе пептидов.
2.4. Специфические реакции аминокислот
Реакции с одновременным участием карбоксильной и аминогрупп идут, как правило, с образованием продуктов, содержащих термодинамически устойчивые 5-ти- и 6-тичленные гетероциклы.
a -Аминокислоты образуют прочные хелатные комплексы с ионами переходных металлов (Cu, Ni, Co, Cr и др.).
Отношение аминокислот к нагреванию
Превращения аминокислот при нагревании зависят от взаимного расположения карбоксильной и аминогруппы и определяются возможностью образования термодинамически стабильных 5-ти- 6-тичленных циклов
a -Аминокислоты вступают в реакцию межмолекулярного самоацилирования. При этом образуются циклические амиды – дикетопиперазины.
b -Аминокислоты при нагревании переходят a , b -непредельные кислоты.
g — и d -Аминокислот претерпевают внутримолекулярное ацилирование с образованием циклических амидов – лактамов.
При взаимодействии a -аминокислот с трикетоном – нингидрином происходит одновременное окислительное дезаминирование и декарбоксилирование с образованием альдегида и окрашенного продукта конденсации.
Реакция используется для количественного анализа аминокислот методом фотометрии.
3.1. Строение и классификация
Природные аминокислоты отвечают общей формуле RCH(NH2)COOH и отличаются строением радикала R. Формулы и тривиальные названия важнейших аминокислот приведены в таблице. Для биологического функционирования аминокислот в составе белков определяющим является полярность радикала R. По этому признаку аминокислоты разделяют на следующие основные группы (см. таблицу).
Таблица47.1. Важнейшие a -аминокислоты RCH(NH2)COOH
Аминокислоты, содержащие неполярный радикал R
Аминокислоты, содержащие полярный неионогенный радикал R
Аминокислоты, содержащие полярный положительно заряженный радикал R
Аминокислоты, содержащие полярный отрицательно заряженный радикал R
Аминокислоты, содержащие неполярный радикал R. Такие группы располагаются внутри молекулы белка и обуславливают гидрофобные взаимодействия.
Аминокислоты, содержащие полярный неионогенный радикал R. Аминокислоты этого типа имеют в составе бокового радикала полярные группы, не способные к ионизации в водной среде (спиртовый гидроксил, амидная группа). Такие группы могут располагаться как внутри, так и на поверхности молекулы белка. Они участвуют в образовании водородных связей с другими полярными группами.
Аминокислоты, содержащие радикал R, способный к ионизации в водной среде с образованием положительно или отрицательно заряженных групп. Такие аминокислоты содержат в боковом радикале дополнительный основный или кислотный центр, который в водном растворе может соответственно присоединять или отдавать протон.
В белках ионогенные группы этих аминокислот располагаются, как правило, на поверхности молекулы и обуславливают электростатические взаимодействия.
Все природные a -аминокислоты (кроме глицина) являются хиральными соединениями. По конфигурации хирального центра в положении 2 аминокислоты относят D- или L-ряду.
Природные аминокислоты относятся к L-ряду.
Большинство аминокислот содержат один хиральный центр и имеют два стереоизомера. Аминокислоты изолейцин, треонин, гидроксипролин, 5-гидроксилизин и цистин содержат два хиральных центра и имеют (кроме цистина) 4 стереоизомера, из которых только один встречается в составе белков.
Так, из 4-х стереоизомеров треонина в природе встречается только (2S,3R)-2-амино-3-гидроксибутановая кислота.
Использование для построения белков только одного вида стереоизомеров имеет важное значение для формирования их пространственной структуры и обеспечения биологической активности.
a -Аминокислоты, полученные синтетическим путем, представляют рацемические смеси, которые необходимо разделять. Наиболее предпочтительным является ферментативный способ разделения с помощью ферментов ацилаз, способных гидролизовать N-ацетильные производные только L- a -аминокислот. Ферментативное расщепление проводят по следующей схеме.
Сначала рацемическую аминокислоту ацилируют уксусным ангидридом:
Затем рацемическую смесь ацетильных производных подвергают ферментативной обработке. При этом гидролизуется ацетильное производное только L-аминокислоты:
Полученная после ферментативного смесь легко разделяется, так как свободная L-аминокислота растворяется и в кислотах, и в щелочах, а ацилированная – только в щелочах.
3.3. Кислотно-основные свойства.
По кислотно-основным свойствам аминокислоты разделяют на три группы.
Нейтральные аминокислоты не содержат в радикале R дополнительных кислотных или основных центров, способных к ионизации в водной среде. В кислой среде они существуют в виде однозарядного катиона и являются двухосновными кислотами по Бренстеду. Как видно на примере аланина, изоэлектрическая точка у нейтральных аминокислот не равна 7, а лежит в интервале 5,5 – 6,3.
Основные аминокислоты содержат в радикале R дополнительный основный центр. К ним относятся лизин, гистидин и аргинин. В кислой среде они существуют в виде дикатиона и являются трехосновными кислотами. Изоэлектрическая точка основных аминокислот, как видно на примере лизина, лежит в области рН выше 7.
Кислые аминокислоты содержат в радикале R дополнительный кислотный центр. К ним относятся аспаргиновая и глутаминовая кислоты. В кислой среде они существуют в виде катиона и являются трехосновными кислотами. Изоэлектрическая точка этих аминокислот лежит в области рН много ниже 7.
Тирозин и цистеин содержат в боковых радикалах слабые кислотные центры, способные к ионизации при высоких значениях рН.
Важное значение имеет тот факт, что при физиологическом значении рН (
7) ни одна аминокислота не находится в изоэлектрической точке. В организме все аминокислоты ионизированы, что обеспечивает им хорошую растворимость в воде.
Различие в кислотно-основных свойствах используется для разделения аминокислот методом электрофореза и ионообменной хроматографии. При данном значении рН разные аминокислоты могут иметь разный по величине и знаку электрический заряд. Например, при рН6 лизин имеет заряд +1 и движется к катоду, аспаргиновая кислота имеет заряд –1 и перемещается к аноду, а аланин находится в изоэлектрической точке и не перемещается в электрическом поле. Таким образом при рН6 они могут быть разделены с помощью электрофореза.
Для разделения аминокислот методом ионообменной хроматографии используют катионообменные смолы (сульфированный полистирол). Процесс ведут в кислой среде, когда аминокислоты находятся катионной форме.
Скорость продвижения аминокислот по хроматографической колонке зависит от силы их электростатических и гидрофобных взаимодействий со смолой. Наиболее прочно связываются со смолой основные аминокислоты, имеющие наибольший положительный заряд, наименее прочно – кислые аминокислоты. Наибольшим гидрофобным связыванием со смолой обладают аминокислоты с неполярными боковыми радикалами, особенно ароматическими. Таким образом, порядок элюирования аминокислот следующий. Легче других элюируются кислые аминокислоты (Asp и Glu), следом за ними идут аминокислоты, содержащие полярные неионогенные группы (Ser, Thr, Asn, Gln), затем из колонки вымываются аминокислоты с неполярными боковыми радикалами (Phe, Trp, Ile и др.) и в последнюю очередь элюируются основные аминокислоты (His, Lys, Arg).
Петиды – это полиамиды, построенные из a -аминокислот. По числу аминокислотных остатков в молекуле пептида различают дипептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами, более 10 аминокислотных остатков – полипептидами. Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками.
Формально пептиды можно рассматривать как продукты поликонденсации аминокислот.
Аминокислотные остатки в пептиде связаны амидными (пептидными) связями. Один конец цепи, на котором находится аминокислота со свободной аминогруппой, называют N-концом. Другой конец, на котором находится аминокислота со свободной карбоксильной группой, называют С-концом. Пептиды принято записывать и называть, начиная с N-конца.
Название пептида строят на основе тривиальных названий, входящих в его состав аминокислотных остатков, которые перечисляют, начиная с N-конца. При этом в названиях всех аминокислот за исключением С-концевой суффикс “ин” заменяют на суффикс “ил”. Для сокращенного обозначения пептидов используют трехбуквенные обозначения входящих в его состав аминокислот.
Пептид характеризуется аминокислотным составом и аминокислотной последовательностью.
Аминокислотный состав пептида может быть установлен путем полного гидролиза пептида (расщепления до аминокислот) с последующим качественным и количественным анализом образовавшихся аминокислот методом ионобменной хроматографии или ГЖХ-анализом сложных эфиров аминокислот. Полный гидролиз пептидов проводят в кислой среде при кипячении их с 6н. HCl.
Одному и тому же аминокислотному составу отвечает несколько пептидов. Так, из 2-х разных аминокислот может быть построено 2 дипептида, из трех разных аминокислот – 6 трипептидов, из n разных аминокислот n! пептидов одинакового состава. Например, составу Gly:Ala:Val=1:1:1 отвечают следующие 6 трипептидов.
Gly-Ala-Val Gly- Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-Val Ala-Val-Glu
Таким образом, для полной характеристики пептида необходимо знать его аминокислотный состав и аминокислотную последовательность.
4.2. Определение аминокислотной последовательности
Для определения аминокислотной последовательности используют комбинацию двух методов: определение концевых аминокислот и частичный гидролиз.
Определение N-концевых аминокислот.
Метод Сегнера. Пептид обрабатывают 2,4-динитрофтробензолом (ДНФБ), а затем полностью гидролизуют. Из гидролизата выделяют и идентифицируют ДНФ-производное N-концевой аминокислоты.
Метод Эдмана состоит во взаимодействии N-концевой аминокислоты с фенилизотиоцианатом в щелочной среде. При дальнейшей обработке слабой кислотой без нагревания происходит отщепление от цепи “меченой” концевой аминокислоты в виде фенилгидантоинового (ФТГ) производного.
Преимущество этого метода состоит в том, что при отщеплении N-концевой аминокислоты пептид не разрушается и операцию по отщеплению можно повторять. Метод Эдмана используют в автоматическом приборе – секвенаторе, с помощью которого можно осуществить 40 – 50 стадий отщепления, идентифицируя полученные на каждой стадии ФТГ-производные методом газожидкостной хроматографии.
Частичный гидролиз полипептидов
При частичном гидролизе пептиды расщепляются с образованием более коротких цепей. Частичный гидролиз проводят с помощью ферментов, которые гидролизуют пептидные связи избирательно, например, только с N-конца (аминопептидазы) или только с С-конца (карбоксипептидазы). Существуют ферменты, расщепляющие пептидные связи только между определенными аминокислотами. Меняя условия гидролиза, можно разбить пептид на различные фрагменты, которые перекрываются по составляющим их аминокислотным остаткам. Анализ продуктов частичного гидролиза позволяет воссоздать структуру исходного пептида. Рассмотрим простейший пример установления структуры трипептида. Частичный гидролиз по двум разным направлениям трипептида неизвестного строения дает продукты представленные на схеме.
Единственный трипептид, структура которого не противоречит продуктам частичного гидролиза – Gly-Ala-Phe.
Установление аминокислотной последовательности пептидов, содержащих несколько десятков аминокислотных остатков, – более сложная задача, которая требует комбинации различных методов.
Синтез пептида с заданной аминокислотной последовательностью – чрезвычайно сложная задача. В простейшем случае синтеза дипептида из 2-х разных аминокислот возможно образование 4-х разных продуктов.
В настоящее время разработана стратегия синтеза пептидов, основанная на использовании методов активации и защиты функциональных групп на соответствующих этапах синтеза. Процесс синтеза дипептида включает следующие стадии:
- защита аминогруппы N-концевой аминокислоты;
- активация карбоксильной группы N-концевой аминокислоты;
- конденсация модифицированных аминокислот
- снятие защитных групп
Таким образом, последовательно присоединяя аминокислоты, шаг за шагом наращивают цепь полипептида. Такой синтез очень длителен, трудоемок и дает низкий выход конечного продукта. Основные потери связаны с необходимостью выделения и очистки продуктов на каждой стадии.
Этих недостатков лишен используемый в настоящее время твердофазный синтез пептидов. На первой стадии защищенная по аминогруппе С-концевая аминокислота закрепляется на твердом полимерном носителе (полистироле, модифицированном введением групп –CH2Cl). После снятия защиты проводят ацилирование аминогруппы закрепленной на носителе аминокислоты другой аминокислотой, которая содержит активированную карбоксильную и защищенную аминогруппу. После снятия защиты проводят следующую стадию ацилирования. Отмывание продукта от примесей проводят прямо на носителе и лишь после окончания синтеза полипептид снимают с носителя действием бромистоводородной кислоты. Твердофазный синтез автоматизирован и проводится с помощью приборов – автоматических синтезаторов.
Методом твердофазного синтеза получено большое количество пептидов, содержащих 50 и более аминокислотных остатков, в том числе инсулин (51 аминокислотный остаток) и рибонуклеаза (124 аминокислотных остатка).
🎬 Видео
КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

7 ВАЖНЕЙШИХ РЕАКЦИЙ, которые тебе нужно знать (Алкины)Скачать

8 класс. Составление уравнений химических реакций.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химия с нуля — Химические свойства АлкеновСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Оксиды. Химические свойства. 8 класс.Скачать

Водород/химические свойства водорода/8 классСкачать

Химические уравнения. Как составлять химические уравнения.Скачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства воды/часть 1/химия 8 классСкачать