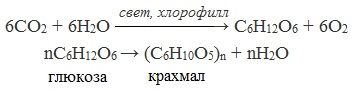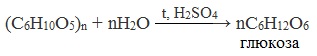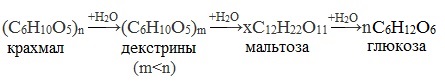Крахмал – ценный питательный продукт. Он входит в состав хлеба, картофеля, круп и наряду с сахарозой является важнейшим источником углеводов в человеческом организме.
Химическая формула крахмала (С6(Н2О)5) n .
- Строение крахмала
- Амилоза
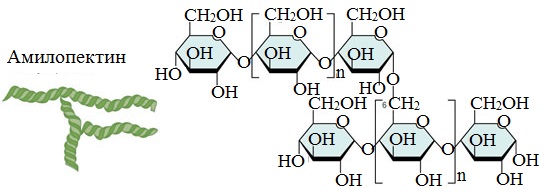
- Амилопектин
- Биологическая роль крахмала. Гликоген
- Превращение крахмала в организме человека и животных
- Нахождение в природе
- Физические свойства
- Химические свойства крахмала
- Получение крахмала
- Применение крахмала
- Химические свойства крахмала подтвердить уравнениями реакций
- Урок химии с ИКТ «Крахмал»
- Ход урока
- I. Организационная часть.
- II. Проверка домашнего задания.
- III. Изучение учебного материала по плану с использованием презентации.
- IV. Закрепление изученного материала (демонстрация слайда «Вопросы»).
- V. Итог урока.
- 📽️ Видео
Строение крахмала
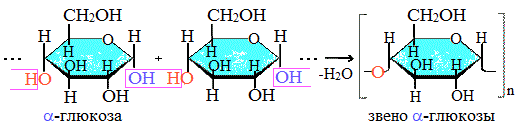
Крахмал состоит из 2 полисахаридов, построенных из остатков циклической a-глюкозы.
Как видно, соединение молекул глюкозы происходит с участием наиболее реакционноспособных гидроксильных групп, а исчезновение последних исключает возможность образования альдегидных групп, и они в молекуле крахмала отсутствуют. Поэтому крахмал не дает реакцию «серебряного зеркала».
Крахмал состоит не только из линейных молекул, но и из молекул разветвленной структуры. Этим объясняется зернистое строение крахмала.
В состав крахмала входят:
- амилоза (внутренняя часть крахмального зерна) — 10-20%;
- амилопектин (оболочка крахмального зерна) — 80-90%.
Амилоза
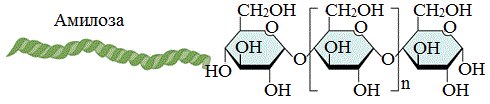
Амилоза растворима в воде и представляет собой линейный полимер, в котором остатки α–глюкозы связаны друг с другом через первый и четвертый атомы углерода (α-1,4-гликозидными связями).
Цепь амилозы включает 200 — 1000 остатков a-глюкозы (средняя мол. масса 160 000) .
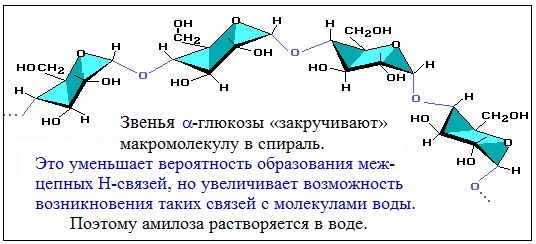
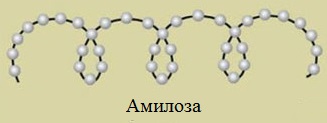
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев a-глюкозы.
Амилопектин
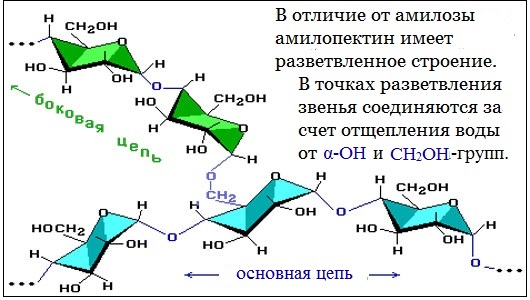
В отличие от амилозы, амилопектин не растворим в воде, и имеет разветвленное строение.
Подавляющее большинство глюкозных остатков в амилопектине связаны, как и в амилозе α-1,4-гликозидными связями. Однако в точках разветвлений цепи имеются α-1,6-гликозидные связи.
Молекулярная масса амилопектина достигает 1-6 млн.
Молекулы амилопектина также довольно компактны, так как имеют сферическую форму.
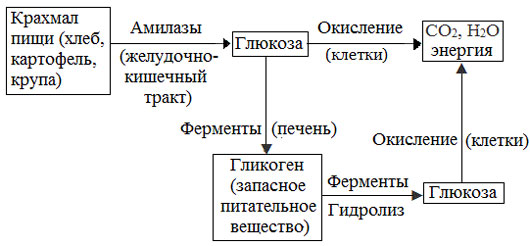
Биологическая роль крахмала. Гликоген
Крахмал – главное запасное питательное вещество растений, основной источник резервной энергии в растительных клетках.
Остатки глюкозы в молекулах крахмала соединены достаточно прочно и в то же время под действием ферментов легко могут отщепляться, как только возникает потребность в источнике энергии.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах.
Гликоген (животный крахмал) – полисахарид, молекулы которого построены из большого числа остатков α–глюкозы. Он имеет сходное строение с амилопектином, но отличается от него большей разветвленностью цепей, а также большей молекулярной массой.
Содержится гликоген главным образом в печени и в мышцах.
Гликоген – белый аморфный порошок, хорошо растворяется даже в холодной воде, легко гидролизуется под действием кислот и ферментов, образуя в качестве промежуточных веществ декстрины, мальтозу и при полном гидролизе – глюкозу.
Превращение крахмала в организме человека и животных
Нахождение в природе
Крахмал широко распространен в природе. Он образуется в растениях в процессе фотосинтезе и накапливается в клубнях, корнях, семенах, а также в листьях и стеблях.
Крахмал содержится в растениях в виде крахмальных зерен. Наиболее богато крахмалом зерно злаков: риса (до 80%), пшеницы (до 70%), кукурузы (до 72%), а также клубни картофеля (до 25%). В клубнях картофеля крахмальные зерна плавают в клеточном соке, в злаках они плотно склеены белковым веществом клейковиной.
Физические свойства
Крахмал – белое аморфное вещество, без вкуса и запаха, нерастворимое в холодной воде, в горячей воде набухает и частично растворяется, образуя вязкий коллоидный раствор (крахмальный клейстер).
Крахмал существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
Химические свойства крахмала
Химические свойства крахмала объясняются его строением.
Крахмал не дает реакцию «серебряного зеркала», однако ее дают продукты его гидролиза.
1. Гидролиз крахмала
При нагревании в кислой среде крахмал гидролизуется с разрывом связей между остатками α-глюкозы. При этом образуется ряд промежуточных продуктов, в частности мальтоза. Конечным продуктом гидролиза является глюкоза:
Процесс гидролиза протекает ступенчато, схематически его можно изобразить так:
Видеоопыт «Кислотный гидролиз крахмала»
Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1811 г. русский ученый К.Кирхгоф (реакция Кирхгофа).
2. Качественная реакция на крахмал
Так как молекула амилозы представляет собой спираль, то при взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения.
Раствор иода окрашивает крахмал в синий цвет. При нагревании окрашивание исчезает (комплекс разрушается), при охлаждении появляется вновь.
Крахмал + J2 – синее окрашивание
Видеоопыт «Реакция крахмала с йодом»
Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба)
3. Большинство глюкозных остатков в молекулах крахмала имеют по 3 свободных гидроксила (у 2,3,6-го атомов углерода), в точках разветвления – у 2-го и 3-го атомов углерода.
Следовательно, для крахмала возможны реакции, характерные для многоатомных спиртов, в частности образование простых и сложных эфиров. Однако эфиры крахмала большого практического значения не имеют.
Качественную реакцию на многоатомные спирты крахмал не дает, так как плохо растворяется в воде.
Получение крахмала
Из растений извлекают крахмал, разрушая клетки и отмывая его водой. В промышленном масштабе его получают главным образом из клубней картофеля (в виде картофельной муки), а также кукурузы, в меньшей степени – из риса, пшеницы и других растений.
Получение крахмала из картофеля
Картофель моют, измельчают и промывают водой и перекачивают в большие сосуды, где происходит отстаивание. Вода извлекает из измельченного сырья крахмальные зерна, образуя так называемое «крахмальное молоко».
Полученный крахмал ещё раз промывают водой, отстаивают и сушат в струе теплого воздуха.
Получение крахмала из кукурузы
Зерна кукурузы замачивают в теплой воде разбавленной сернистой кислоты с целью размягчения зерна и удаления из него основной части растворимых веществ.
Набухшее зерно дробят для удаления ростков.
Ростки, после всплывания на поверхность воды, отделяют и используют в дальнейшем для получения кукурузного масла.
Кукурузную массу повторно измельчают, обрабатывают водой для вымывания крахмала, затем отделяют отстаиванием или с помощью центрифуги.
Применение крахмала
Крахмал широко применяется в различных отраслях промышленности (пищевой, фармацевтической, текстильной, бумажной и т.п.).
Он является основным углеводом пищи человека – хлеба, круп, картофеля.
В значительных количествах перерабатывается на декстрины, патоку и глюкозу, используемые в кондитерском производстве.
Из крахмала, содержащегося в картофеле и зерне злаков, получают этиловый, н-бутиловый спирты, ацетон, лимонную кислоту, глицерин.
Крахмал используется как клеящее средство, применяется для отделки тканей, крахмаления белья.
В медицине на основе крахмала готовятся мази, присыпки и т.д.
Видео:Свойства крахмала. Химический опытСкачать

Химические свойства крахмала подтвердить уравнениями реакций
I. Фильм: “Полисахариды”
II. Физические свойства
Крахмал белый порошок, нерастворимый в холодной воде и образующий коллоидный раствор (крахмальный клейстер) в горячей воде. Существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
III. Нахождение в природе
Крахмал – основной источник резервной энергии в растительных клетках – образуется в растениях в процессе фотосинтеза и накапливается в клубнях, корнях, семенах:
Содержится в клубнях картофеля, зёрнах пшеницы, риса, кукурузы.
Гликоген (животный крахмал), образуется в печени и мышцах животных.
IV. Строение
Состоит из остатков α — глюкозы.
В состав крахмала входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 – 1000 остатков α-глюкозы и имеет неразветвленное строение.
Амилопектин состоит из разветвленных макромолекул, молекулярная масса которых достигает 1 — 6 млн.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах. Поэтому крахмал – необходимый резервный углевод питания.
Подобно амилопектину построен гликоген (животный крахмал), макромолекулы которого отличаются большей разветвлённостью:
V. Применение
Крахмал широко применяется в различных отраслях промышленности (пищевой, бродильной, фармацевтической, текстильной, бумажной и т.п.).
- Ценный питательный продукт.
- Для накрахмаливания белья.
- В качестве декстринового клея.
VI. Химические свойства полисахаридов
1. Гидролиз
Гидролиз протекает ступенчато:
Охлаждённый крахмальный клейстер + I2 (раствор) = синее окрашивание, которое исчезает при нагревании.
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев α-глюкозы.
При взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения. Это соединение имеет характерный синий цвет. Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба)
Видео:Крахмал. Целлюлоза. 11 класс.Скачать

Урок химии с ИКТ «Крахмал»
Разделы: Химия
Цели урока:
- изучение строения макромолекул крахмала, физических и химических свойств и применения крахмала;
- развитие практических навыков, умения сравнивать и выделять основные признаки в строении и свойствах;
- развитие познавательного интереса, коммуникативных качеств;
- воспитание положительного интереса, познавательности и культуры умственного труда.
Тип урока: Изучение нового материала.
Вид урока: Комбинированный урок.
Методы
- обучения: показательный, диалогический;
- преподавания: программируемый, объяснительный;
- учения: практический, частично-поисковый.
Оборудование урока: учебник «Органическая химия» под ред. И.И. Новошинского, видеопроектор, интерактивная доска, компьютер, мультимедийная программа, образец крахмала, вода, йод, пробирки, штативы для пробирок.
Видео:10 класс Химические свойства, получение и применение крахмалаСкачать

Ход урока
I. Организационная часть.
II. Проверка домашнего задания.
III. Изучение учебного материала по плану с использованием презентации.
План урока:
- Строение молекулы крахмала.
- Физические свойства.
- Нахождение в природе.
- Химические свойства.
- Крахмал как питательное вещество.
- Применение крахмала.
1. Строение макромолекул крахмала
(демонстрация слайда «Строение молекулы крахмала»)
Крахмал – это природный полимер, его молекулярная формула (C6 H10O5)п. Исследования показали, что крахмал представляет собой продукт, состоящий из двух полимерных веществ: растворимой в воде амилозы (20%) и нерастворимого в воде амилопектина (80%).
Крахмал образуется в результате фотосинтеза при поглощении энергии солнечного излучения.
Сначала синтезируется глюкоза:
Глюкоза далее превращается в крахмал:
Макромолекулы крахмала различны по размерам и по строению: число звеньев C6H10O5 в составе различно, поэтому неодинакова и их молекулярная масса. Ученым удалось доказать, что макромолекулы крахмала состоят из остатков молекул циклической α – глюкозы.
2. Физические свойства (демонстрация образца крахмала)
Крахмал – белый, нерастворимый в воде порошок, встречается в виде зерен, форма и размеры которых характерны для каждого рода растений. В холодной воде он набухает и образует гель. В горячей воде он образует коллоидный раствор – клейстер. Эти свойства крахмала определяют области его применения (демонстрация слайда «Физические свойства»).
3. Нахождение в природе.
Крахмал – одно из важнейших питательных веществ для человека. Крахмал чрезвычайно распространен в растительном мире. Для различных растений он является запасным питательным материалом и содержится главным образом в плодах, семенах и клубнях. Картофель содержит около 24% крахмала, зерна пшеницы и кукурузы – около 72-75%, риса – около 86% (демонстрация слайда «Нахождение в природе»).
4. Химические свойства.
а) Гидролиз крахмала
б) Качественная реакция крахмала с йодом
(лабораторный опыт или компьютерный эксперимент)
(демонстрация слайда « Химические свойства»).
5. Крахмал как питательное вещество (сообщения учащихся).
Для организма человека крахмал служит основным поставщиком углеводов – одного из важнейших компонентов пищи. Под действием ферментов крахмал гидролизуется до глюкозы, которая окисляется в клетках до углекислого газа и воды с выделением энергии, необходимой для функционирования живого организма. Из продуктов питания наибольшее количество крахмала содержится в хлебе, макаронных и других мучных изделиях, крупах, картофеле.
6. Применение крахмала (сообщения учащихся).
В значительных количествах крахмал перерабатывается на декстрины, патоку и глюкозу, используемые в пищевой промышленности. Из продуктов гидролиза получают пищевой спирт, молочную кислоту и другие ценные продукты. Крахмал используют как клеящее средство, применяют для отделки тканей, в медицине на основе крахмала готовят некоторые мази и присыпки.
IV. Закрепление изученного материала (демонстрация слайда «Вопросы»).
1. Составьте уравнения реакций получения молочной кислоты, исходя из крахмала:
Как называются реакции 1 и 2?
2. Сок зеленого яблока дает реакцию с йодом. Сок спелого яблока восстанавливает аммиачный раствор оксида серебра. Как объяснить эти явления?
3 Проверка знаний по тестам (Приложение 4)
V. Итог урока.
Домашнее задание: гл.6, §30 читать
Библиография использованных ресурсов:
- Угринович Н.Д. Информатика и информационные технологии. – М.: лаборатория базовых знаний, 2002.
- Киселев С.В., Куранов В.П. Оператор ЭВМ. – М.:ИПРО, Издательский цент «Академия», 2000.
- Учебное электронное издание» Химия» (8-11 класс) «Виртуальная лаборатория», лаборатория систем мультимедиа, МарГТУ, 2004.
- Мультимедийное учебное пособие нового образца, издательство «Просвещение», 2004.
- Новошинский И.И. Органическая химия. – Москва, Русское слово, 2009.
📽️ Видео
Химия 10 класс (Урок№11 - Полисахариды. Крахмал. Целлюлоза.)Скачать

Опыты по химии. Гидролиз крахмалаСкачать

Крахмал и целлюлоза. Химические свойства. Все 4 реакции ЕГЭ.Скачать

10 класс. Химия. Химические свойства, получение и применение крахмалаСкачать

Органика. Крахмал. 10 классСкачать

Химия-Практическая работа. Взаимодействие крахмала с йодом и гидролиз крахмала.Скачать

Химические свойства, получение и применение крахмалаСкачать

Полисахариды. Крахмал. ЦеллюлозаСкачать

Химия. 11 класс. Крахмал /10.03.2021/Скачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

52. Сахароза. Крахмал. Целлюлоза (часть 3)Скачать

№10 кач реакции на крахмал, пектин и целлюлозуСкачать

39 Из бесцветного – синий,или иод и крахмал находят друг другаСкачать

Как определить наличие крахмала в продуктах?Скачать

Опыты по химии. Получение коллоидного раствора крахмалаСкачать

10 класс § 60 "Химические свойства моносахаридов"Скачать

Химия. Моносахариды. Дисахариды. Полисахариды Лаб.работа №8 .Скачать