Перед изучением этого раздела рекомендую прочитать следующую статью:
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н + (или Н3О + ).
По растворимости в воде кислоты можно поделить на растворимые и нерастворимые . Некоторые кислоты самопроизвольно разлагаются и в водном растворе практически не существуют (неустойчивые) . Подробно про классификацию кислот можно прочитать здесь.
- Получение кислот
- Химические свойства кислот
- Кислоты как электролиты, их классификация по различным признакам.
- Презентация по теме «Химические свойства кислот как электролитов»
- Описание презентации по отдельным слайдам:
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Материал подходит для УМК
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- 🔍 Видео
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Получение кислот
1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
Например , оксид серы (VI) реагирует с водой с образованием серной кислоты:
При этом оксид кремния (IV) с водой не реагирует:
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
Например , хлор реагирует с водородом:
H2 0 + Cl2 0 → 2 H + Cl —
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например , электролиз раствора сульфата меди (II):
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Например , концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
Видео:Свойства кислот с точки зрения теории электролитической диссоциации. 9 класс.Скачать
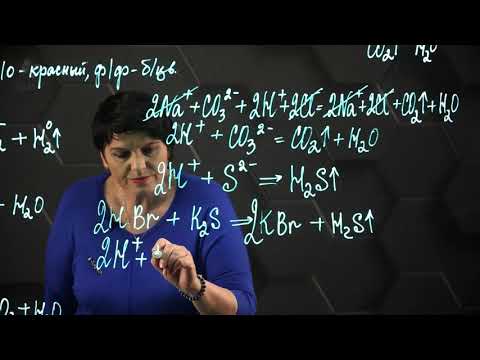
Химические свойства кислот
1. В водных растворах кислоты диссоциируют на катионы водорода Н + и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
Например , соляная кислота диссоциирует почти полностью:
HCl → H + + Cl –
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O + + Cl –
Многоосновные кислоты диссоциируют cтупенчато.
Например , сернистая кислота диссоциирует в две ступени:
HSO3 – ↔ H + + SO3 2–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
3. Кислоты реагируют с основаниями и основными оксидами .
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
Например , гидроксид меди (II) взаимодействует с растворимой бромоводородной кислотой:
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
Щёлочи взаимодействуют с любыми кислотами — и сильными, и слабыми . При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации . Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например , гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
Например , уксусная кислота взаимодействует с гидроксидом алюминия:
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
Например , йодоводород можно окислить хлоридом меди (II):
4H I — + 2 Cu +2 Cl2 → 4HCl + 2 Cu + I + I2 0
6. Кислоты взаимодействуют с солями.
Кислоты реагируют с растворимыми солями только при условии, что в продуктах реакции присутствует газ, вода, осадок или другой слабый электролит . Такие реакции протекают по механизму ионного обмена.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Например , соляная кислота взаимодействует с нитратом серебра в растворе:
Ag + NO3 — + H + Cl — → Ag + Cl — ↓ + H + NO3 —
Кислоты реагируют и с нерастворимыми солями. При этом более сильные кислоты вытесняют менее сильные кислоты из солей .
Например , карбонат кальция (соль угольной кислоты), реагирует с соляной кислотой (более сильной, чем угольная):
7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
Например , гидрокарбонат калия реагирует с соляной кислотой с образованием хлорида калия, углекислого газа и воды:
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример : гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Например , гидроксокарбонат меди (II) растворяется в серной кислоте:
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Например , гидроксохлорид алюминия взаимодействует с соляной кислотой:
Al (OH) Cl2 + HCl → AlCl3 + H2O
8. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Например , железо взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe + 2 H + Cl → Fe +2 Cl2 + H2 0
Сероводородная кислота H2S, угольная H2CO3, сернистая H2SO3 и кремниевая H2SiO3 с металлами не взаимодействуют.
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
9. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
Азотная кислота HNO3 разлагается при нагревании или на свету:
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Кислоты как электролиты, их классификация по различным признакам.
Кислотами называют сложные вещества, молекулы которого состоят из атомов водорода и кислотного остатка.
Вспомним, что мы уже знаем о кислотах и их классификации.
Мы выяснили, что классификаций кислот несколько, как и признаков классификации. Но какими бы разными они не были, все кислоты при диссоциации образуют катионы водорода, которые и обуславливают ряд общих свойств: кислый вкус, изменение окраски индикаторов (демонстрационный эксперимент кислота + индикаторы), взаимодействие с другими веществами. На прошлых уроках мы познакомились с вами с ТЭД, поэтому давайте запишем определение кислот с позиции этой теории.
Кислотами называют электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка.
Самостоятельная работа с учебником: Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов, страница 73. – рассмотреть классификацию кислот.
Химические свойства кислот в свете теории электролитической диссоциации.
Основные химические свойства рассматриваются в виде схемы представленной в учебнике:
1. Кислота + металл → соль + водород
Данные реакции идут при выполнении нескольких условий:
если металлы стоят в ряду активности металлов до водорода;
в результате реакции должна получаться растворимая соль, если образуется нерастворимая соль то на поверхности металла образуется плёнка из этой соли, которая прекращает доступ кислоты к металлу;
нерастворимая кремниевая кислота не взаимодействует с металлами;
особо взаимодействуют с металлами азотная и концентрированная серная кислоты, но об этом мы будем говорить в 9 классе.
Al 0 + 6H + + 3SO4 2- = 2Al 3+ + 3SO4 2- + H2↑
2. Кислота + основание → соль + вода (реакция нейтрализации)
Эта реакция универсальна и протекает между любой кислотой и между любым основанием.
НCl + NaOH = NaCl + Н2О
H + + Cl — + Na + + OH — = Na + + Cl — + Н2О
Реакцию между нерастворимым основанием и кислотой предлагается написать ребятам самостоятельно (молекулярное, полное и сокращённое ионное) первый составивший получает оценку:
3. Кислота + оксид металла → соль + вода
При составлении данного уравнения обратить внимание обучающихся на то, что оксиды металлов не являются электролитами, поэтому в ионном уравнении его записывают в молекулярном виде (мультимедийное учебное пособие “Химия.8 класс” №5, 6).
CuO + 2H + = Cu 2+ + 2H2O
Данный тип реакций идёт в случае образования растворимой соли, если образуется нерастворимая соль, то на поверхности металла образуется плёнка из этой соли, которая прекращает доступ кислоты к оксиду.
4. Кислота + соль → новая кислота + новая соль
Взаимодействие кислот с солями типичная реакция обмена и протекает по тем же закономерностям, т.е. в случае образования осадка, газа или слабого электролита.
Особенности взаимодействия концентрированной серной и азотной кислот с металлами.
Самостоятельная работа с учебником: Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов, страница 74.
Основные способы получения кислоты.
— бескислородные кислоты получают взаимодействием водорода с неметаллами (с последующим растворением в воде):
— — взаимодействие кислотных оксидов с водой:
N2O5 + H2O = 2HNO3;
P2O5 + 3H2O = 2H3PO4;
— — взаимодействие солей с кислотами (действием сильной или менее летучей кислоты на соль более слабой кислоты или более летучей кислоты):
H2SO4 + NaCl(ТВ) = HCl + NaHSO4;
Na2SiO3 + 2HCl = H2SiO3¯ + 2NaCl;
— — окисление простых веществ:
2P + 5HNO3 + 2H2O = 3H3PO4 + 5NO;
Br2 + 5Cl2 + 6H2O = 2HBrO3 + 10HCl.
Вопросы для самоконтроля
¾ Дайте определение классу кислот.
¾ Кислот достаточно много, а можно ли их классифицировать.
¾ Какие вы знаете классификации.
¾ На какие группы делятся кислоты по составу, по основности, по силе (приведите примеры).
¾ Перечислите основные физические свойства, присущие практические всем неорганическим кислотам.
¾ Какие вещества реагируют друг с другом? Выберите правильные ответы:
а) CuO + HCl = …;
б) Cu + HCl = …;
в) CuSO4 + HCl = …;
г) CuCO3 + HCl = …
¾ Напишите уравнения возможных реакций (молекулярные и сокращённые ионные.
¾ Какие вещества реагируют друг с другом? Выберите правильные ответы:
¾ Напишите уравнения возможных реакций (молекулярные и сокращённые ионные.
¾ Отвечать на вопросы учебника: Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов, страница 77.
ПЛАН ЗАНЯТИЯ № 14
Дисциплина: Химия.
Тема:Основания.
Цель занятия: закрепить знания обучающихся о свойствах, способах получения и классификации оснований.
Предметные: сформированность представлений о месте химии в современной научной картине мира; владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
Метапредметные: использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
Личностные: готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом;
Норма времени:2 часа
Вид занятия:Лекция.
План занятия:
1. Основания как электролиты, их классификация по различным признакам.
2. Химические свойства оснований в свете теории электролитической диссоциации. Разложение нерастворимых в воде оснований.
3. Основные способы получения оснований.
Оснащение:Учебник.
Литература:
1. Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил..
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 — изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.
Тема 14. Основания.
1. Основания как электролиты, их классификация по различным признакам.
2. Химические свойства оснований в свете теории электролитической диссоциации. Разложение нерастворимых в воде оснований.
Видео:Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать

Презентация по теме «Химические свойства кислот как электролитов»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Описание презентации по отдельным слайдам:
9 класс
Химические свойства кислот как электролитов
Выполнила: учитель химии ГБОУ СОШ №443 Жирова Ю.А.- первая категория
9-й урок
Из списка выберите кислоты
Na2SO4, LiOH, HNO2 , Na2O, H3PO4, SO3, Н2СО3 , Са(ОН)2, ВаО, H2SiO3
Вспомним! Кто такие кислоты?
HNO2, H3PO4, Н2СО3 , H2SiO3
Вспомним! Кто такие электролиты?
HnAcd = nH+ + Acdn-
Вспомним! Общее уравнение электролитической диссоциации?
Где:
Acd – кислотный остаток
Кислоты — это электролиты, которые диссоциируют с образованием катионов водорода и анионов кислотных остатков.
Общие химические свойства кислот
1. Обладают кислым вкусом
2. Изменяют окраску индикаторов
лакмус
метилоранж
фенолфталеин
Действие кислот на индикаторы
Химические свойства кислот
3. Взаимодействие с основаниями с образованием соли и воды
ОПЫТ
Запишем уравнения проведённых реакций
2NaOH + H2SO4 = Na2SO4 + 2H2O
Запись уравнения реакций с помощью формул веществ называют молекулярным уравнением
реакции
Однако, в растворе вещества диссоциируют на ионы и взаимодействия происходят между ионами
Перепишем молекулярное уравнение следующим образом:
формулы сильных электролитов запишем в виде ионов,
а формулы неэлектролитов оставим в молекулярном виде
2Na+ + 2OH-
2NaOH + H2SO4 = Na2SO4 + 2H2O
+ 2H+ +SO4 2- =
2Na+ +2SO42-
+ 2H2O
Такую запись называют полным ионным уравнением
реакции
2Na+ + 2OH- + 2H+ +SO4 2- = 2Na+ +2SO42- + 2H2O
2OH- + 2H+ = 2H2O
Таким образом получают сокращенное ионное уравнение
реакции
2OH- + 2H+ = 2H2O
Катион водорода взаимодействует с гидроксид-анионами с образованием воды
Это значит, что протекает реакция
нейтрализации
кислотная
среда
щелочная
среда
нейтральная
среда
Реакции обмена, протекающие в растворах с участием сильных электролитов, называют реакциями ионного обмена.
Взаимодействие кислот с нерастворимым основанием
ОПЫТ
М(OH)n↓ + сильная кислота (nH+ + Acdn-) → Мn+ + 2H2O
Cu(OH)2 ↓ + 2HCl = CuCl2 + 2H2O
Cu(OH)2 ↓ + H2SO4 = CuSO4 + 2H2O
Cu(OH)2 ↓ + 2HNO3 = Cu(NO3)3 + 2H2O
Всем трём молекулярным уравнениям соответствует одно сокращённое ионное уравнение
Cu(OH)2↓ + 2H+ = Cu2+ + 2H2O
Всем трём молекулярным уравнениям соответствует одно сокращённое ионное уравнение
9 класс
Химические свойства кислот как электролитов
Выполнила: учитель химии ГБОУ СОШ №443 Жирова Ю.А.- первая категория
10-й урок
4. Взаимодействие с оксидами металлов с образованием соли и воды
ОПЫТ
MO + сильная кислота (nH+ + Acdn-) → Mn+ + 2H2O
CuO + 2HCl = CuCl2 + H2O
CuO + H2SO4 = CuSO4 + H2O
CuO + 2HNO3 = Cu(NO3)3 + H2O
Всем трём молекулярным уравнениям соответствует одно сокращённое ионное уравнение
CuO + 2H+ = Cu2+ + H2O
Всем трём молекулярным уравнениям соответствует одно сокращённое ионное уравнение
5. Взаимодействие с металлами с образованием соли и водорода
Из сильных кислот по-особому взаимодействуют с металлами концентрированная серная кислота и азотная кислота любой концентрации.
Будучи сильными электролитами, эти вещества в растворе существуют не в виде молекул, а в виде ионов:
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
M + сильная кислота (nH+ + Acdn-) → Mn+ + H2↑
Ионное уравнение этого процесса:
Zn + 2H+ = Zn2+ + H2↑
Запишите молекулярные уравнения реакций:
между цинком и соляной кислотой
между цинком и серной кислотой
Электрохимический ряд напряжений металлов
Возможность протекания такой реакции определяется положением металла в ряду активности – электрохимическом ряду напряжений металлов
Активность металлов уменьшается
Условия реакции:
1)
Условия реакции:
2)
В результате этой реакции должна образоваться растворимая соль.
Условия реакции:
3)
С металлами IA- и IIA- групп не записывают, т.к.эти металлы одновременно взаимодействуют и с водой, образуя щёлочь и водород.
6. Взаимодействие с солями с образованием другой соли и другой кислоты
Реакция между растворами электролитов возможна только в том случае, если образуется газ, осадок или слабый электролит (вода)
Правило Бертоле:
1. Выделение газа
Na2CO3 = 2Na+ + CO32-
2H+ + CO32- = H2O + CO2↑
Сокращённое ионное уравнение для всех карбонатов
2. Выпадение осадка
2H+ + SiO32- = H2SiO3 ↓
2HCl + Na2SiO3= H2SiO3 ↓ + 2NaCl
§ 6, читать до конца, упр.4-6
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 952 человека из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 49 человек из 30 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 33 человека из 19 регионов
Ищем педагогов в команду «Инфоурок»
Видео:Химия. 9 класс. Химические свойства кислот с точки зрения теории электролитической диссоциацииСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 565 451 материал в базе
Материал подходит для УМК
«Химия», Габриелян О.С., Остроумов И.Г., Сладков С.А.
§ 6. Химические свойства кислот как электролитов
Другие материалы
- 10.10.2021
- 358
- 0
- 10.10.2021
- 236
- 7
- 10.10.2021
- 151
- 6
- 10.10.2021
- 76
- 3
- 10.10.2021
- 180
- 10
- 10.10.2021
- 84
- 8
- 10.10.2021
- 457
- 7
- 10.10.2021
- 64
- 5
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 10.10.2021 742
- PPTX 926.1 кбайт
- 79 скачиваний
- Рейтинг: 5 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Жирова Юлия Александровна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 6 лет и 4 месяца
- Подписчики: 3
- Всего просмотров: 7221
- Всего материалов: 17
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Химические свойства кислот. 7 класс.Скачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В Рособрнадзоре рассказали, как будет меняться ЕГЭ
Время чтения: 2 минуты
Объявлен конкурс дизайн-проектов для школьных пространств
Время чтения: 2 минуты
ЕГЭ в 2022 году будут сдавать почти 737 тыс. человек
Время чтения: 2 минуты
Профессия педагога на третьем месте по популярности среди абитуриентов
Время чтения: 1 минута
Онлайн-конференция о создании школьных служб примирения
Время чтения: 3 минуты
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
🔍 Видео
кислоты как электролиты/химия 9 классСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Химия-9. Параграф 6. Химические свойства кислот как электролитов.Скачать

9 класс. Химия. ОГЭ. Химические свойства кислот как электролитов.Скачать

8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

47. Химические свойства кислотСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Кислоты | Химия ОГЭ 2023 | УмскулСкачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

практическая работа 2 "Свойства кислот, оснований солей как электролитов"Скачать















