Карбонат натрия Na2CO3 — соль щелочного металла натрия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 105,99; относительная плотность для тв. и ж. состояния d = 2,539; tпл = 851º C;
Видео:Химия | Молекулярные и ионные уравненияСкачать

Способ получения
1. Карбонат натрия можно получить путем взаимодействия оксида натрия и углекислого газа:
2. В результате взаимодействия концентрированного раствора гидроксида натрия и углекислого газа образуется карбонат натрия и вода:
3. При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Качественная реакция
Качественная реакция на карбонат натрия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат натрия образует хлорид натрия, углекислый газ и воду:
2. Взаимодействуя с серной кислотой, карбонат натрия образует углекислый газ и воду, а также сульфат натрия:
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Химические свойства
1. Карбонат натрия может реагировать с простыми веществами :
1.1. Карбонат натрия при 900–1000º C реагирует с углеродом . При этом образуется натрий и угарный газ:
Na2CO3 + 2C(кокс) = Na + 3CO
1.2. С хлором концентрированный и горячий раствор карбоната натрия реагирует с образованием хлорида натрия, хлората натрия и углекислого газа:
2. Карбонат натрия вступает в реакцию со многими сложными веществами :
2.1. Насыщенный карбонат натрия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната натрия:
2.2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
2.3. При взаимодействии с разбавленной хлороводородной кислотой карбонат натрия образует хлорид натрия, углекислый газ и воду:
2.4. Карбонат натрия реагирует с разбавленной плавиковой кислотой . Взаимодействие карбоната натрия с плавиковой кислотой приводит к образованию фторида натрия, воды и углекислого газа:
2.5. Концентрированный раствор карбоната натрия взаимодействует с оксидом серы . При этом образуются карбонат натрия и углекислый газ:
Видео:Ионные уравнения | Химия 8 класс #42 | ИнфоурокСкачать

Химические свойства карбонатов ионное уравнение
Ключевые слова конспекта: ионные соединения, карбонаты, силикаты, сода, гидролиз, гашение соды, приготовление теста.
Как и большинство солей, карбонаты и силикаты можно отнести к ионным соединениям.
Формулы для силикатов Men(SiO3)m отражают только соотношение элементов, но не истинный состав силикат-анионов, который, как и в случае с кремниевой кислотой, более сложен.
При обычных условиях карбонаты и силикаты – твёрдые вещества, бесцветные, если катион металла не даёт характерную окраску. В воде растворимы только карбонаты и силикаты щелочных металлов (кроме Li) и (NH4)2CO3. Гидрокарбонаты металлов, в которых катионы имеют заряд 2+, как правило, лучше растворимы в воде, чем карбонаты.
Химические особенности карбонатов и силикатов
- Растворимые карбонаты и силикаты подвергаются гидролизу в водных растворах:
Na2CO3 + H2O ⇆ NaHCO3 + NaOH
CO3 2– + H2O ⇆ НСО3 – + OH –
При обычных условиях гидролиз протекает преимущественно по I ступени.
- Карбонаты и растворимые силикаты взаимодействуют с более сильными кислотами.
В быту часто проводится реакция гашения соды, когда готовят тесто. Питьевую соду NaHCO3 обрабатывают уксусом (раствором уксусной кислоты):
NaHCO3 + СH3СООН = CH3COONa + CO2↑ + H2O
НСO3 – + СH3СООН = CO2↑ + H2O + CH3COO –
В этой реакции уксусная кислота вытесняет из соли слабую и летучую угольную кислоту, которая разлагается на углекислый газ и воду. Образующийся углекислый газ поднимает тесто.
С сильными кислотами взаимодействуют и растворимые силикаты, при этом образуется гель кремниевой кислоты переменного состава. Условно этот процесс можно отразить с помощью ионного уравнения:
S1O3 – + 2Н + = H2SiO3↓
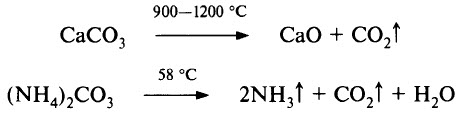
- Карбонаты разлагаются при нагревании:
Более устойчивы к нагреванию карбонаты щелочных металлов, они плавятся без разложения (кроме Li2СO3) при 800–900 °С и разлагаются при температуре около 1000 °С. Вообще, термическая устойчивость карбонатов изменяется в широких пределах. Например, ВеСО3 разлагается при температуре ниже 100 °С, а у ВаСO3 полная диссоциация наблюдается при 1300 °С.
Наиболее известными карбонатами являются: Na2CO3 – сода кальцинированная, Na2CO3 • 10H2O – сода кристаллическая, К2СО3 – поташ. Соединение MgCO3 образует минерал магнезит, а СаСО3 – известняк, мел, мрамор, кальцит (исландский шпат), (СuОН)2СО3 образует малахит. Концентрированный раствор силиката натрия Na2SiO3 используется как силикатный клей.
Конспект урока по химии «Карбонаты и силикаты». Выберите дальнейшее действие:
Ещё конспекты по теме «Углерод и кремний«:
Видео:8 класс химические свойства оксидов, оснований, кислот, солей и ионные уравненияСкачать

ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНАТОВ
Дата добавления: 2013-12-23 ; просмотров: 13967 ; Нарушение авторских прав
Взаимодействует с основаниями
Взаимодействует с основными и амфотерными оксидами
Взаимодействует с металлами
Разлагается при нагревании и в момент выделения
Действием кислот на карбонаты
Брожение глюкозы
Разложение известняка
Сжигание угля в избытке кислорода
Проявляет окислительные свойства, реагируя с сильными восстановителями
СO2 + Mg t→ MgO + C
5) Растворяется в расплавленных щелочах(с растворами не реагирует)
СО + NaOH P→ HCOONa формиат натрия
ПОЛУЧЕНИЕ CO2
Образуется при дыхании (в выдыхаемом воздухе содержится 4 % СО2), горении, гниении
В лаборатории
Разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты(отнимает воду)
ПРИМЕНЕНИЕ CO2
1. Получение соды, мочевины;
2. Для тушения пожаров – сжиженным углекислым газом заполняют углекислотные огнетушители;
3. Для газирования напитков;
4. Для замораживания скоропортящихся продуктов (температура сухого льда –80 °С);
5. В пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
УГОЛЬНАЯ КИСЛОТА H2СО3
Существуеттолько в растворе. Является слабой кислотой. Разлагается при нагревании и в момент образования:
ХИМИЧЕСКИЕ СВОЙСТВА H2СО3
H2СО3 проявляет типичные свойства кислот
H2CO3 →← СО2↑ + H2O нагреванием можно удалить весь СО2 из раствора
H2СО3 проявляет типичные свойства кислот:
Соли H2СО3 – КАРБОНАТЫ и ГИДРОКАРБОНАТЫ
Это белые кристаллические вещества. Все гидрокарбонаты и карбонаты щелочных металлов и аммония растворимы. Остальные карбонаты – нерастворимы.
1) Разлагаются при нагревании(кроме карбонатов щелочных металлов)
2) При пропускании СО2 через раствор карбоната образуется гидрокарбонат
| | | следующая лекция ==> | |
| Взаимодействует с аммиаком | | | Киев — 2008. |
Не нашли то, что искали? Google вам в помощь!
🎥 Видео
СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Химия 9 класс (Урок№19 - Угольная кислота.)Скачать

Реакции ионного обмена. 9 класс.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Карбонаты и гидрокарбонаты. Способы получения и химические свойства | ХимияСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Реакции ионного обменаСкачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Реакции ионного обмена. 9 класс.Скачать

Химия. КарбонатыСкачать

Габриелян О. С. 8 класс §38 "Ионные уравнения"Скачать

Качественная реакция на сульфат- и карбонат-ионы.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания | Как составлять молекулярные и ионные уравненияСкачать