Ключевые слова: кадмий элемент, история открытия кадмий элемента ,кадмий элемент в природе, получение кадмия элемента, применение кадмия, токсичность кадмия и его соединений, физические и химические свойства кадмия элемента, соединения кадмия элемента: оксид кадмия, гидроксид кадмия, карбонат кадмия, молибдат кадмия, нитрат кадмия, сульфат кадмия, сульфид кадмия.

ИСТОРИЯ ОТКРЫТИЯ
Кадмий элемент был открыт в 1817 г. Фридрихом Штромейером, профессором химии и фармации в Геттингенском университете .При инспекции аптек Штромейер обратил внимание на то, что при прокаливании некоторых образцов карбоната цинка образуется не белый, а оранжево-желтый или коричневый оксид, который, однако, не содержит ни железа, ни свинца. Он предположил, что такая необычная окраска вызвана присутствием какого-то постороннего элемента. Специальной обработкой Штромейер отделил оксид неизвестного элемента от соединений меди и пинка, а затем восстановил его до металла.
Независимо от Штромейера и почти в то же время кадмий в соединениях цинка открыли К. Херман из Шонебека и И. Ролофф из Магдебурга ( они обнаружили новый элемент в оксиде цинка, раствор которого давал с сероводородом вместо белого — желтый осадок), а также В. Мейсснер из Галле и С. Карстен из Берлина. Более поздние исследования подтвердили наличие неизвестного элемента (кадмия) во многих образцах металлического цинка и его соединений и позволили получить из них оксид металла и выделить его в чистом виде .По свидетельству Гомера, цинковую руду, добавляемую к меди при выплавке латуни, именовали в Древней Греции к а д м е й я . Поэтому Штромейер открытому в соединениях цинка новому элементу дал название «кадмий» . В русской химической литературе первой половины XIX в. кадмий нередко называли кадмом, за рубежом для него в первое время предлагали и другие названия: меллиний, клапротий и юноний .
КАДМИЙ ЭЛЕМЕНТ В ПРИРОДЕ.
Содержание элемента кадмия в литосфере составляет 1,5∙ 10 -5 весовых %, в метеоритах 1∙10 -5 %. Кадмий образует ограниченное число природных соединений. Основной его минерал — гринокит, гексагональный CdS (77,6% Cd) открыл в 1841 г. Кеткарт, лорд Гринок . Гринокит не образует естественных скоплений и встречается обычно лишь в виде землистой корочки на цинковых минералах. Гринокит находят в зоне окисления некоторых сульфидных месторождений Центрального Казахстана, Средней Азии и Южного Урала . Известны еще два сульфида кадмия — кубический—хоулиит и аморфный, содержащий воду, ксантохроит . Очень редки другие минералы кадмия: монтепонит — CdO (87,5% Cd), отавит — CdCО3 (65,3% Cd) и кадмоселит — CdSe (47,00% Cd) . В различных типах пород присутствует 1∙10 -6 —6∙10 -5 % кадмия .
ПОЛУЧЕНИЕ КАДМИЯ.
Основное сырье для получения элемента кадмия — отходы цинкового, свинцового и медного производств: пыли при обжиге цинковых концентратов, пыли свинцовоплавильных печей, медно-кадмиевые кеки цинковых электролитных заводов, остатки литопонного производства. Содержание кадмия в этих продуктах может достигать 30—40% (например, в кадмиевой фракции при ректификации цинка). Наряду с элементом кадмием цинковые и свинцовые концентраты содержат Ga, Ge, In, TI, Se и Те; содержание последних двух элементов в свинцовых концентратах достигает сотых (селена — даже десятых) долей процента.
Первые упоминания о промышленном производстве кадмия (в Верхней Силезии) относятся к 1829 г.; до 1870 г. оно не превышало 125 кг в год. В начале XX в. был разработан гидроэлектрометаллургический способ получения кадмия, и к 1925 г. его выпуск возрос с десятков до сотен тонн.Производство металлического кадмия обычно включает следующие основные стадии: выщелачивание сырья, очистку растворов от основной массы посторонних элементов, электролитическое осаждение кадмия или его цементацию на цинке, плавку выделенной губки, рафинирование и получение металла высокой чистоты.При извлечении кадмия из полу-продуктов свинцово-цинкового производства применяют амальгамные способы — цементацию амальгамой цинка и ее последующее анодное окисление, в результате чего получают продукт с содержанием 99,95%Cd.
ПРИМЕНЕНИЕ КАДМИЯ.
Основное техническое применение кадмия элемента (более половины его мирового производства) заключается в антикоррозионном покрытии металлов; около 20% расходуется на антифрикционные сплавы, до 10% используют для производства солей кадмия. Кадмирование стальных изделий предохраняет их от коррозии значительно эффективнее, чем никелирование, цинкование и лужение; подшипники с кадмий -содержащими сплавами имеют преимущества при работе в условиях больших скоростей вращения, высоких температур и давлений. Многочисленные легкоплавкие эвтектики кадмия с другими металлами применяют в автоматических противопожарных устройствах, в виде плавких предохранителей и в качестве припоев; ими можно паять железо, латунь, нейзильбер, олово, свинец и цинк.
Добавление кадмия элемента в медные сплавы также повышает их механическую прочность, жароустойчивость и сопротивление коррозии; введение циркония увеличивает и твердость; такие сплавы используют в линиях высоковольтных передач. В платино-железных сплавах кадмий служит для изготовления часовых пружинок, а со свинцом и оловом — для типографских клише .
Наряду с бором, гафнием, золотом и некоторыми редкоземельными элементами металлический кадмий высокой чистоты применяют в атомной промышленности в качестве поглотителя тепловых нейтронов. Употребление в ювелирном деле основано на способности кадмия придавать изделиям из драгоценных металлов различные оттенки («зеленое» золото); он входит также в некоторые составы монетного серебра . Кадмиевые электроды используют в элементах Вестона и в кислотных аккумуляторах, а с железом и никелем — в щелочных. Металлический кадмий широко применяется в военном деле, входит в состав смесей для дымовых завес и добавляется к металлам цериевой группы в пирофорных сплавах .
Соли кадмия элемента также широко применяют в стеклоделии, в фотографии, в производстве люминофоров и силиконовых каучуков, в качестве катализаторов в органическом синтезе, а так же красок различных цветов (от цвета слоновой кости до малинового). Антимониды, арсениды, селениды, сульфиды и теллуриды кадмия (для синтеза используют 99,99999%-ный Cd) обладают полупроводниковыми свойствами и применяются в фотоэлектрических и электронно-оптических приборах, — в качестве материала для фототранзисторов и фотоэлементов.
ТОКСИЧНОСТЬ КАДМИЯ И ЕГО СОЕДИНЕНИЙ.
Соединения элемента кадмия, независимо от их агрегатного состояния (пыль, дым окиси кадмия, нары, туман), ядовиты. Отравления кадмием могут происходить при нагревании металла или его сплавов, плавке руд и при производстве и применении красок и сплавов, в состав которых он входит. По своей токсичности кадмий аналогичен ртути или мышьяку. Менее растворимые соединения его действуют в первую очередь на дыхательные пути и желудочно-кишечный тракт, а более растворимые — после всасывания в кровь — поражают центральную нервную систему (сильное отравление), вызывают дегенеративные изменения во внутренних органах (главным образом — в печени и почках) и нарушают фосфорно-кальциевый обмен. Механизм токсического действия кадмия заключается, по-видимому, в связывании карбоксильных, аминных и особенно сульфгидрильных групп белковых молекул, в результате чего угнетается активность ферментных систем. В связи с ядовитостью элемента кадмия и его соединений их контакт с пищевыми продуктами недопустим .
ФИЗИЧЕСКИЕ СВОЙСТВА КАДМИЯ
Плотность металлического кадмия при 0° К равняется 9,65 г/см 3 , в нормальных условиях .Кадмий существует в трех различных модификациях, неразличимых структурно при рентгенометрическом исследовании, но различающихся коэффициентами расширения и величиной электролитического потенциала растворения (но лишь на тысячные доли вольта). При комнатной температуре элемент кадмий устойчив и лишь незначительно тускнеет под действием воздуха и воды; поэтому его широко применяют в качестве антикоррозионных покрытий. При сильном нагревании на воздухе кадмий сгорает красным пламенем с образованием коричневого дыма оксида кадмия CdO (при этом образуются также следы перекиси ).
СОЕДИНЕНИЯ КАДМИЯ ЭЛЕМЕНТА
Оксид кадмия CdO получается при нагревании металла на воздухе или при прокаливании его гидроксида, карбоната, нитрата или сульфида. Цвет оксида кадмия зависит от температуры: прокаливание при 350—370° С дает зеленовато- желтую окраску, при нагревании до 800° С получается соединение густого сине-черного цвета; последнее образуется также при длительном кипячении гидроксида с очень концентрированным раствором КОН. При прокаливании карбоната кадмия получается аморфная коричневая, из нитрата кадмия — кристаллический черный оксид. Продукты разного цвета различаются лишь величиной частиц. При нагревании на воздухе CdO очень устойчив, около 700° С, не плавясь, начинает возгоняться, при более высокой температуре (до 1000° С) отщепляет кислород. Но в токе водорода легко восстанавливается уже при 270—300° С, а углеродом или монооксидом углерода (угарный газ) — при 700° С. Нагреванием в токе хлора оксид кадмия можно перевести в хлорид CdCl2. На воздухе коричневый CdO поглощает СО2 и постепенно белеет, переходя в карбонат. CdO нерастворим в воде и щелочах, в кислотах растворяется с образованием ионов Cd 2+ , а в аммиаке — комплексных катионов [Cd(NH3)4] 2+ .Оксид кадмия использовали в гравиметрии в виде весовой формы после прокаливания CdS или CdCО3; но при выполнении анализа необходимо учитывать ее способность легко восстанавливаться газами пламени и углем фильтровальной бумаги, что может привести к заниженным результатам.
Гидроксид кадмия Cd(OH)2 выделяется из растворов солей кадмия при действии едких щелочей в виде белого студенистого осадка, практически нерастворимого в избытке реагента, но легко растворяющегося в кислотах, цианидах и аммиаке. При нагревании до 170°С Cd(OH)2 не разлагается, при 371° С образуется CdO .
Карбонат кадмия CdCО3, выделяющийся в виде белого осадка карбонатами щелочных металлов, обычно загрязнен основной солью Cd2(ОH)2CО3. Соли аммония препятствуют выделению, но при кипячении аммиак удаляется в виде газа и происходит полное осаждение. При действии NaHCО3 осаждается не основная, а средняя соль.
Нитрат кадмия Cd(NО3)2∙4H2О — расплывающиеся лучистые иглы, получаются при растворении металла или карбоната в азотной кислоте. Осторожное обезвоживание тетрагидрата при 75—80° С (или в эксикаторе над H2SО4) дает безводную соль, плавящуюся при 360° С; при более высокой температуре разлагается с выделением CdO.
Сульфат кадмия 3CdSО4∙8H2О получают кристаллизацией раствора кадмия, его оксида или карбоната в разбавленной серной кислоте; при температурах ниже 70° С нерастворим в этаноле. При нагревании соли между 80 и 120° С образуется моногидрат, а при 320° С — безводная соль, устойчивая до 906° С. Кадмий образует двойные соли с сульфатами щелочных металлов, меди и Fe(II). Из водных растворов, содержащих аммиак, кристаллизуется в виде аммиаката. Сульфат кадмия — одна из наиболее распространенных весовых форм при определении кадмия, которую высушивают при 350—400° С. Если исходят из CdS, то его сначала растворяют в соляной кислоте и выпаривают с серной; полное удаление ее происходит с большим трудом, поэтому прокаленный сульфат растворяют в воде, снова выпаривают, прокаливают, взвешивают и повторяют эти операции до достижения постоянного веса .
Сульфид кадмия образуется при действии на растворы кадмия растворимых сульфидов или газообразного сероводорода. Цвет осадка зависит от условий выделения и меняется от зеленовато-желтого через оранжевый до красного. Желтый сульфид получается при его осаждении из холодного щелочного раствора, красный — из кислого при нагревании. Желтая форма при нагревании становится оранжево-красной, по охлаждении первоначальный желтый цвет восстанавливается; изменения цвета можно достигнуть также трением и давлением. Свежеосажденный сульфид немного растворим в разбавленных кислотах с выделением сероводорода (в соляной значительно легче, чем в серной), растворяется в концентрированном растворе хлорида аммония, но нерастворим в растворах щелочных сульфидов и очень мало — в растворе сульфида аммония. До сравнительно недавнего времени CdS, благодаря своей малой растворимости, служил основой для отделения кадмия от других элементов и использовался при его гравиметрическом, титриметрическом и колориметрическом определении.
ключевые слова: кадмий элемент. как получить кадмий элемент, кадмий элемент в природе, кадмий элемент применение. кадмий элемент свойства, кадмий элемент что это, кадмий элемент формула, кадмий элемент название..
- Кадмий
- Общая информация
- История
- Распространение в природе
- Изотопы
- Получение
- Физические свойства
- Химические свойства
- Применение
- Опасность здоровью
- КАДМИЙ
- Распространенность кадмия в природе и его промышленное извлечение.
- Характеристика простого вещества и промышленное получение металлического кадмия.
- Соединения кадмия.
- Биологическая роль кадмия.
- 📽️ Видео
Видео:Химия с нуля — Химические свойства АлкеновСкачать

Кадмий
| Название, Обозначение, Номер | Кадмий, Cd, 48 | |||||||||||||||||||||||||||||||||||||||||
| Химическая группа | переходные металлы | |||||||||||||||||||||||||||||||||||||||||
| Группа, период, Блок | 12, 5, d | |||||||||||||||||||||||||||||||||||||||||
| Плотность, Твердость | 8650 кг / м³, 2 | |||||||||||||||||||||||||||||||||||||||||
| Показать | Серебристо-белый металлический | |||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Атомная масса | 112,411 а.е.м. (г / моль) | |||||||||||||||||||||||||||||||||||||||||
| Радиус атома | 155 (161) пм | |||||||||||||||||||||||||||||||||||||||||
| Ковалентная радиус | 148 пм | |||||||||||||||||||||||||||||||||||||||||
| Радиус Ван дер Ваальса | 158 пм | |||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Kr] 4d 10 5s 2 | |||||||||||||||||||||||||||||||||||||||||
| e — на энергетический уровень | 2, 8, 18, 18, 2 | |||||||||||||||||||||||||||||||||||||||||
| Степени окисления (Оксид) | 2 (основной) | |||||||||||||||||||||||||||||||||||||||||
| Структура решетки | Гексагональная | |||||||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||||||
| Агрегатное состояние | Твердый | |||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 594,22 K | |||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 1040 K | |||||||||||||||||||||||||||||||||||||||||
| Молярный объем | 1,00 × 10 -6 м³ / моль | |||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 100 кДж / моль | |||||||||||||||||||||||||||||||||||||||||
| Удельная теплота плавления | 6,192 кДж / моль | |||||||||||||||||||||||||||||||||||||||||
| Давление насыщенного пара | 14,8 Па при 597 K | |||||||||||||||||||||||||||||||||||||||||
| Скорость звука | 2310 м / с при 293,15 K | |||||||||||||||||||||||||||||||||||||||||
| Разное | ||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | 1,69 (по Полинґом) | |||||||||||||||||||||||||||||||||||||||||
| Удельная теплоемкость | 233 Дж / (кг · К) | |||||||||||||||||||||||||||||||||||||||||
| Электропроводность | 13,8 10 июня / (м · Ом) | |||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 96,8 Вт / (м · К) | |||||||||||||||||||||||||||||||||||||||||
| I [Энергия ионизации]] | 867,8 кДж / моль | |||||||||||||||||||||||||||||||||||||||||
| II ИОНИЗАЦИОННОГО потенциал | 1631,4 кДж / моль | |||||||||||||||||||||||||||||||||||||||||
| III ИОНИЗАЦИОННОГО потенциал | 3 616 кДж / моль | |||||||||||||||||||||||||||||||||||||||||
| Самые стойкие изотопы | ||||||||||||||||||||||||||||||||||||||||||
|
Кадмий — химический элемент в периодической таблице, который сказывается Cd и имеет атомный номер 48 и атомную массу 112,41. Серебристо-белый мягкий металл с синеватым отливом, гибкий, тягучий, легкоплавкий, токсический переходный металл, встречается в цинковом рыжие, массово используется в батареях питания.
Природный кадмий состоит из смеси 8 стабильных изотопов с массовыми числами106, 108, 110, 111, 112, 113, 114, 116. Кадмий сильно захватывает тепловые нейтроны, самый поперечное сечение поглощения имеет изотоп 113 Cd. Соли легко гидролизуются, имеют кислую реакцию, под действием щелочей выделяется гидроксид Cd (OН) 2. Единственный стабильный степень окисления 2. Характерным для Cd является координационное число 6, хотя встречаются 4 и 5. Кадмийорганични соединения R 2 Cd не устойчивы к воде и кислорода, высокореактивный.
Видео:Химические свойства металлов. 9 класс.Скачать

Общая информация
Простое вещество — кадмий. Мягкий ковкий металл, аллотропных модификаций НЕ мае..Густина 8,65, т-ра плавления 321,1 ° C, т-ра кипения — 766,5 ° C. Кларк К. — 1,35 · 10-35%. Реагирует с кислотами. Растворимые соединения ядовиты. Образует редкие минералы: гринокит CdS (77,7% Cd), отавит CdCO 3, кадмоселит CdSe, монтепонит CdO (87,5% Cd). Входит в виде изоморфной примеси в минералов цинка, особенно в сфалерита. Примесь Cd (тысячные доли%) является в гидротермальных рудах, где он присутствует в Сфалерит, галените и др., Главным образом сульфидных минералах. Повышенное содержание К. до 1,5% характерен для маложелезистого Сфалерит.
Во влажном воздухе покрывается защитной оксидацийного пленкой с CdO, при сильном нагревании сгорает до CdO. Галогенами легко оксидируется к галида. Растворяется в минеральных кислотах, в лугах не растворим. Реагирует с кислородом при нагревании, а также с кислотами.
Видео:Кадмий 48. Жёлтый яд вокруг нас.Скачать

История
Кадмий (лат. Cadmia, греч. Kadmeia означает цинковая руда) был открыт в Германии в 1817 Фридрихом Штрогмеером. Штронгмеер нашел новый элемент в загрязнении оксида цинка, и около 100 лет Германия оставалась единственной страной, которая импортировала этот металл. Ученый назвал металл кадмием, подчеркнув его «родственные связи» с цинком: греческое слово «кадмия» означало «цинковая руда».
Видео:Кадмий - Токсичный Металл из Старых Батареек!Скачать

Распространение в природе
Кадмий относится к числу редких рассеянных элементов, его Кларк (процент содержания по массе) в земной коре составляет 1,3 * 10 -5%. Для кадмия характерна миграция в горячих подземных водах вместе с цинком и другими халькофильных элементами (т.е. химическими элементами, склонными к образованию природных сульфидов, селенидов, телерадио, сульфосолей, что иногда встречаются в самородном состоянии) и концентрация в гидротермальных отложениях. Вулканические породы содержат до 0,2 мг кадмия на кг, среди осадочных пород наиболее богатые кадмием глины — до 0,3 мг / кг, известняки содержат 0,035 мг / кг, песчаники — 0,03 мг / кг. Среднее содержание кадмия в почве — 0,06 мг / кг.
Хотя известны самостоятельные минералы кадмия — гринокит (CdS), отавит (CdCO 3), монтепонит (CdO) и селенид (CdSe), своих залежей они не образуют, а присутствующие в виде примесей в цинковых, свинцовых, медных и полиметаллических рудах, и является основным источником промышленного получения кадмия.
В определенной степени кадмий присутствует и в воздухе. Содержание кадмия в воздухе составляет 0,1 -5 нг / м в сельской местности (1 нг или 10 -9 г), 2-15 нг / м — в городах и от 15 до 150 нг / м — в промышленных районах. Связано это с тем, что многие виды угля содержат кадмий в виде примесей и, при сжигания на теплоэлектростанциях, он попадает в атмосферу. При этом большая его часть оседает на почву. Также увеличению содержания кадмия в почве способствует использование минеральных удобрений, так как все они содержат незначительные примеси кадмия.
Кадмий может накапливаться в растениях (больше всего в грибах) и живых организмах (особенно в водных) и далее по пищевой цепи может «поставляться» человеку. Многие кадмия в сигаретном дыме.
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Изотопы
Природный кадмиум состоит из 6 устойчивых изотопов. Было выявлено 27 устойчивых радиоизотопов: Cd-113 с периодом полураспада 7,7 квадриллионов лет, Cd-109 с периодом полураспада 462,6 дней и Cd-115 с периодом полураспада 53,46 часов. Все остальные радиоактивные изотопы имеют период полураспада менее 2,5 часов и большинство из них имеют период полураспада менее 5 минут. Этот элемент имеет 8 метастабильных состояний, самые стойкие из них: Cd-113 (t ½ 14,1 лет), Cd-115 (t ½ 44,6 дней) и Cd-117 (t ½ 3,36 часов).
Изотопы кадмия имеют атомную массу в пределах от 96,935 Дн (Cd-97) к 129,934 Дн (Cd-138). Основной вид распада наиболее распространенного устойчивого изотопа Cd-112 — это захват электрона и его бета-излучения. Продуктом распада к операции является элемент 47 (серебро), а после — элемент 49 (индий).
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Получение
Мировое производство кадмия в начале XXI в. составляет ок. 20 млн т. Из них страны Азии дают 45%, Америки — 25%, Европы — 27%.
Основные источники кадмия — промежуточные продукты цинкового производства, пыль свинцовых и медеплавильных заводов. Сырье обрабатывают концентрированной серной кислотой и получают CdSO 4 в растворе. Из раствора Cd выделяют, используя цинковая пыль:
Полученный металл очищают переплавкой под слоем щелочи для удаления примесей цинка и свинца. Кадмий высокой чистоты получают электрохимическим рафинированием с промежуточным очисткой электролита.
Видео:Кадмий - Cd. Реакция Хлорида Кадмия и Цинка. Реакция Zn и CdCl2.Скачать

Физические свойства
Кадмий — это мягкий, тягучий, гибкий, серебристо-белый двухвалентный металл, который можно легко разрезать. Во многом он похож на цинк, но он способен образовывать сложные соединения.
Видео:КАДМИЙСкачать

Химические свойства
По химическим свойствам кадмий подобный цинка, однако менее активным. При обычной температуре на воздухе поверхность металлического кадмия покрывается оксидной пленкой, которая затрудняет проведение реакций — большинство взаимодействий проходят при нагревании. При сжигании кадмия в струе кислорода образуется его оксид:
При контакте с водой кадмий пассивируется за появления гидроксидних пленки Cd (OH) 2, однако он активно разлагает перегретый водную пару:
Кроме кислорода, металлический кадмий взаимодействует также с галогенами, серой, селеном, фосфором (с образованием примесей):


Восстановительные свойства в кадмия слабее, чем в цинке, но он так же восстанавливает некоторые неметаллы из оксидов и металлы в их солях (в растворах):


Кадмий может выступать в качестве комплексообразователя, координируя 3, 4 или 6 лигандов:

Видео:Говори как химик. Ионы. Катионы и АнионыСкачать

Применение
Благодаря своим физическим свойствам, кадмий нашел широкое применение в технике и промышленности (особенно, начиная с 50-х годов XX века). Основные сферы применения его использования: для антикоррозионного покрытия (так называемого кадмирования) черных металлов, особенно в тех случаях, когда они контактируют с морской водой, а также для производства никель-кадмиевых электрических аккумуляторов и батарей. Кадмий входит в состав многих сплавов, как лекгоплавких, применяемых в качестве припоев (например, сплав Вуда (Wood’s metal) — 50% Bi, 25% Pb, 12,5% Sn, 12,5% Cd), так и тугоплавких износостойких (например, с никелем). Кадмий используется в стержнях-замедлителях атомных реакторов, некоторые соединения кадмия имеют полупроводниковые свойства и тому подобное. Достаточно долго кадмий использовался для производства красителей (пигментов) и в качестве стабилизатора в производстве пластмасс (например, полихлорвинила), однако в настоящее время, из-за токсичности, в этих целях он практически не используется.
Видео:9 класс. Химические свойства металловСкачать

Опасность здоровью
Кадмий — один из немногих элементов, не выполняет конструктивных функций в человеческом организме. Этот элемент и его соединения являются чрезвычайно токсичными даже в незначительных концентрациях. Имеет свойство накапливаться в организмах и экосистемах.
Вдыхание кадмиевого пыли быстро приводит к заболеваниям, часто смертельных, дыхательных путей и почек (чаще всего — почечная недостаточность). Поглощение любой значительного количества кадмия вызывает немедленное поражение печени и почек. Соединения, содержащие кадмий также канцерогенными. Данные о канцерогенности кадмия ограничены. В опытах на животных не было зафиксировано роста числа опухолей из употребления кадмия. Такая тенденция наблюдалась только с вдыханием частиц пыли, содержащий неорганические соединения кадмия.
Отравление кадмием является причиной болезни, которая впервые была описана в Японии в 50-х годах XX века и получила название «Итай-итай» (что дословно означает «больно-больно»).
Видео:Кадмий. Польза и действие на организм.Скачать

КАДМИЙ
КАДМИЙ (Cadmium) Cd, – химический элемент II группы Периодической системы. Атомный номер 48, относительная атомная масса 112,41. Природный кадмий состоит из восьми стабильных изотопов: 106 Cd (1,22%), 108 Cd (0,88%), 110 Cd (12,39%), 111 Cd (12,75%), 112 Cd (24,07%), 113 Cd (12,26%), 114 Cd (28,85%) и 116 Cd (7,58%). Степень окисления +2, редко +1.
Кадмий был открыт в 1817 немецким химиком Фридрихом Штромейером (Stromeyer Friedrich) (1776–1835).
При проверке оксида цинка, вырабатываемого одной из шенебекских фабрик, появилось подозрение, что он содержит примесь мышьяка. При растворении препарата в кислоте и пропускании через раствор сероводорода выпадал желтый осадок, похожий на сульфиды мышьяка, однако более тщательная проверка показала, что этого элемента нет. Для окончательного заключения образец подозрительного оксида цинка и другие цинковые препараты (в том числе карбонат цинка) с этой же фабрики послали Фридриху Штромейеру, занимавшему с 1802 кафедру химии в Геттингенском университете и должность генерального инспектора ганноверских аптек.
Прокалив карбонат цинка, Штромейер получил оксид, но не белый, как это должно было быть, а желтоватый. Он предположил, что окраска вызвана примесью железа, однако оказалось, что железа нет. Штромейер полностью проанализировал цинковые препараты и установил, что желтая окраска появилась благодаря новому элементу. Он получил название в честь цинковой руды, в которой был найден: греческое слово kadmeia , «кадмиевая земля» – древнее название смитсонита ZnCO3. Это слово, по преданию, происходит от имени финикийца Кадма, который будто бы первым нашел цинковый камень и подметил его способность придавать меди (при выплавке ее из руды) золотистый цвет. Так же звали героя древнегреческой мифологии: по одной из легенд, Кадм победил в тяжелом поединке Дракона и на его землях построил крепость Кадмею, вокруг которой затем вырос семивратный город Фивы.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Распространенность кадмия в природе и его промышленное извлечение.
Содержание кадмия в земной коре составляет 1,6·10 –5 %. Он близок по распространенности к сурьме (2·10 –5 %) и в два раза более распространен, чем ртуть (8·10 –6 %). Для кадмия характерна миграция в горячих подземных водах вместе с цинком и другими химическими элементами, склонными к образованию природных сульфидов. Он концентрируется в гидротермальных отложениях. Вулканические породы содержат до 0,2 мг кадмия на кг, среди осадочных пород наиболее богаты кадмием глины – до 0,3 мг/кг, в меньшей степени – известняки и песчаники (около 0,03 мг/кг). Среднее содержание кадмия в почве – 0,06 мг/кг.
У кадмия есть собственные минералы – гринокит CdS, отавит CdCO3, монтепонит CdO. Однако своих месторождений они не образуют. Единственным промышленно значимым источником кадмия являются руды цинка, где он содержится в концентрации 0,01–5%. Кадмий накапливается также в галените (до 0,02%), халькопирите (до 0,12%), пирите (до 0,02%), станните (до 0,2%). Общие мировые ресурсы кадмия оцениваются в 20 млн. т, промышленные – в 600 тыс. т.
Видео:Получение кадмияСкачать

Характеристика простого вещества и промышленное получение металлического кадмия.
Кадмий – серебристое твердое вещество с голубоватым блеском на свежей поверхности, мягкий, ковкий, тягучий металл, хорошо прокатывается в листы, легко поддается полированию. Подобно олову палочки кадмия при сгибании издают треск. Плавится при 321,1° С, кипит при 766,5° С, плотность – 8,65 г/см 3 , что позволяет отнести его к тяжелым металлам.
В сухом воздухе кадмий устойчив. Во влажном воздухе он быстро тускнеет, а при нагревании легко взаимодействует с кислородом, серой, фосфором и галогенами. С водородом, азотом, углеродом, кремнием и бором кадмий не реагирует.
Пары кадмия взаимодействуют с парами воды с выделением водорода. Кислоты растворяют кадмий с образованием солей этого металла. Кадмий восстанавливает нитрат аммония в концентрированных растворах до нитрита аммония. Он окисляется в водном растворе катионами некоторых металлов, например меди(II) и железа(III). С растворами щелочей, в отличие от цинка, кадмий не взаимодействует.
Основные источники кадмия – промежуточные продукты цинкового производства. Осадки металлов, полученные после очистки растворов сульфата цинка действием цинковой пыли, содержат 2–12% кадмия. Во фракциях, образующихся при дистилляционном получении цинка, содержится 0,7–1,1% кадмия, а во фракциях, полученных при ректификационной очистке цинка – до 40% кадмия. Кадмий извлекают и из пыли свинцовых и медеплавильных заводов (она может содержать до 5% и 0,5% кадмия, соответственно). Пыль обычно обрабатывают концентрированной серной кислотой, а затем сульфат кадмия выщелачивают водой.
Из растворов сульфата кадмия действием цинковой пыли осаждают кадмиевую губку, затем ее растворяют в серной кислоте и очищают раствор от примесей действием оксида цинка или карбоната натрия, а также методами ионного обмена. Металлический кадмий выделяют электролизом на алюминиевых катодах либо восстановлением цинком.
Для удаления цинка и свинца металлический кадмий переплавляют под слоем щелочи. Расплав обрабатывают алюминием, чтобы удалить никель, и хлоридом аммония, чтобы избавиться от таллия. Применяя дополнительные методы очистки, можно получить кадмий с содержанием примесей 10 –5 % по массе.
В год производится около 20 тыс. т кадмия. Объем его производства в большой степени связан с масштабами производства цинка.
Важнейшей областью применения кадмия является производство химических источников тока. Кадмиевые электроды используются в батареях и аккумуляторах. Отрицательные пластины никель-кадмиевых аккумуляторов изготовлены из железных сеток с губчатым кадмием в качестве активного агента. Положительные пластины покрыты гидроксидом никеля. Электролитом служит раствор гидроксида калия. На основе кадмия и никеля изготавливают и компактные аккумуляторы для управляемых ракет, только в этом случае в качестве основы устанавливают не железные, а никелевые сетки.
Процессы, протекающие в никель-кадмиевом щелочном аккумуляторе, можно описать суммарным уравнением:
Cd + 2NiO(OH) + 2H2O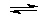
Никель-кадмиевые щелочные аккумуляторы более надежны, чем свинцовые (кислотные). Эти источники тока отличаются высокими электрическими характеристиками, стабильностью работы, длительным сроком эксплуатации. Их можно зарядить всего за один час. Однако никель-кадмиевые аккумуляторы нельзя подзаряжать без полной предварительной разрядки (в этом отношении они уступают металлогидридным аккумуляторам).
Кадмий широко используется для нанесения антикоррозионных покрытий на металлы, особенно в случаях их контакта с морской водой. Кадмируются наиболее важные детали кораблей, самолетов, а также различные изделия, предназначенные для работы в условиях тропического климата. Раньше железо и другие металлы кадмировали погружением изделий в расплавленный кадмий, сейчас кадмиевое покрытие наносят электролитически.
У кадмиевых покрытий есть некоторые преимущества по сравнению с цинковыми: они более устойчивы к коррозии, их легче сделать ровными и гладкими. Высокая пластичность таких покрытий обеспечивает герметичность резьбовых соединений. К тому же кадмий, в отличие от цинка, устойчив в щелочной среде.
Однако у кадмирования есть свои проблемы. При электролитическом нанесении кадмия на стальную деталь в металл может проникнуть содержащийся в электролите водород. Он вызывает у высокопрочных сталей так называемую водородную хрупкость, приводящую к неожиданному разрушению металла под нагрузкой. Для предотвращения этого явления в кадмиевые покрытия вводят добавку титана.
Кроме того, кадмий токсичен. Поэтому, хотя кадмированную жесть применяют довольно широко, для изготовления кухонной утвари и тары для пищевых продуктов использовать ее запрещено.
Примерно десятая часть мирового производства кадмия расходуется на производство сплавов. Кадмиевые сплавы используют главным образом как антифрикционные материалы и припои. Сплав, содержащий 99% кадмия и 1% никеля, применяют для изготовления подшипников, работающих в автомобильных, авиационных и судовых двигателях в условиях высоких температур. Поскольку кадмий недостаточно стоек к действию кислот, в том числе и содержащихся в смазочных материалах органических кислот, иногда подшипниковые сплавы на основе кадмия покрывают индием.
Легирование меди небольшими добавками кадмия позволяет делать более износостойкими провода на линиях электрического транспорта. Медь с добавкой кадмия почти не отличается по электропроводности от чистой меди, но заметно превосходит ее прочностью и твердостью.
Кадмий входит в легкоплавкого сплава Вуда (Wood’s metal), содержащего 50% висмута, 25% свинца, 12,5% олова, 12,5 % кадмия. Сплав Вуда можно расплавить в кипящей воде. Любопытно, что первые буквы компонентов сплава Вуда образуют аббревиатуру ВОСК. Он был изобретен в 1860 не очень известным английским инженером Б.Вудом (B.Wood). Часто это изобретение ошибочно приписывают его однофамильцу – знаменитому американскому физику Роберту Уильямсу Вуду, который родился лишь спустя восемь лет. Легкоплавкие сплавы кадмия используют как материал для получения тонких и сложных отливок, в автоматических противопожарных системах, для спайки стекла с металлом. Припои, содержащие кадмий, довольно устойчивы к температурным колебаниям.
Резкий скачок спроса на кадмий начался в 1940-е и был связан с применением кадмия в атомной промышленности – выяснилось, что он поглощает нейтроны и из него стали делать регулирующие и аварийные стержни атомных реакторов. Способность кадмия поглощать нейтроны строго определенных энергий используется при исследовании энергетических спектров нейтронных пучков.
Видео:🔥 Получил МЕТАЛЛ из СОДЫ. Старинный способ ДОБЫЧИ НАТРИЯ.Скачать

Соединения кадмия.
Кадмий образует бинарные соединения, соли и многочисленные комплексные, в том числе металлоорганические, соединения. В растворах молекулы многих солей, в частности галогенидов, ассоциированы. Растворы имеют слабокислотную среду вследствие гидролиза. При действии растворов щелочей, начиная с рН 7–8, осаждаются основные соли.
Оксид кадмия CdO получают при взаимодействии простых веществ или прокаливанием гидроксида либо карбоната кадмия. В зависимости от «термической истории» он может быть зеленовато-желтым, коричневым, красным или почти черным. Это частично обусловлено размером частиц, но в большей степени является результатом дефектов кристаллической решетки. Выше 900° С оксид кадмия летуч, а при 1570° С полностью возгоняется. Он обладает полупроводниковыми свойствами.
Оксид кадмия легко растворяется кислотах и плохо – в щелочах, легко восстанавливается водородом (при 900° С), монооксидом углерода (выше 350° С), углеродом (выше 500° С).
Оксид кадмия используют в качестве материала электродов. Он входит в состав смазочных масел и шихты для получения специальных стекол. Оксид кадмия катализирует ряд реакций гидрогенизации и дегидрогенизации.
Гидроксид кадмия Cd(OH)2 выпадает в виде белого осадка из водных растворов солей кадмия(II) при добавлении щелочи. При действии очень концентрированных растворов щелочей он превращается в гидроксокадматы, такие как Na2[Cd(OH)4]. Гидроксид кадмия реагирует с аммиаком с образованием растворимых комплексов:
Кроме того, гидроксид кадмия переходит в раствор под действием цианидов щелочных элементов. Выше 170° С он разлагается до оксида кадмия. Взаимодействие гидроксида кадмия с пероксидом водорода в водном растворе приводит к образованию пероксидов разнообразного состава.
Применяют гидроксид кадмия для получения других соединений кадмия, а также как аналитический реагент. Он входит в состав кадмиевых электродов в источниках тока. Кроме того, гидроксид кадмия используется в декоративных стеклах и эмалях.
Фторид кадмия CdF2 мало растворим в воде (4,06% по массе при 20° С), не растворим в этаноле. Его можно получить действием фтора на металл или фтороводорода на карбонат кадмия.
Фторид кадмия используется в качестве оптического материала. Он входит в состав некоторых стекол и люминофоров, а также твердых электролитов в химических источниках тока.
Хлорид кадмия CdCl2 хорошо растворим в воде (53,2% по массе при 20° С). Его ковалентный характер обусловливает сравнительно низкую температуру плавления (568,5° С), а также растворимость в этаноле (1,5% при 25° С).
Хлорид кадмия получают при взаимодействии кадмия с концентрированной соляной кислотой или хлорированием металла при 500° С.
Хлорид кадмия является компонентом электролитов в кадмиевых гальванических элементах и сорбентов в газовой хроматографии. Он входит в состав некоторых растворов в фотографии, катализаторов в органическом синтезе, флюсов для выращивания полупроводниковых кристаллов. Его используют как протраву при крашении и печатании тканей. Из хлорида кадмия получают кадмиеорганические соединения.
Бромид кадмия CdBr2 образует чешуйчатые кристаллы с перламутровым блеском. Он очень гигроскопичен, хорошо растворим в воде (52,9% по массе при 25° С), метаноле (13,9% по массе при 20° С), этаноле (23,3% по массе при 20° С).
Получают бромид кадмия бромированием металла или действием бромоводорода на карбонат кадмия.
Бромид кадмия служит катализатором в органическом синтезе, является стабилизатором фотоэмульсий и компонентом вирирующих составов в фотографии.
Иодид кадмия CdI2 образует блестящие кристаллы в виде листочков, у них слоистая (двумерная) кристаллическая структура. Известно до 200 политипов иодида кадмия, различающихся последовательностью расположения слоев с гексагональной и кубической плотнейшей упаковкой.
В отличие от других галогенов, иодид кадмия не гигроскопичен. Он хорошо растворяется в воде (46,4% по массе при 25° С). Получают иодид кадмия иодированием металла при нагревании или в присутствии воды, а также действием иодоводорода на карбонат или оксид кадмия.
Иодид кадмия служит катализатором в органическом синтезе. Он является компонентом пиротехнических составов и смазочных материалов.
Сульфид кадмия CdS был, вероятно, первым соединением этого элемента, которым заинтересовалась промышленность. Он образует кристаллы от лимонно-желтого до оранжево-красного цвета. Сульфид кадмия обладает полупроводниковыми свойствами.
В воде это соединение практически не растворяется. К действию растворов щелочей и большинства кислот он также устойчив.
Получают сульфид кадмия взаимодействием паров кадмия и серы, осаждением из растворов под действием сероводорода или сульфида натрия, реакциями между кадмий- и сераорганическими соединениями.
Сульфид кадмия – важный минеральный краситель, раньше его называли кадмиевой желтью.
В малярном деле кадмиевая желть впоследствии стала применяться шире. В частности, ею красили пассажирские вагоны, потому что, помимо прочих достоинств, эта краска хорошо противостояла паровозному дыму. Как красящее вещество сульфид кадмия использовали также в текстильном и мыловаренном производствах. Соответствующие коллоидные дисперсии применяли для получения цветных прозрачных стекол.
В последние годы чистый сульфид кадмия вытесняется более дешевыми пигментами – кадмопоном и цинкокадмиевым литопоном. Кадмопон – смесь сульфида кадмия и сульфата бария. Его получают, смешивая две растворимые соли – сульфат кадмия и сульфид бария. В результате образуется осадок, содержащий две нерастворимые соли:
CdSO4 + BaS = CdS Ї + BaSO4 Ї
Цинкокадмиевый литопон содержит еще и сульфид цинка. При изготовлении этого красителя в осадок выпадают одновременно три соли. Литопон – кремового цвета или цвета слоновой кости.
С добавками селенида кадмия, сульфида цинка, сульфида ртути и других соединений сульфид кадмия дает термически устойчивые пигменты с яркой окраской от бледно-желтой до темно-красной.
Сульфид кадмия придает пламени синюю окраску. Это его свойство используют в пиротехнике.
Кроме того, сульфид кадмия применяется как активная среда в полупроводниковых лазерах. Он случит в качестве материала для изготовления фотоэлементов, солнечных батарей, фотодиодов, светодиодов, люминофоров.
Селенид кадмия CdSe образует темно-красные кристаллы. Он не растворяется в воде, разлагается соляной, азотной и серной кислотами. Получают селенид кадмия сплавлением простых веществ или из газообразных кадмия и селена, а также осаждением из раствора сульфата кадмия под действием селеноводорода, реакцией сульфида кадмия с селенистой кислотой, взаимодействием между кадмий- и селенорганическими соединениями.
Селенид кадмия является люминофором. Он служит в качестве активной среды в полупроводниковых лазерах, является материалом для изготовления фоторезисторов, фотодиодов, солнечных батарей.
Селенид кадмия является пигментом для эмалей, глазурей и художественных красок. Селенидом кадмия окрашивают рубиновое стекло. Именно он, а не оксид хрома, как в самом рубине, сделал рубиново-красными звезды московского Кремля.
Теллурид кадмия CdTe может иметь окраску от темно-серой до темно-коричневой. Он не растворяется в воде, но разлагается концентрированными кислотами. Его получают взаимодействием жидких или газообразных кадмия и теллура.
Обладающий полупроводниковыми свойствами теллурид кадмия используют как детектор рентгеновского и g -излучения, а теллурид ртути-кадмия нашел широкое применение (особенно в военных целях) в ИК детекторах для тепловидения.
При нарушении стехиометрии или введении примесей (например, атомов меди и хлора), теллурид кадмия приобретает светочувствительные свойства. Это используется в электрофотографии.
Кадмиеорганические соединения CdR2 и CdRX (R = CH3, C2H5, C6H5 и другие углеводородные радикалы, Х – галогены, OR, SR и др.) обычно получают из соответствующих реактивов Гриньяра. Они термически менее устойчивы, чем их цинковые аналоги, однако в целом менее реакционноспособны (обычно не воспламеняются на воздухе). Их наиболее важной областью применения является получение кетонов из хлорангидридов кислот.
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

Биологическая роль кадмия.
Кадмий обнаруживается в организмах практически всех животных (у наземных около 0,5 мг на 1 кг массы, а у морских – от 0,15 до 3 мг/кг). Вместе с тем его относят к наиболее токсичным тяжелым металлам.
Кадмий сосредотачивается в организме преимущественно в почках и печени, при этом содержание кадмия в организме к старости повышается. Он накапливается в виде комплексов с белками, которые участвуют в ферментативных процессах. Попадая в организм извне, кадмий оказывает ингибирующее действие на целый ряд ферментов, разрушая их. Его действие основано на связывании группы –SH цистеиновых остатков в белках и ингибировании SH-ферментов. Он может также ингибировать действие цинксодержащих ферментов, замещая цинк. Из-за близости ионных радиусов кальция и кадмия, он может замещать кальций в костной ткани.
Люди отравляются кадмием, употребляя воду, загрязненную кадмиесодержащими отходами, а также овощи и зерновые, растущие на землях, расположенных вблизи от нефтеперегонных заводов и металлургических предприятий. Особой способностью накапливать кадмий отличаются грибы. По некоторым сведениям, содержание кадмия в грибах может достигать единиц, десятков и даже 100 и более миллиграммов на кг собственной массы. Соединения кадмия есть среди вредных веществ, находящихся в табачном дыме (одна сигарета содержит 1–2 мкг кадмия).
Классическим примером хронического отравления кадмием является заболевание, впервые описанное в Японии в 1950-е и получившее название «итай-итай». Болезнь сопровождалась сильными болями в поясничной области, болью в мышцах. Появлялись и характерные признаки необратимого поражения почек. Были зафиксированы сотни смертельных исходов «итай-итай». Заболевание приняло массовый характер в силу высокой загрязненности окружающей среды в Японии в то время и специфики питания японцев – преимущественно рисом и морепродуктами (они способны накапливать кадмий в высоких концентрациях). Исследования показали, что заболевшие «итай-итай» потребляли до 600 мкг кадмия в сутки. В дальнейшем в результате мероприятий по охране окружающей среды, частота и острота синдромов, подобных «итай-итай» заметно снизилась.
В США была обнаружена зависимость между содержанием кадмия в атмосфере и частотой смертельных случаев от сердечно-сосудистых заболеваний.
Считают, что без вреда для здоровья в организм человека в сутки может поступать около 1 мкг кадмия на 1 кг собственного веса. В питьевой воде кадмия не должно содержаться более 0,01 мг/л. Противоядием при отравлении кадмием является селен, однако употребление продуктов, богатых этим элементом, приводит к понижению содержания серы в организме, и в этом случае кадмий снова становится опасным.
📽️ Видео
Палладий - САМЫЙ ПРОТИВНЫЙ МЕТАЛЛ НА ЗЕМЛЕ!Скачать

2.3. Алкены: Химические свойстваСкачать

Химические свойства веществ. Общие представления.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

5.3. Циклоалканы: Химические свойства. ЕГЭ по химииСкачать






