Халькогены — это группа химических элементов, которые размещены в главной подгруппе 6 группы периодической таблицы Менделеева.
Интересно узнать, почему они так названы. А все потому, что в природе они очень часто встречаются в виде соединений с медью (на греческом «chalkos» — медь и «genos» — рожденный).
Видео:Химия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать

Описание и общая характеристика
Родоначальник этой группы — кислород. Кроме него сюда входят такие элементы как селен, сера, теллур и полоний.
Среди них: неметаллы — сера и кислород, промежуточные элементы между металлами и неметаллами — теллур и селен, и один металл — полоний.
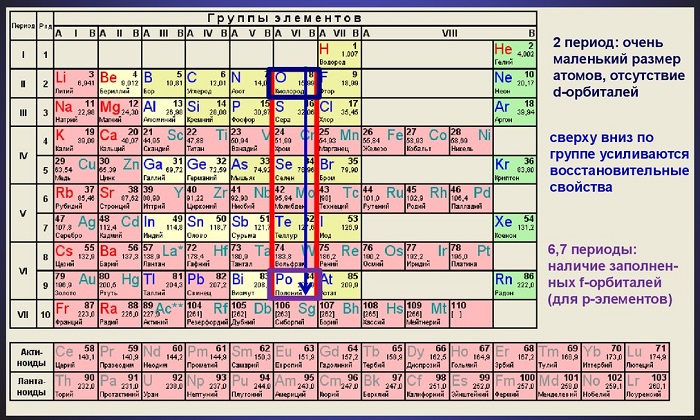
С уменьшением порядочного номера элементов группы радиус атомов уменьшается, поэтому наименьший радиус имеется у кислорода, а наибольший — у полония.
Видео:ХИМИЯ 9 класс : ХалькогеныСкачать

Строение молекул и физические свойства
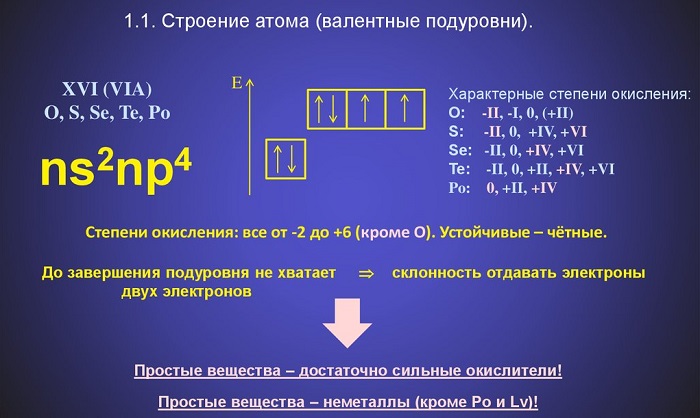
Электронная конфигурация атомов этих элементов характеризуется шестью электронами на внешнем энергетическом уровне.
Все халькогены могут проявлять разные степени окисления: для кислорода это -2 и +2 (в соединении с фтором), для атома теллура, а также для селена и серы это +2, +4 и +6.
Для кислорода и серы характерно такое свойство как аллотропия. Так как у них есть два неспаренных электрона, то возможны разные варианты строения простых веществ. Например, в зависимости от того, какую связь образует элемент О (кислород) — двойную или тройную, соответственно различают кислород и озон.
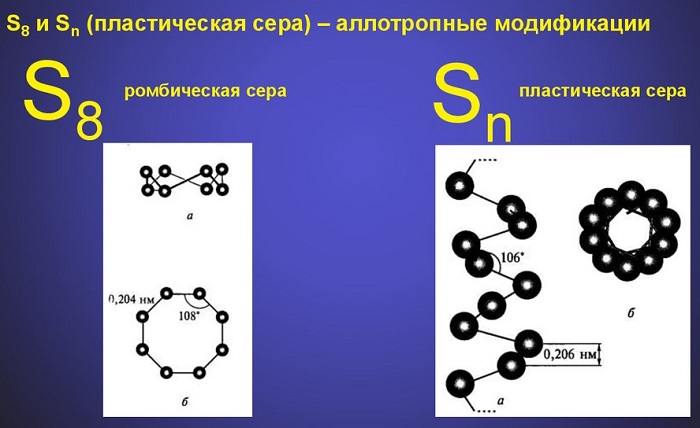
Также образовывать аллотропные вещества может сера, создавая многоатомные циклы и цепи.
Аллотропные модификации элементов имеют также различные физические свойства: такие характеристики как растворимость в воде и температура кипения у озона намного выше, чем у кислорода, а виды многоатомных цепей у серы такие как ромбическая и моноклинная, в отличие от пластической — растворяются в органических жидкостях, но при этом все они не растворяются в воде.
Видео:ХАЛЬКОГЕНЫ | Кислород | Химия 9 классСкачать

Химические свойства халькогенов
Кислород, как наиболее элетроотрицательный элемент этой группы — может выступать окислителем почти всех простых и некоторых сложных веществ.
Только взаимодействуя со фтором он выступает в качестве восстановителя с положительной степенью окисления. С неметаллами он взаимодействует при довольно высоких температурах.
Так как сера имеет высокую реакционную способность (особенно если она находится в твёрдом агрегатном состоянии, а не в расплаве) — она может соединяться почти со всеми простыми веществами, кроме инертных газов.
Её скорость взаимодействия с водородом и хлором увеличивается с увеличением температуры. Также она может гореть во фторе и окисляться при высоких температурах с образованием оксида серы.
Полоний, селен и теллур хотя и не имеют такой большой реакционной способности, как у двоих предыдущих представителей этой группы элементов, тем не менее — так же могут реагировать почти со всеми простыми веществами. Селениды, полониды и теллуриды металлов именуются наиболее устойчивыми.
Всем халькогенам характерна реакция диспропорционирования (в виде взаимодействия с водой).
Видео:Элементы 16 (VIA) группы. 9 класс.Скачать

Биологическая роль халькогенов
В этой группе есть как элементы, жизненно необходимые, так и те, биологическую роль которых не обнаружили. К первым относится сера, селен и, как ни странно, кислород; ко вторым — теллур и полоний.
Представители первой группы имеют место в составе биомолекул организма человека. Главное значение здесь по праву принадлежит кислороду.
Он окисляет питательные вещества, в результате чего выделяется энергия, необходимая для жизнедеятельности, принимает участие в защитных свойствах организма, также в медицине огромную роль играет его применение при различных заболеваниях, по причине которых у человека нарушаются дыхательные функции.
Другая форма кислорода — озон — используется для обеззараживания воздуха и дезинфекции помещений. Ещё его применяют для очистки питьевой воды. В природе его можно обнаружить в воздухе из-за характерного чувства приятной свежести и некоего запаха.
Теперь поговорим о сере. Она также, как и предыдущий элемент, относится по содержанию в организме к макроэлементам. Чтобы понять её большое значение, достаточно сказать, что она входит в состав таких биомолекул как белки, аминокислоты, гормоны, витамины.
Также её обнаружили в составе костей, в нервной ткани и в каротине волос. Кроме всего этого она некоторым образом участвует и в защитной системе организма, обезвреживая ядовитые соединения.
И последний представитель «полезных» элементов — селен. Хотя его относят к микроэлементам, но для организма он жизненно необходимым.
Селен может выступать в различных соединениях в роли аналога серы, замещая её. Его также обнаружили в составе некоторых ферментов.
Находясь в активном центре одного из них — он участвует в защите клеток от действия пероксида водорода и органических пероксидов. Физиологическая роль этого элемента в процессе жизнедеятельности доказывается его способностью предохранять ткани от некроза. Ещё одна из функций селена — предохранение от отравления кадмием и ртутью.
Поэтому, если обобщить: сера и кислород — жизненно необходимые, селен — физиологически активен, а роль полония и теллура не обнаружена.
Видео:СЕРА | Химия 9 классСкачать

Халькогены

Средняя оценка: 4.3
Всего получено оценок: 512.
Средняя оценка: 4.3
Всего получено оценок: 512.
Элементы VI группы главной подгруппы называются халькогенами. К ним относятся кислород, сера, селен, теллур и полоний. Слово «халькоген» состоит из двух греческих слов, означающих «медь» или «руда» и «рождённый».
Видео:Химия | КислородСкачать

Описание
Халькогены в природе встречаются чаще всего в составе руды – сульфидов, пиритов, оксидов, селенидов. К халькогенам относятся неметаллы и металлы. В группе сверху вниз свойства меняются следующим образом:
- металлические свойства усиливаются;
- свойства окислителя ослабевают;
- электроотрицательность уменьшается;
- термическая устойчивость ослабевает.
Общая характеристика группы халькогенов:
- неметаллы – кислород, сера, селен;
- металлы – теллур, полоний;
- валентность: II – О; IV и VI – S; II, IV, VI – Se, Te, Po;
- электронная конфигурация – ns 2 np 4 ;
- гидриды – H2R;
- оксиды – RO2, RO3;
- кислородные кислоты – H2RO3, H2RO4.
По электронному строению халькогены относятся к р-элементам. На внешнем энергетическом уровне находится шесть электронов. До завершения р-орбитали не хватает двух электронов, поэтому в соединениях халькогены проявляют свойства окислителя. С увеличением в группе количества энергетических уровней связь с внешними электронами ослабевает, поэтому теллур и полоний являются восстановителями.
Находясь на границе металлов и неметаллов, теллур относится к металлоидам или полуметаллам. Является аналогом серы и селена, но менее активен.
Видео:Свойства кислорода. 8 класс.Скачать

Свойства
Наиболее активным элементом группы халькогенов является кислород. Это мощный окислитель, который проявляет четыре степени окисления – -2, -1, +1, +2.
Элемент
Физические свойства
Химические свойства
Газ. Образует две модификации – О2 и О3 (озон). О2 не имеет запаха и вкуса, плохо растворим в воде. Озон – голубоватый газ с запахом, хорошо растворимый в воде
Реагирует с металлами, неметаллами
Типичный неметалл. Твёрдое вещество с температурой плавления 115°С. Нерастворима в воде. Встречается три модификации – ромбическая, моноклинная, пластическая. Степень окисления – -2, -1, 0, +1, +2, +4, +6
Реагирует с кислородом, галогенами, неметаллами, металлами
Хрупкое твёрдое вещество. Полупроводник. Имеет три модификации – серый, красный, чёрный селен. Степень окисления – -2, +2, +4, +6
Реагирует со щелочными металлами, кислородом, водой
Внешне похож на металл. Полупроводник. Степень окисления – -2, +2, +4, +6
Реагирует с кислородом, щелочами, кислотами, водой, металлами, неметаллами, галогенами
Радиоактивный металл серебристого цвета. Степень окисления – +2, +4, +6
Реагирует с кислородом, галогенами, кислотами
К халькогенам также причисляют искусственно созданный ливерморий (Lv) или унунгексий (Uuh). Это 116 элемент периодической таблицы. Проявляет сильные металлические свойства.
Видео:34. Кислород. Химические свойства (часть 1)Скачать

Что мы узнали?
Халькогены – элементы шестой группы периодической таблицы Менделеева. В группе находятся три неметалла (кислород, сера, селен), металл (полоний) и полуметалл (теллур). Поэтому халькогены являются как окислителями, так и восстановителями. Металлические свойства усиливаются в группе сверху вниз: кислород – газ, полоний – твёрдый металл. К халькогенам также относится искусственно синтезированный ливерморий с сильными металлическими свойствами.
Видео:ЕГЭ ХИМИЯ | Халькогены | Сера и КислородСкачать

Халькогены – строение, общая характеристика в таблице
Элементы VI группы главной подгруппы называются халькогенами. К ним относятся кислород, сера, селен, теллур и полоний. Слово «халькоген» состоит из двух греческих слов, означающих «медь» или «руда» и «рождённый».
Видео:Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Описание
Халькогены в природе встречаются чаще всего в составе руды – сульфидов, пиритов, оксидов, селенидов. К халькогенам относятся неметаллы и металлы. В группе сверху вниз свойства меняются следующим образом:
- металлические свойства усиливаются;
- свойства окислителя ослабевают;
- электроотрицательность уменьшается;
- термическая устойчивость ослабевает.
Общая характеристика группы халькогенов:
- неметаллы – кислород, сера, селен;
- металлы – теллур, полоний;
- валентность: II – О; IV и VI – S; II, IV, VI – Se, Te, Po;
- электронная конфигурация – ns2np4;
- гидриды – H2R;
- оксиды – RO2, RO3;
- кислородные кислоты – H2RO3, H2RO4.
Рис. 1. Халькогены.
По электронному строению халькогены относятся к р-элементам. На внешнем энергетическом уровне находится шесть электронов. До завершения р-орбитали не хватает двух электронов, поэтому в соединениях халькогены проявляют свойства окислителя. С увеличением в группе количества энергетических уровней связь с внешними электронами ослабевает, поэтому теллур и полоний являются восстановителями.
Находясь на границе металлов и неметаллов, теллур относится к металлоидам или полуметаллам. Является аналогом серы и селена, но менее активен.
Видео:Химические свойства кислорода. Урок 18. Химия 7 класс.Скачать

Свойства
Наиболее активным элементом группы халькогенов является кислород. Это мощный окислитель, который проявляет четыре степени окисления – -2, -1, +1, +2.
Основные свойства халькогенов представлены в таблице.
Элемент
Физические свойства
Химические свойства
Газ. Образует две модификации – О2 и О3 (озон). О2 не имеет запаха и вкуса, плохо растворим в воде. Озон – голубоватый газ с запахом, хорошо растворимый в воде
Реагирует с металлами, неметаллами
Типичный неметалл. Твёрдое вещество с температурой плавления 115°С. Нерастворима в воде. Встречается три модификации – ромбическая, моноклинная, пластическая. Степень окисления – -2, -1, 0, +1, +2, +4, +6
Реагирует с кислородом, галогенами, неметаллами, металлами
Хрупкое твёрдое вещество. Полупроводник. Имеет три модификации – серый, красный, чёрный селен. Степень окисления – -2, +2, +4, +6
Реагирует со щелочными металлами, кислородом, водой
Внешне похож на металл. Полупроводник. Степень окисления – -2, +2, +4, +6
Реагирует с кислородом, щелочами, кислотами, водой, металлами, неметаллами, галогенами
Радиоактивный металл серебристого цвета. Степень окисления – +2, +4, +6
Реагирует с кислородом, галогенами, кислотами
К халькогенам также причисляют искусственно созданный ливерморий (Lv) или унунгексий (Uuh). Это 116 элемент периодической таблицы. Проявляет сильные металлические свойства.
Рис. 3. Ливерморий.
Видео:7. Халькогены (6 группа). Общая характеристика, химические свойства и способы получения серыСкачать

Что мы узнали?
Халькогены – элементы шестой группы периодической таблицы Менделеева. В группе находятся три неметалла (кислород, сера, селен), металл (полоний) и полуметалл (теллур). Поэтому халькогены являются как окислителями, так и восстановителями. Металлические свойства усиливаются в группе сверху вниз: кислород – газ, полоний – твёрдый металл. К халькогенам также относится искусственно синтезированный ливерморий с сильными металлическими свойствами.
🎥 Видео
Соединения серы. 9 класс.Скачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Халькогены. Сера (часть 1)Скачать

Общая характеристика халькогенов. КислородСкачать

Физические и химические свойства кислорода Применение кислородаСкачать

Химия. Халькогены. Сера. ТеорияСкачать

9 класс § 25 "Халькогены. Кислород".Скачать

Халькогены. Общая характеристика халькогенов. СераСкачать