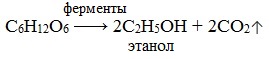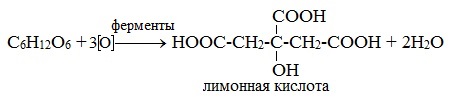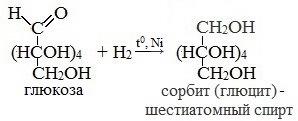Теория по теме Углеводы. Краткие конспект по углеводам. Классификация углеводов, химические свойства углеводов, способы получения углеводов. Свойства и получение моносахаридов (глюкоза, фруктоза), олигосахаридов (сахароза и др.), полисахаридов.
| Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3. |
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
- Классификация углеводов
- По числу структурных звеньев
- По числу атомов углерода в молекуле
- По размеру кольца в циклической форме молекулы
- Химические свойства, общие для всех углеводов
- 1. Горение
- 2. Взаимодействие с концентрированной серной кислотой
- Моносахариды
- Глюкоза
- Химические свойства глюкозы
- Водный раствор глюкозы
- Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
- Реакции на карбонильную группу — CH=O
- Получение глюкозы
- Гидролиз крахмала
- Синтез из формальдегида
- Фотосинтез
- Фруктоза
- Дисахариды
- Сахароза (свекловичный или тростниковый сахар) С12Н22О11
- Мальтоза С12Н22О11
- Полисахариды
- Крахмал
- Свойства крахмала
- Целлюлоза
- Свойства целлюлозы
- Химические свойства глюкозы уравнения реакций
- Специфические свойства
- Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
- Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
- Реакции с участием полуацетального гидроксила
- Реакции окисления
- Химические свойства глюкозы уравнения реакций
- Таблица Менделеева
- Универсальная таблица растворимости
- Коллекция таблиц к урокам по химии
- Химические свойства глюкозы. Получение, применение
Видео:Свойства глюкозы. 11 класс.Скачать
Классификация углеводов
Видео:Качественная реакция глюкозы с гидроксидом меди (II)Скачать

По числу структурных звеньев
- Моносахариды — содержат одно структурное звено.
- Олигосахариды — содержат от 2 до 10 структурных звеньев (дисахариды, трисахариды и др.).
- Полисахариды — содержат n структурных звеньев.
Некоторые важнейшие углеводы:
| Моносахариды | Дисахариды | Полисахариды |
| Глюкоза С6Н12О6 Дезоксирибоза С5Н10О4 | Сахароза С12Н22О11 Целлобиоза С12Н22О11 | Целлюлоза (С6Н10О5)n Крахмал(С6Н10О5)n |
Видео:ХИМИЧЕСКИЕ СВОЙСТВА ГЛЮКОЗЫСкачать

По числу атомов углерода в молекуле
- Пентозы — содержат 5 атомов углерода.
- Гексозы — содержат 6 атомов углерода.
- И т.д.
Видео:Углеводы. Тема 33. Химические свойства глюкозыСкачать

По размеру кольца в циклической форме молекулы
- Пиранозы — образуют шестичленное кольцо.
- Фуранозы — содержат пятичленное кольцо.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства, общие для всех углеводов
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

1. Горение
Все углеводы горят до углекислого газа и воды.
| Например, при горении глюкозы образуются вода и углекислый газ |
Видео:Реакция глюкозы с гидроксидом меди (II)Скачать

2. Взаимодействие с концентрированной серной кислотой
Концентрированная серная кислота отнимает воду от углеводов, при этом образуется углерод С («обугливание») и вода.
| Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода |
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Моносахариды
| Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных. |
Моносахариды являются структурными звеньями олигосахаридов и полисахаридов.
Важнейшие моносахариды
| Название и формула | Глюкоза C6H12O6 | Фруктоза C6H12O6 | Рибоза C5H10O5 |
| Структурная формула |  |  |  |
| Классификация |
|
|
|
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Глюкоза
Глюкоза – это альдегидоспирт (альдоза).
Она содержит шесть атомов углерода, одну альдегидную и пять гидроксогрупп.
Глюкоза существует в растворах не только в виде линейной, но и циклических формах (альфа и бета), которые являются пиранозными (содержат шесть звеньев):
| α-глюкоза | β-глюкоза |
 |  |
Видео:Проклятая химическая реакция 😜 #shortsСкачать

Химические свойства глюкозы
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:
Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
При взаимодействии свежеосажденного гидроксида меди (II) с глюкозой (и другими моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.
- Реакция «серебряного зеркала»
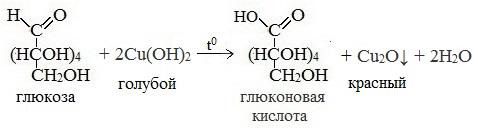
- Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):
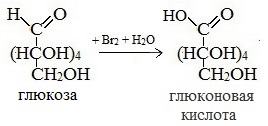
- Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:
- Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
| Концентрированная азотная кислота окисляет не только альдегидную группу, но и гидроксогруппу на другом конце углеродной цепи. |
- Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:
- Брожение глюкозы. Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
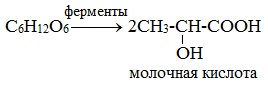
Молочнокислое брожение. При молочнокислом брожении глюкозы образуется молочная кислота:
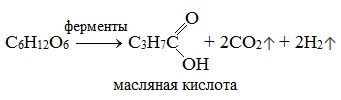
Маслянокислое брожение. При маслянокислом брожении глюкозы образуется масляная кислота (внезапно):
- Образование эфиров глюкозы (характерно для циклической формы глюкозы).
Глюкоза способна образовывать простые и сложные эфиры.
Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
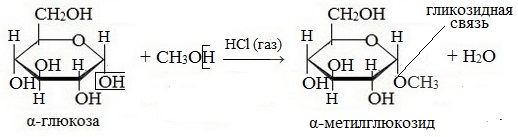
Например, α-D-глюкоза взаимодействует с метанолом.
При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):
| Простые эфиры глюкозы получили название гликозидов. |
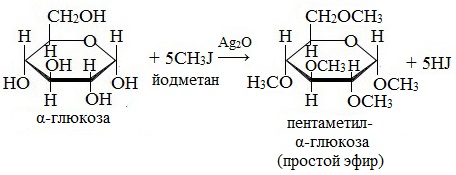
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
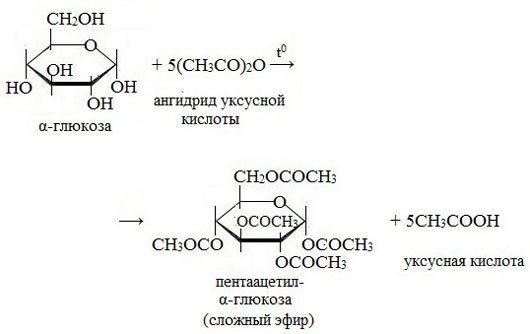
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
| Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы): |
Видео:Реакция глюкозы с аммиачным раствором оксида серебраСкачать

Получение глюкозы
Гидролиз крахмала
В присутствии кислот крахмал гидролизуется:
Синтез из формальдегида
Реакция была впервые изучена А.М. Бутлеровым. Синтез проходит в присутствии гидроксида кальция:
Фотосинтез
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

Фруктоза
| Фруктоза — структурный изомер глюкозы. Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы). |
Она содержит шесть атомов углерода, одну кетоновую группу и пять гидроксогрупп.
| Фруктоза | α-D-фруктоза | β-D-фруктоза |
 |  |  |
Фруктоза – кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза.
В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы связаны с наличием кетонной и пяти гидроксильных групп.
При гидрировании фруктозы также получается сорбит.
Видео:Взаимодействие сахара с концентрированной серной кислотойСкачать

Дисахариды
| Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой). |
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом:
В молекуле сахарозы гликозидный атом углерода глюкозы связан из-за образования кислородного мостика с фруктозой, поэтому сахароза не образует открытую (альдегидную) форму.
| Поэтому сахароза не вступает в реакции альдегидной группы – с аммиачным раствором оксида серебра с гидроксидом меди при нагревании. Такие дисахариды называют невосстанавливающими, т.е. не способными окисляться. |
Сахароза подвергается гидролизу подкисленной водой. При этом образуются глюкоза и фруктоза:
Видео:Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать

Мальтоза С12Н22О11
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.
| Мальтоза является восстанавливающим дисахаридом (одно из циклических звеньев может раскрываться в альдегидную группу) и вступает в реакции, характерные для альдегидов. |
При гидролизе мальтозы образуется глюкоза.
Видео:Опыты по химии. Обнаружение глюкозы в виноградном соке и медеСкачать

Полисахариды
| Полисахариды — это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов. |
Основные представители — крахмал и целлюлоза — построены из остатков одного моносахарида — глюкозы.
Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (C6H10O5)n, но совершенно различные свойства.
Это объясняется особенностями их пространственного строения.
Крахмал состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы:
Видео:10 класс Химические свойства, получение и применение глюкозыСкачать

Крахмал
Крахмалом называется полисахарид, построенный из остатков циклической α-глюкозы.
В его состав входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 — 1000 остатков α-глюкозы (средняя молекулярная масса 160 000) и имеет неразветвленное строение.
Амилопектин имеет разветвленное строение и гораздо большую молекулярную массу, чем амилоза.
Свойства крахмала
- Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется:
- Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
- Качественная реакция на крахмал: синее окрашивание с раствором йода.
Видео:8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

Целлюлоза
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.
Свойства целлюлозы
- Образование сложных эфиров с азотной и уксусной кислотами.
Нитрование целлюлозы.
Так как в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании целлюлозы избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина:
Ацилирование целлюлозы.
При действии на целлюлозу уксусного ангидрида (упрощённо-уксусной кислоты) происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН.
Получается ацетат целлюлозы – ацетатное волокно.
- Гидролиз целлюлозы.
Целлюлоза, подобно крахмалу, в кислой среде может гидролизоваться, в результате тоже получается глюкоза. Но процесс идёт гораздо труднее.
Видео:Химия 10 класс (Урок№10 - Углеводы. Глюкоза. Олигосахариды. Сахароза.)Скачать

Химические свойства глюкозы уравнения реакций
Химические свойства глюкозы, как и других альдоз, обусловлены присутствием в ее молекуле: а)альдегидной группы; б) спиртовых гидроксилов; в) полуацетального (гликозидного) гидроксила.
Специфические свойства
1. Брожение (ферментация) моносахаридов
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожению подвергаются в основном гексозы в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1) Спиртовое брожение
2) Молочнокислое брожение
3) Маслянокислое брожение
4) Лимоннокислое брожение
Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
1. Восстановление (гидрирование) с образованием многоатомного спирта
В ходе этой реакции карбонильная группа восстанавливается и образуется новая спиртовая группа:
Cорбит содержится во многих ягодах и фруктах, особенно много сорбита в плодах рябины.
2. Окисление
1) Окисление бромной водой
Качественные реакции на глюкозу как альдегид!
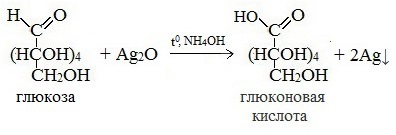
Протекающие в щелочной среде при нагревании реакции с аммиачным раствором Ag2O (реакция серебряного зеркала») и с гидроксидом меди (II) Cu (OH)2 приводят к образованию смеси продуктов окисления глюкозы.
2) Реакция серебряного зеркала
Соль этой кислоты – глюконат кальция – известное лекарственное средство.
Видеоопыт «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
3) Окисление гидроксидом меди (II)
В ходе этих реакций альдегидная группа – СНО окисляется до карбоксильной группы – СООН.
Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
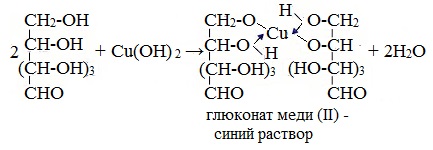
1. Взаимодействие с Cu (ОН)2 с образованием глюконата меди (II)
Качественная реакция на глюкозу как многоатомный спирт!
Подобно этиленгликолю и глицерину, глюкоза способна растворять гидроксид меди (II), образуя растворимое комплексное соединение синего цвета:
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет.
В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение.
Видеоопыт «Качественная реакция глюкозы с гидроксидом меди (II)»
2. Взаимодействие с галогеналканами с образованием простых эфиров
Являясь многоатомным спиртом, глюкоза образует простые эфиры:
Реакция происходит в присутствии Ag2O для связывания выделяющегося при реакции НI.
3. Взаимодействие с карбоновыми кислотами или их ангидридами с образованием сложных эфиров.
Например, с ангидридом уксусной кислоты:
Реакции с участием полуацетального гидроксила
1. Взаимодействие со спиртами с образованием гликозидов
Гликозиды – это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения.
Содержащийся в циклических формах глюкозы полуацетальный (гликозидный) гидроксил является очень реакционноспособным и легко замещается на остатки различных органических соединений.
В случае глюкозы гликозиды называются глюкозидами. Связь между углеводным остатком и остатком другого компонента называется гликозидной.
Гликозиды построены по типу простых эфиров.
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу:
В данных условиях в реакцию вступает только гликозидный гидроксил, спиртовые гидроксильные группы в реакции не участвуют.
Гликозиды играют чрезвычайно важную роль в растительном и животном мире. Существует огромное число природных гликозидов, в молекулах которых с атомом С (1) глюкозы остатки самых различных соединений.
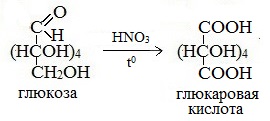
Реакции окисления
Более сильный окислитель – азотная кислота НNO3 – окисляет глюкозу до двухосновной глюкаровой (сахарной) кислоты:
В ходе этой реакции и альдегидная группа – СНО и первичная спиртовая группа — СН2ОН окисляются до карбоксильных – СООН.
Видеоопыт «Окисление глюкозы кислородом воздуха в присутствии метеленового голубого»
Видео:Моносахариды. Глюкоза. 11 класс.Скачать

Химические свойства глюкозы уравнения реакций
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Химические свойства глюкозы. Получение, применение
I. Получение глюкозы
1. В промышленности
2. В лаборатории
- Из формальдегида (1861 г А.М. Бутлеров):
3. В природе
4. Другие способы
сахароза глюкоза фруктоза
II. Химические свойства глюкозы
1. Специфические свойства
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1.Спиртовое брожение:
2. Молочнокислое брожение:
3. Маслянокислое брожение:
2. Свойства альдегидов
1. Реакция серебряного зеркала:
2. Окисление гидроксидом меди (II):
3. Восстановление:
сорбит – шестиатомный спирт
3. Свойства многоатомных спиртов
1. Образование простых эфиров со спиртами
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
2. Качественная реакция многоатомных спиртов
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение – ярко синего цвета.
4. Реакции окисления
III. Применение
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению. На практике используется также спиртовое брожение глюкозы, например при производстве пива.