К элементам главной подгруппы VII группы периодической таблицы Менделеева относятся элементы с общим названием «галогены»:
- Фтор F
- Хлор Cl
- Бром Br
- Йод I
- Астат At
- Общая характеристика галогенов
- Нахождение в природе галогенов
- Способы получения фтора
- Физические свойства фтора
- Химические свойства фтора
- Способы получения хлора
- Физические свойства хлора
- Химические свойства хлора
- Способы получения брома
- Физические свойства брома
- Химические свойства брома
- Способы получения йода
- Физические свойства йода
- Химические свойства йода
- Химические свойства фтора
- Содержание
- История
- Происхождение названия
- Распространение в природе
- Физические свойства
- Электронное строение
- Строение молекулы
- Кристаллы
- Изотопный состав
- Ядерные свойства изотопов фтора
- Магнитные свойства ядер
- Химические свойства
- Получение
- Лабораторный метод
- Промышленный метод
- Хранение
- Применение
- Ракетная техника
- Применение в медицине
- Биологическая и физиологическая роль
- Токсикология
- 🎬 Видео
Видео:Галогены: фтор, хлор, бром и иод | Химические свойства #галогены #химия #видеоурок #егэхимияСкачать

Общая характеристика галогенов
От F к At (сверху вниз в периодической таблице)
Увеличивается
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
Электронные конфигурации у данных элементов схожи, они содержат 7 электронов на внешнем слое ns 2 np 5 :
Br – 3d 10 4s 2 4p 5 ;
I — 4d 10 5s 2 5p 5 ;
At – 4f 14 5d 10 6s 2 6p 5
Электронная конфигурация фтора и хлора
Электронная конфигурация брома и йода
Видео:Химия 70. Химические свойства фтора — Академия занимательных наукСкачать

Нахождение в природе галогенов
Галогены являются химически активными веществами, в связи с чем, в природе они встречаются только в виде соединений. Их распространённость в земной коре снижается при увеличении атомного радиуса (от фтора к иоду). Например, содержание астата в земной коре исчисляется граммами.
Наиболее распространённые соединения фтора — флюорит CaF2, криолит Na3AlF6 и др., хлора — каменная соль (галит) NaCl, сильвин KCl и сильвинит KCl⋅NaCl.
Бром и иод не образуют индивидуальных минералов, но их соединения содержатся в морской воде и могут накапливаться водорослями.
Способы получения фтора
Фтор получают методом электролиза расплава гидрофторида калия (смеси HF и KF):
Физические свойства фтора
Фтор при обычной температуре — зеленовато-жёлтый ядовитый газ, с резким запахом, очень реакционноспособный, хорошо растворим в жидких водороде и кислороде.
Химические свойства фтора
Фтор является самым сильным окислителем из всех простых веществ. Непосредственно он не взаимодействует только с N2, Не, Ne, Аr, а при нормальных условиях также и с O2.
Взаимодействие с простыми веществами
С кислородом
Реакция протекает при электрическом разряде (2100-2400 В, 25-30 мА), температуре от -196°C до -183°C и давлении 12 мм рт.ст. с образованием дифторида трикислорода (триоксодифторид, фторид озона) или фторида кислорода:
С галогенами (Cl, Br, I)
Фтор вступает в реакции с другими галогенами:
Например, Cl2 + F2 → 2ClF
С водородом
Взаимодействует с водородом со взрывом даже в темноте:
С серой
Реакция с серой протекает легко даже при сильном охлажлении:
С углеродом
Реакция окисления порошкообразного углерода сопровождается самовоспламенением последнего:
С азотом
При нагревании фтор реагирует и с азотом:
С фосфором
Фтор взаимодействует с P энергично (со взрывом) на свету и в темноте, даже при охлаждении жидким N2:
С кремнием
Взаимодействует с кремнием с образованием фторида кремния
C инертными газами
Окисляет ксенон, образуя фторид ксенона:
С металлами
При взаимодействии с металлами образуются фториды:
- К, Na, Pb, Feзагораются при обычной температуре на свету. С щелочными металлами реакция протекает со взрывом:
- Mg, Zn, Sn, Al, Ag, Cu и др. загораются на свету при слабом нагревании:
- с малоактивными металлами – Au, Pt реагирует при нагревании до 300-400°С
Взаимодействие со сложными веществами
С водой
Фтор активно разлагает воду с образованием таких соединений, как фториды кислорода OF2, O2F2; пероксид водорода Н2O2; кислород, озон, фтороводород:
С кислотами
- Взаимодействует с безводной азотной кислотой при комнатной температуре с образованием диоксида-гипофторита азота и фтороводорода:
- С серной кислотой образует гексафторид серы, фтороводород и кислород:
С щелочами и аммиаком
Фтор окисляет щелочи:
Реагирует с газообразным аммиаком:
С солями
Не взаимодействует
Взаимодействие фтора с водными растворами солей невозможны, т.к. он ступает в реакцию с водой.
С оксидами
Реагирует с оксидом кремния, который загорается в атмосфере F2:
Способы получения хлора
Промышленный способ
Электролиз расплавов или водных растворов хлоридов, чаще – NaCl.
- Электролиз расплава хлорида натрия:
A(+): 2Cl − ̶ 2e → Cl2 0
2Na + + 2Cl − → 2Na º + Cl2º
Таким образом, получаем:
- Электролиз раствора хлорида натрия.
A(+): 2Cl − ̶ 2e → Cl2 0
Таким образом, получаем:
Лабораторный способ
Окисление концентрированной HCI сильными окислителями:
Физические свойства хлора
Хлор Cl2 при обычной температуре – тяжелый, желто-зеленый газ с резким удушающим запахом.
Cl2 в 2,5 раза тяжелее воздуха, малорастворим в воде (
6,5 г/л); хорошо растворим в неполярных органических растворителях. В свободном состоянии встречается только в вулканических газах.
Химические свойства хлора
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, с образованием в устойчивые хлорид-ионы:
Взаимодействие с простыми веществами
С кислородом
Непосредственно не взаимодействует
С галогенами
Хлор взаимодействует с другими галогенами – более активные галогены окисляют менее активные. В зависимости от условий могут получиться различные соединения:
С водородом
Реакция с водородом при обычных условиях не протекает. Однако, при нагревании, УФ — освещении или электрическом разряде реакция протекает со взрывом:
Непосредственно не взаимодействует
С фосфором
Непосредственно не взаимодействует
С кремнием
2Cl2 + Si = SiCl4 (при нагревании)
С металлами
- Активные металлы самовоспламеняются и горят в атмосфере сухого газообразного хлора:
- Окисление малоактивных металлов происходит легче влажным хлором или его водными растворами:
Взаимодействие со сложными веществами
Окисляет сложные вещества:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кипячении)
С водой
При растворении хлора в воде вступает в реакцию диспропорционирования (самоокисления-самовосстановления), с образованием хлорноватистой кислоты:
С водными растворами щелочей
При взаимодействии с щелочами хлор диспропорционирует с образованием солей, состав которых зависит от условий проведения реакции:
- с холоднымраствором щелочи образуются хлорид и гипохлорит:
- с горячимраствором щелочи образуются хлорид и хлорат:
- Хлор также растворяется в холодном растворе гидроксида кальция:
Эти реакции имеют важное практическое значение, приводят к получению гипохлоритов — КClO3 и Са(ClO)2; хлората калия (бертолетова соль) — КClO3
С солями
Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов:
- замещение атомов водорода в молекулах органических соединений:
- присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
HC ≡ CH + 2Cl2 → Cl2HC — CHCl2 1,1,2,2-тетрахлорэтан
Способы получения брома
Промышленный способ
- Исходное сырьё для получения брома — морская вода, озёрные и подземные рассолы и щелока калийного производства, содержащие бром в виде бромид-иона Br-
Бром втесняют при помощи хлора:
Далее бром отгоняют из раствора водяным паром или воздухом.
Лабораторный способ
- В лаборатории для получения брома используют сильные окислители:
Физические свойства брома
В обычных условиях бром – красно-бурая жидкость с резким зловонным запахом. При Т=-7,2°C жидкий бром застывает, образуя красно-коричневые игольчатые кристаллы.
Пары брома жёлто-бурого цвета, Ткип = 58,78°C.
В воде бром растворяется лучше других галогенов (3,58 г брома в 100 г H2O при 20°C). Хорошо растворим во многих органических растворителях.
Бромная вода имеет желто-бурую окраску, быстро исчезающую, при взаимодействии растворенного Br2 с каким-либо веществом. «Обесцвечивание бромной воды» — широко используется в качестве теста на обнаружение в растворе многих неорганических и органических веществ.
Химические свойства брома
Химические свойства брома сходны с хлором. Различаются только условия протекания реакций.
Взаимодействие с простыми веществами
С металлами
Жидкий бром сильный окислитель. Например, железо и алюминий самовозгораются при соприкосновении с бромом даже при обычной температуре.
С водородом
Взаимодействие брома с водородом происходит лишь при повышенной температуре. Реакция эндотермической и обратимой.
С азотом, углеродом, кислородом и благородными газами
Непосредственно не взаимодействует
С галогенами
Бром окисляется более активными галогенами:
Взаимодействие со сложными веществами
- Бром окисляет сложные соединения:
- диспропорционирует в водном растворе:
3BrO — ↔ BrO3 — + 2Br —
4BrO — ↔ BrO4 — + 3Br —
Обесцвечивание бромной воды
Обесцвечивание бромной воды – качественная реакция на многие неорганические и органические соединения:
- в воде SO2 и H2S в газообразном и растворенном виде, а также растворимые сульфиты и сульфиды реагируют с бромной водой, обесцвечивая ее:
- Фенол и анилин также легко взаимодействуют с бромной водой:
Способы получения йода
Промышленный способ
- Йод, также как и бром, извлекают из морской воды, соленых озер, подземных рассолов и буровых вод, где он содержится в виде I — .
- Получение свободного йода с помощью различных окислителей, чаще всего газообразного хлора:
Лабораторный способ
- Йод можно получить также как и хлор или бром действием различных окислителей (КМnО4, МnО2, КСlO3, КВrО3, FеСl3 и СuSO4) на иодоводородную кислоту:
2 FеC3 + 2 НI = 2 FeCl2 + I2 + 2 НСl
Физические свойства йода
Свободный йод I2 при обычной температуре — черно-серое с фиолетовым оттенком кристаллическое вещество с металлическим блеском. Легко возгоняется. Пары йода имеют своеобразный запах и очень ядовиты.
Среди галогенов I2 обладает самой меньшей растворимостью в воде, однако он хорошо растворим в спирте и других органических растворителях.
Химические свойства йода
Химическая активность йода – наименьшая по сравнению с другими галогенами. Со многими элементами йод непосредственно не взаимодействует, а с некоторыми реагирует только при повышенных температурах (водород, кремний, многие металлы).
Йод-крахмальная реакция
Обнаружить I2 даже в самой минимальной концентрации можно с помощью раствора крахмала, который при наличии I2 окрашивается в грязно-синий цвет.
Йод-крахмальная реакция используется при качественном обнаружении йода, а также его количественного анализа
Взаимодействие с простыми веществами
С водородом
Реакция обратима и возможна только при высокой температуре:
С металлами
При добавлении капли воды в качестве катализатора цинк, железо и алюминий в смеси с порошком йода горят, образуя йодиды:
С азотом, углеродом, кислородом
Непосредственно не взаимодействует
Взаимодействие со сложными веществами
С водой
Частично реагирует с водой (реакция диспропорционирования):
С щелочью
Диспропорционирует в водном растворе щелочи:
C аммиаком
C аммиаком образует аддукт нитрид трииодида:
С иодидами щелочных металлов
Молекулы галогенов присоединяются к иодидам щелочных металлов с образованием полииодидов (периодидов):
С окислителями
Йод проявляет восстановительные свойства в реакциях с сильными окислителями:
C восстановителями
Иод менее сильный окислитель, чем фтор, хлор и бром. Восстановители, такие как H2S, Na2S2O3 и др. восстанавливают его до иона I − :
Видео:Галогены. 9 класс.Скачать

Химические свойства фтора
Большая энергия связей между атомом фтора и атомами других элементов является следствием большой электроотрицательности фтора и маленьким размером его атома. Благодаря малой энергии связи молекула фтора легко диссоциирует на атомы и энергия активации реакций со фтором обычно не велика, поэтому процессы с участием фтора протекают очень быстро.
Для фтора характерно:
1. Отсутствие положительных степеней окисления в соединениях с другими элементами.
2. Чрезвычайно низкая энергия активации реакций.
3. Большое выделение энергии при переходе молекулы фтора в анионы F – .
4. Стремление максимально использовать валентные электроны партнеров. Именно в соединениях со фтором реализуются высшие степени окисления многих элементов: BiF5, SF6, IF7, OsF7, CuF3 и др.
Итак, фтор – сильнейший окислитель. По образному выражению академика А. Е. Ферсмана его можно назвать “всесъедающим”.
Щелочные металлы, свинец, железо и большинство порошков других металлов загораются в атмосфере фтора при комнатной температуре. На некоторые металлы (алюминий, железо, никель, медь, цинк, марганец, магний) фтор на холоде не действует из-за образования поверхностной пленки фторидов, защищающей металл от дальнейшего взаимодействия. Поэтому сплавы этих металлов или никеля используют для хранения фтора. Однако при нагревании фтор реагирует со всеми металлами, в т.ч. с золотом и платиной.
Со многими неметаллами (водород, йод, бром, сера, фосфор, мышьяк, сурьма, углерод, кремний, бор) фтор взаимодействует на холоде; реакции протекают со взрывом или с образованием пламени.
С серой, фосфором и сурьмой фтор взаимодействует даже при температуре жидкого воздуха (-190 °C):
С водородом фтор взаимодействует уже при температуре -252 °C
Криптон взаимодействует с фтором под действием электрического разряда, а ксенон горит в атмосфере фтора ярким пламенем.
С кислородом фтор реагирует при низких тепературах в электрических разрядах с образованием эндотермических фторидов кислорода. O2 + F2 = O2F2, -190 °C, электрич. разряд.
При нагревании с фтором реагирует хлор с образованием ClF и ClF3. Бром и йод при взаимодействии с фтором образуют следующие соединения: BrF, BrF3, BrF5, IF, IF3, IF5, IF7.
При нагревании фтор вступает в реакцию и с азотом:
Непосредственно фтор не реагирует только с углеродом (в виде алмаза), гелием, неоном и аргоном.
В реакциях с фтором в роли восстановителей выступают такие вещества как азотная и серная кислоты:
Под действием фтора разлагается вода:
0 °C: H2O(тв) + F2 = HF + HOF (фтороксигенат водорода)
В атмосфере фтора горят такие стойкие вещества, как стекло (в виде ваты), асбест, кварц:
Катализатором этой реакции является вода. С совершенно сухим кварцем или стеклом фтор не взаимодействует.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

| Фтор | |
|---|---|
| Жёлтая жидкость (при криогенных температурах), бесцветный газ (в толстых слоях — зеленовато-жёлтый, н. у.) | |
 |
(молярная масса)
(первый электрон)
ж.: 1,516 −188 г/см³,
тв.: 1,7 −228 г/см³ или 1,810 −225 г/см³
β -фтор: a = 5,5314(15)
Фтор (устар. флюор ; F, лат. fluorum ) — химический элемент 17-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA) с атомным номером 9. Самый химически активный неметалл и сильнейший окислитель, самый лёгкий элемент из группы галогенов. Как простое вещество при нормальных условиях фтор представляет собой двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Токсичен.
Видео:Химия | седьмая группа | фтор | 3 | химические свойстваСкачать

Содержание
- 1 История
- 1.1 Происхождение названия
- 2 Распространение в природе
- 3 Физические свойства
- 3.1 Электронное строение
- 3.1.1 Строение молекулы
- 3.2 Кристаллы
- 3.3 Изотопный состав
- 3.3.1 Ядерные свойства изотопов фтора
- 3.3.2 Магнитные свойства ядер
- 3.1 Электронное строение
- 4 Химические свойства
- 5 Получение
- 5.1 Лабораторный метод
- 5.2 Промышленный метод
- 6 Хранение
- 7 Применение
- 7.1 Ракетная техника
- 7.2 Применение в медицине
- 8 Биологическая и физиологическая роль
- 9 Токсикология
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 г. Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — «разрушение, порча, вред»), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от лат. fluorum (от fluere — «течь», — по способности некоторых соединений фтора, например флюорита (CaF2), понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть.
Видео:Химические свойства фтора. ЕГЭ химияСкачать

Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук.
В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода.
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета.
Электронное строение
Электронная конфигурация атома фтора: 1s 2 2s 2 2p 5 .
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2 P3/2.
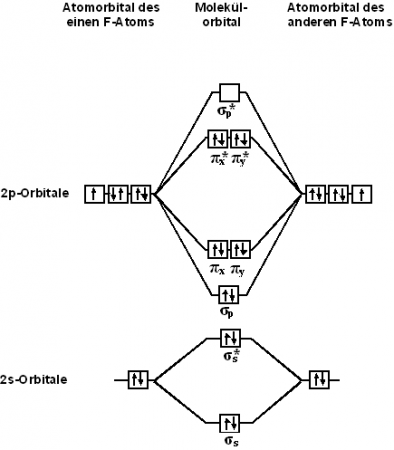
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
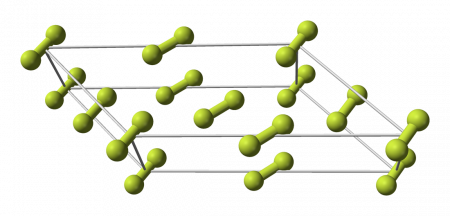
Кристаллы
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
- α -фтор, непрозрачный, твёрдый и хрупкий, существует при температуре ниже 45,6 K, кристаллическая решётка моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 0,54780(12) нм , b = 0,32701(7) нм , c = 0,72651(17) нм , β = 102,088(18)° , Z = 4 , d = 1,98 г/см 3 с объёмом элементарной ячейки 0,12726(5) нм 3 (при 10 К);
- β -фтор, прозрачный и менее плотный и твёрдый, существует в интервале температур от 45,6 К до точки плавления 53,53 K , кристаллическая решётка кубической сингонии (примитивная решётка), пространственная группа Pm 3 n, параметры ячейки a = 0,65314(15) нм , Z = 8 , d = 1,81 г/см 3 с объёмом элементарной ячейки 0,27862(11) нм 3 (при 48 К ), решётка изотипична γ -фазе O2 и δ -фазе N2. Следует отметить, что в раннем (но единственном проведённом до 2019 года) эксперименте по изучению структуры β -фтора рентгенографическая плотность кристалла была оценена как 1,70(5) г/см 3 , и эта плотность твёрдого фтора цитируется в большинстве справочников. Более точное современное измерение даёт 1,8104(12) г/см 3 .
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза ромбической сингонии у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы α -фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет 0,1404(12) нм .
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву.
Изотопный состав
Фтор является моноизотопным элементом: в природе существует только один стабильный изотоп фтора 19 F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18m F. Самым долгоживущим из радиоактивных изотопов фтора является 18 F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17 F | 17,0020952 | 64,5 c | β + -распад в 17 O | 5/2 | 4,722 |
| 18 F | 18,000938 | 1,83 часа | β + -распад в 18 O | 1 | |
| 19 F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20 F | 19,9999813 | 11 c | β − -распад в 20 Ne | 2 | 2,094 |
| 21 F | 20,999949 | 4,2 c | β − -распад в 21 Ne | 5/2 | |
| 22 F | 22,00300 | 4,23 c | β − -распад в 22 Ne | 4 | |
| 23 F | 23,00357 | 2,2 c | β − -распад в 23 Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19 F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР- 19 F являются достаточно характеристичными для фторорганических соединений.
Видео:Фтор. Видеоурок 22. Химия 9 класс.Скачать

Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов) и с большинством из них — с горением и взрывом. Образует соединения со всеми химическими элементами, кроме гелия, неона, аргона.
К воздействию фтора при комнатной температуре устойчивы некоторые металлы за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
В атмосфере фтора горят даже вода и платина.
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять в электрическом разряде кислород, образуя дифторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
Не реагирует с гелием, неоном, аргоном, азотом, кислородом, тетрафторметаном. При комнатной температуре не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Получение
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Лабораторный метод
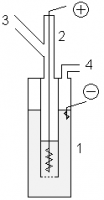
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Видео:Решаем два варианта Добротина за 2 часаСкачать

Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются плёнкой фторидов, которая защищает от дальнейшей реакции с фтором).
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Применение
Фтор используется для получения:
- фреонов — широко распространённых хладагентов;
- фторопластов — химически инертных полимеров;
- элегаза SF6 — газообразного изолятора, применяемого в высоковольтной электротехнике;
- гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;
- гексафтороалюмината натрия — электролита для получения алюминия электролизом;
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами;
Ракетная техника
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих ракетных топлив. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
Фторированные углеводороды (например перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил, флуоксетин, галоперидол и др.). Фториды натрия, калия и др. применяются для профилактики кариеса (см. ниже).
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор в основном содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно.
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %.
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Токсикология
Фтор представляет собой чрезвычайно агрессивное ядовитое вещество. Является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода. Резорбтивное действие объясняется возможностью фтора вступать в свободнорадикальные реакции с тканями организма. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век.
🎬 Видео
Галогены (F, Cl, Br, I). Химические свойстваСкачать
9 класс. Галогены. Химические свойства.Скачать
КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

8 класс. Составление уравнений химических реакций.Скачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Водород/химические свойства водорода/8 классСкачать