Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
- I. Реакции с участием гидроксильной группы
- II . Реакции, с участием бензольного кольца
- III. Реакция окисления
- IV. Качественная реакция! — обнаружение фенола
- Урок по химии «Химические свойства фенола» (естественно-научный профиль). 10-й класс
- Презентация к уроку
- Фенолы
- Классификация фенолов
- По числу гидроксильных групп:
- Строение фенолов
- Химические свойства фенолов
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции фенола по бензольному кольцу
- 2.1. Галогенирование
- 2.2. Нитрование
- 3. Поликонденсация фенола с формальдегидом
- 4. Взаимодействие с хлоридом железа (III)
- 5. Гидрирование (восстановление) фенола
- Получение фенолов
- 1. Взаимодействие хлорбензола с щелочами
- 2. Кумольный способ
- 3. Замещение сульфогруппы в бензол-сульфокислоте
- 🔥 Видео
I. Реакции с участием гидроксильной группы
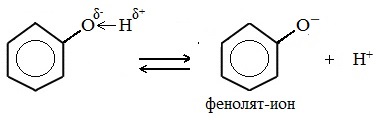
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
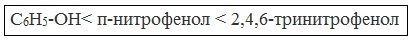
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 — , Br — )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
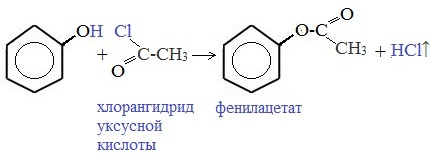
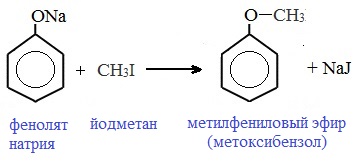
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II . Реакции, с участием бензольного кольца
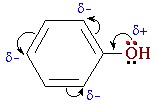
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
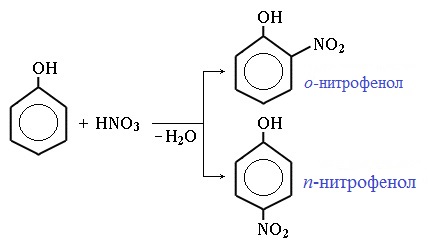
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
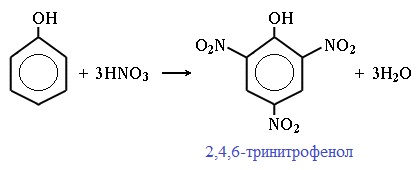
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.
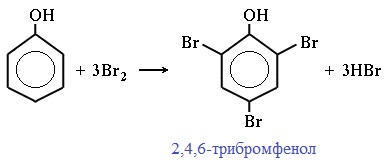
2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ):
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: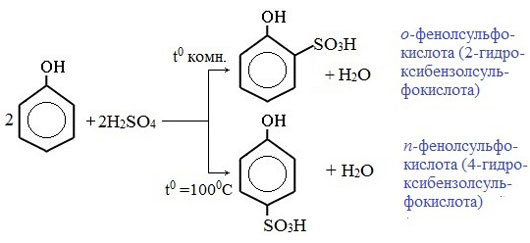
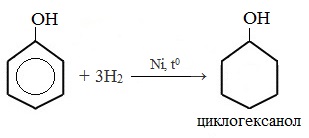
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
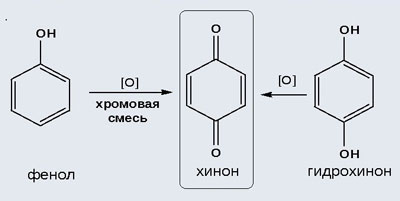
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! — обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Видео:9.3. Фенол: Химические свойстваСкачать

Урок по химии «Химические свойства фенола» (естественно-научный профиль). 10-й класс
Класс: 10
Презентация к уроку
Форма урока: комбинированный (2 часа).
Цели:
- Образовательные: на основе представлений о составе и строении фенола рассмотреть химические свойства; дать представление о химии полимеров и реакции поликонденсации; охарактеризовать связь химии с жизнью.
- Развивающие: совершенствовать умение сравнивать, обобщать, делать выводы о свойствах веществ на основе строения и о строении веществ по их свойствам, применять знания для составления прогнозов и объяснений, развивать умение применять приобретенные знания в нестандартных ситуациях.
- Воспитательные: развивать умение работать в парах и малых группах, прислушиваться к мнению друзей, обратить внимание на применимость закона диалектики о переходе количественных изменений в качественные.
Оборудование: мультимедийная установка, шаростержневые модели бензола, этилового спирта, презентация “Химические свойства фенола”.
На ученических столах: коллекция изделий на основе фенолформадегильной смолы, FeCl3, чайная заварка.
1. Организационный момент.
2. Актуализация опорных знаний и мотивация познавательной деятельности.
Учитель: Предлагает ответить на вопросы (Слайды: 1, 2) и наводит на определение темы и целей урока.
- Какие вещества называются фенолами?
- По числу гидроксогрупп какие различают фенолы?
Учитель: В основе учения об органических веществах лежит теория химического строения А.М.Бутлерова. Объясните почему?
(Ответ: Эта теория раскрывает взаимосвязь между строением веществ и их свойствами, показывает, что свойства веществ неслучайные).
Из каких двух знакомых фрагментов состоит молекула фенола?
Сформулируйте 3 положение теории А.М.Бутлерова.
3. Определение темы урока, целей и задач урока.
Учитель задаёт вопрос: Как вы считаете, какой будет тема урока?
(Ученики высказывают версии, формулируют с помощью учителя тему урока.
Записывают тему урока в тетрадь). Слайд 3.
4. Изучение нового материала.
Учитель: Свойствами каких соединений формально должен обладать фенол?
(Ответ: фенол должен сочетать свойства аренов (бензола) и одноатомных спиртов).
Учитель: Оказывается, это не совсем так.
Именно поэтому фенолы рассматриваются отдельно от класса спиртов.
Учитель: Как Вы думает, в чем причина?
(Ответ: причина кроется в том, что в результате взаимного влияния гидроксильной группы и ароматического радикала химические свойства этих фрагментов изменяются, а фенол в целом приобретает некоторые особенные свойства). (Слайд: 7).
4.1. Кислотные свойства фенола.
Ученики предполагают, что для фенола характерна реакция с Ме (IА). (Слайды: 8, 9).
2 C6H5OH +2 Na —> 2 C6H5ONa + H2
Учитель: первым доказательством более сильных кислотных свойств фенола по сравнению со спиртами является тот факт, что в водном растворе наблюдается незначительная диссоциация фенола: C6H5OHFC6H5O – + H + . (Слайд: 10).
В отличие от спиртов фенол взаимодействует с щелочами.
C6H5OH + NaOH
C6H5ONa + H2O
Реакция обратима, т.к. фенолят натрия — это соль, образованная слабой кислотой и сильным основанием. (Слайд: 11, 12).
Вопрос: что происходит с солями в водном растворе? Какова реакция среды в растворе фенолята натрия? (Ответ: они гидролизуются; среда щелочная). (Слайд: 13).
Учитель: первым названием фенола было карболовая кислота. Однако кислота эта значительно слабее не только сильных, но даже некоторых неорганических кислот, даже угольной:
C6H5ONa + CO2 +H2O —> C6H5OH
+NaHCO3.
Отличие от спиртов: (Слайд: 14).
- Фенол не образует сложных эфиров при действии на него карбоновых кислот.
- Фенол не образует простых эфиров при действии конц. серной кислоты.
- Фенол не реагирует с галогеноводородами.
Вопрос: Чем обусловлено различие кислотных свойств спиртов и фенола?
(Ответ: различие кислотных свойств спиртов и фенола обусловлено влиянием радикала на гидроксильную группу: радикал фенил — C6H5 увеличивает подвижность атома водорода в ОН группе, а алкильные радикалы (- СН3, — C2H5) уменьшают ее, поэтому кислотные свойства у фенола выражены сильнее, чем у спиртов. (Слайд: 15).
Вопрос: как можно получить сложные и простые эфиры?
Ученики высказывают свои предположения. Затем идет объяснение.
Учитель: в отличие от спиртов, фенолы не образуют сложных эфиров при действии на них карбоновых кислот, для этого можно использовать хлорангидриды кислот. H3CC(O)Cl+HO–C6H5 —> H3C–C(O)–O–C6H5+HCl (Слайд: 16).
В качестве исходных веществ для получения простых и сложных эфиров используются также феноляты. (Слайды: 17, 18).
Затем ученики составляют уравнения возможных реакций получения эфиров. (Слайд: 19). (На усмотрение учителя данное упражнение может быть выполнено учениками в качестве домашнего задания).
4.2. Реакции электрофильного замещения.
Учитель: Почему реакции электрофильного замещения в бензольном кольце фенола протекают легче, чем у бензола, и в более мягких условиях? (Слайд: 20).
Ответ: Влияние ОН — группы на бензольное кольцо
ОН — группа — заместитель I рода.
Подает электроны на бензольное кольцо, увеличивая электронную плотность в орто и пара положениях.Атомы Н в положениях 2,4,6 — более подвижны и легко замещаются. (Слайд: 21).
Хлорирование (Слайд: 22).
Реакция с бромной водой- качественная реакция. (Слайд: 23, 24).
Аналогичные закономерности наблюдаются при нитровании фенола. Однако при действии на фенол разбавленной азотной кислотой можно получить смесь монозамещенных нитропроизводных: о-нитрофенола и п-нитрофенола. (Слайд: 25).
Ученик у доски записывает реакцию взаимодействия фенола с разбавленной HNO3. Проверка — (Слайд: 26).
При взаимодействии с концентрированной азотной кислотой образуется 2,4,6—тринитрофенол. Ученик у доски записывает реакцию взаимодействия фенола с концентрированной HNO3. Проверка — (Слайд: 27).
Электроноакцепторные свойства нитрогрупп значительно усиливают кислотность тринитрофенола. Он является примерно в миллиард раз более сильной кислотой по сравнению с фенолом, и в 100 раз сильнее фосфорной кислоты. (Слайд: 28).
Рассказ учителя. Впервые тринитрофенол получил в 1771г. английский химик П.Вульф действием азотной кислоты на природное органическое вещество индиго. Благодаря интенсивной желтой окраске вещества его стали использовать в качестве красителя для волокна и тканей. Из-за горького вкуса тринитрофенол назвали сначала пикрином (от греческого слова pykros — горький, острый), а затем — пикриновой кислотой. В 1779г. выяснилось, что это вещество способно взрываться. Но только после того, как на нескольких красильных фабриках произошли несчастные случаи в результате взрывов пикриновой кислоты, она в 1885г. была запатентована в качестве взрывчатого вещества.
4.3. Реакция поликонденсация.
Одним из важнейших свойств фенола, используемых в промышленности, является его способность вступать в реакцию с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации, в ходе которой образуется реакция поликонденсации, в ходе которой образуется высокомолекулярное соединение — фенолформальдегидная смола и выделяется низкомолекулярный продукт вода. (Слайд: 29, 30, 31, 32). Из фенолформальдегидной смолы получают пластмассы — фенопласты (бакелиты). Фенопласты — важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготавливается большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали. Сравнение с реакцией полимеризацией. Закрепление понятий “полимер”, “мономер”, “структурное звено”, “степень полимеризации”, “степень поликонденсации”.
Работа с коллекцией изделий на основе фенолформадегильной смолы.
4.5. Взаимодействие с раствором хлорида железа (III).
Качественной реакцией на фенол и его гомологи является образование окрашенных комплексов с раствором хлорида железа (III). (Слайд 33, 34).
В экстрактах многих растений, особенно обладающих дубильным и вяжущим действием, содержатся вещества, называемые “танины”. В состав их молекул входит большое число фенольных остатков. Они также дают с хлорным железом интенсивное окрашивание. Ученики проводят опыт: в пробирку наливают 2-3 мл холодной чайной заварки светло-желтого цвета и добавляют 2-3 капли раствора хлорида железа (III). Жидкость приобретает чернильный цвет. В чайных листах содержится большое количество танина, придающего напитку терпкий вяжущий привкус.
Ученик у доски записывает реакцию взаимодействия фенола с водородом. Проверка — (Слайд 35).
Объяснение: фенолы легко окисляются даже под действием кислорода воздуха. На воздухе фенол постепенно окрашивается в розовато-красный цвет. При окислении фенола сильными окислителями основным продуктом окисления является хинон. Двухатомные фенолы окисляются легче. При окислении гидрохинона также образуется хинон.
Окисление фенола и гидрохинона. (Слайд 37, 38). На усмотрение учителя данный материал может быть рассмотрен на элективных курсах при подготовке к ЕГЭ.
5. Заключительная часть.
Задания для закрепления материала и развития логического мышления. (Слайд 39-41).
6. Подведение итогов урока. Рефлексия.
Учитель предлагает ученикам определить результаты урока, сравнить их с целями.
7. (Слайд 42). Домашнее задание.
Параграф 18 по учебнику О.С.Габриелян, И.Г.Остроумов, С.Ю.Пономарев. Химия. 10 класс (М. Дрофа, 2014); стр. 193 № 1-10.
Видео:Химические свойства фенола. 10 класс.Скачать

Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Видео:Фенолы. Химические свойства. 1 часть. 10 класс.Скачать

Классификация фенолов
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Видео:36. Фенолы (часть 2)Скачать

Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
Видео:Тема №6: ФенолыСкачать

2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
Видео:Химические свойства феноловСкачать

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

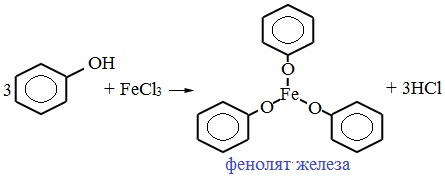
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видео:9.1. Фенол: Строение, номенклатураСкачать

5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Видео:Фенол | Органическая химия ЕГЭ, ЦТСкачать

Получение фенолов
Видео:Химия 8 класс (Урок№18 - Химические свойства оснований.)Скачать

1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
Видео:Спирты и фенолы. Тема 23. Фенолы. Химические свойства, получение и применение фенолаСкачать

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
🔥 Видео
Проклятая химическая реакция 😜 #shortsСкачать

Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

ГАЛОГЕНИРОВАНИЕ БЕНЗОЛА, ФЕНОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать
Химические свойства металлов. 9 класс.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать


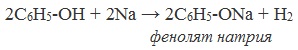
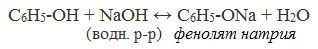
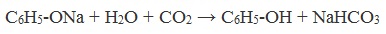

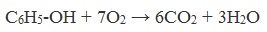

 C6H5ONa + H2O
C6H5ONa + H2O +NaHCO3.
+NaHCO3.



















