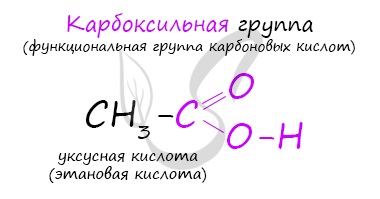
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .
- Acetyl
- Свойства бутановой кислоты — формула, получение и применение в лекарственных препаратах
- Что такое масляная кислота
- Химические свойства
- Физические свойства
- Состав масляной кислоты и структурная формула
- Зачем нужны короткоцепочечные жирные кислоты
- Поддержание кишечного гомеостаза
- Противораковое действие
- Противовоспалительные свойства
- Снижение уровня сахаров крови при диабете
- Как увечить поступление в организм масляной кислоты
- Прием биодобавок
- Препараты масляной кислоты
- 📸 Видео
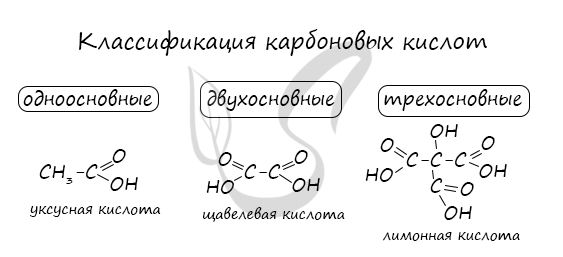
Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
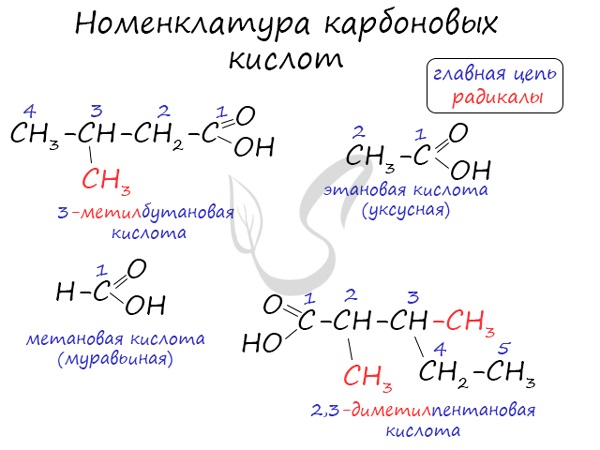
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
- Пентановая — C4H9-COOH — валериановая кислота
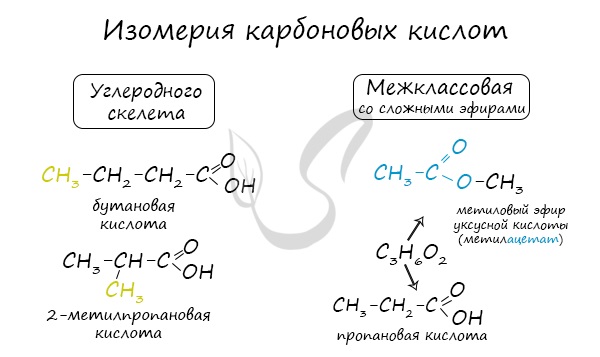
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
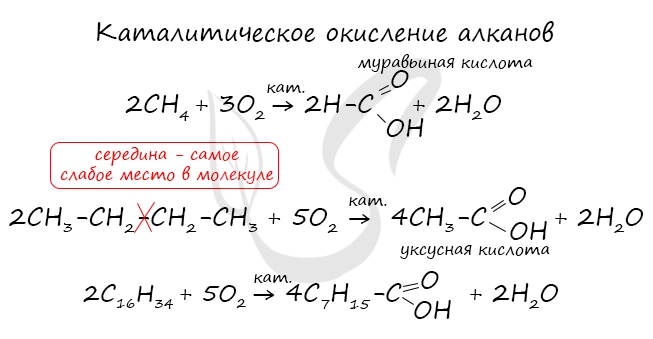
- Окисление алканов
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
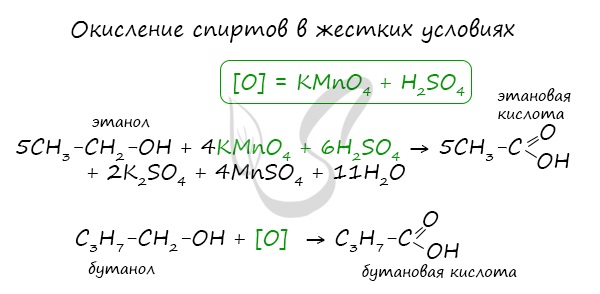
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды — реакцией серебряного зеркала.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.
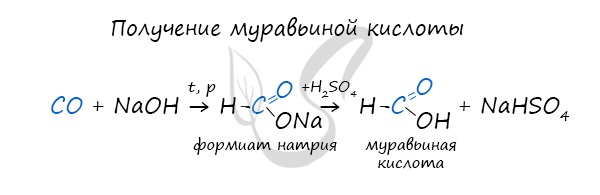
Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С — образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
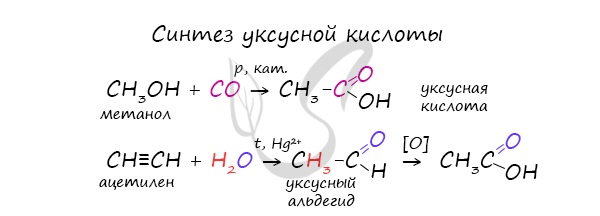
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.
Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная — трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
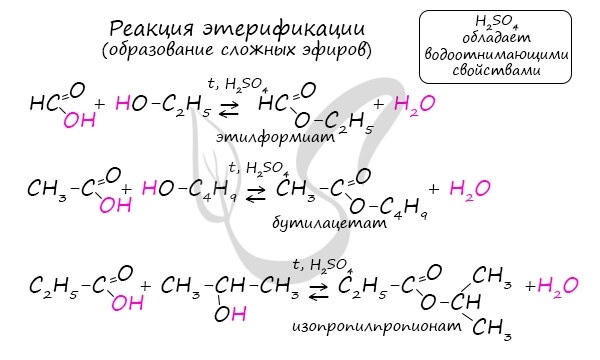
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
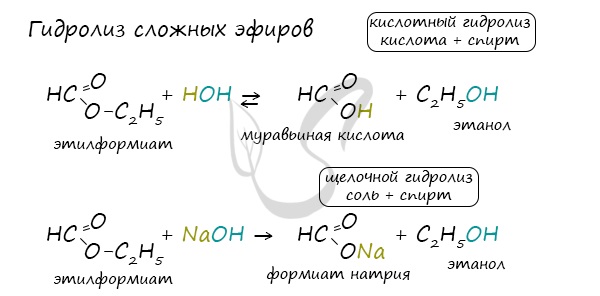
Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
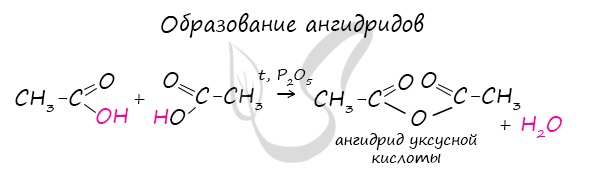
Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
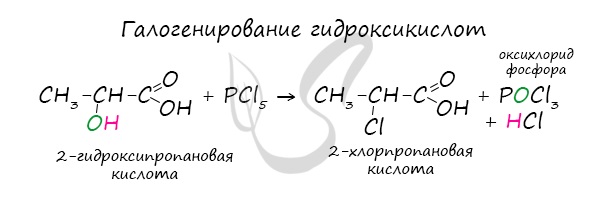
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
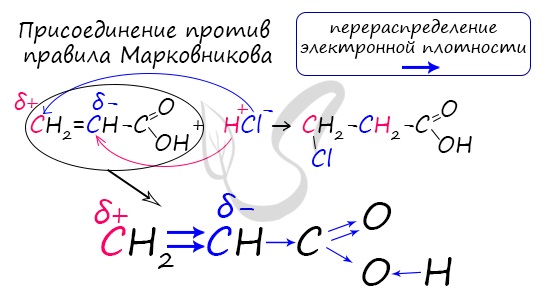
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать  Свойства бутановой кислоты — формула, получение и применение в лекарственных препаратахНаучно доказано, что масляная кислота или бутират — одна из самых полезных короткоцепочечных жирных кислот для кишечника. Она является важным субстратом для энергетического обеспечения клеток кишечника, нормализует микрофлору путем подавления развития патогенных бактерий и обладает еще рядом необходимых для здоровья свойств. Видео:Химические свойства кислот. 7 класс.Скачать  Что такое масляная кислотаРастительной клетчатке приписывают много чудодейственных свойств, начиная от того, что она способствует похудению и заканчивая очищением кишечника от шлаков. Не многие осведомлены, что клетчатка играет ключевую роль в здоровье желудочно-кишечного тракта. Так, попадая в толстый кишечник, она расщепляется кишечной микрофлорой, вследствие чего образуются короткоцепочечные жирные кислоты (КЖК). К ним относятся:
Бактериальный синтез бутирата в кишечнике происходит за счет анаэробных бактерий. В норме, для здоровья толстого кишечника окислительный процесс, образуемый микрофлорой, должен обеспечивать 5 г низкомолекулярной кислоты для поддержания гомеостаза толстого кишечника и снабжения клеток его слизистой – колоноцитов энергией. Производятся КЖК бактериями, постоянно обитающими в кишечнике:
Химические свойстваАнаэробные бактерии обеспечивают производство бутирата в условиях без доступа кислорода. Одноосновная бутановая кислота имеет изомеры, тоже производимые кишечными полезными бактериями. К ним относятся:
По сути, полученные вследствие ферментативной переработки растительного материала короткоцепочечные кислоты, в том числе и масляная, являются побочным продуктом анаэробного процесса расщепления. Химические свойства данного вещества характерны для короткоцепочечных карбоновых кислот. Например, взаимодействие со спиртами дает реакцию этерификации (получение с помощью спирта эфира). Физические свойстваБутират представляет собой жидкость, которая не имеет цвета, с ярко выраженным запахом прогорклого масла. Имеет молярную массу 81 г/моль, температуру плавления – -5 °С, кипения – 173 °С. При комнатной температуре бутират хорошо растворяется в воде и смешивается с органическими окислителями. Небольшие количества бутановой кислоты находятся в нефти, коровьем сливочном масле. Видео:Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать  Состав масляной кислоты и структурная формулаБутановая (масляная) кислота имеет очень простую структуру: одну двойную с кислородом и одну карбоксильную группу, 2 молекулы кислорода и одну двойную связь. Цепочка, которая образуется структурными связями, создается короткая и простая, отсюда и название группы жирных кислот – короткоцепочечные. Соли, образуемые с натрием и кальцием, эфиры данной кислоты называются бутиратами, они широко используются в животноводстве. Видео:Свойства кислот с точки зрения теории электролитической диссоциации. 9 класс.Скачать  Зачем нужны короткоцепочечные жирные кислотыСуществуют научные доказательства связи между дефицитом КЖК и заболеваниями кишечника. Из всех КЖК масляная кислота обладает самыми полезными свойствами для здоровья кишечника, которые обусловлены ее химическими свойствами. Физиологический эффект, оказываемый низкомолекулярными кислотами на слизистую кишечника, выражается в следующем:
При нарушении микрофлоры возникает дефицит КЖК, что может привести к диарейному синдрому, вздутию. Стабильное нарушение выработки полезных кислот может спровоцировать:
Поддержание кишечного гомеостазаСовокупность свойств бутирата обеспечивает гомеостаз кишечника за счет поддержания нормального уровня рН и снабжения кровью слизистой. Гомеостаз поддерживается к тому же за счет регуляции выработки кишечником ряда рецепторов – компонентов врожденного иммунитета, которые препятствуют возникновению воспалительных процессов слизистой оболочки толстого кишечника. Противораковое действиеПрисутствие в кишечнике бутирата в физиологически необходимом количестве обеспечивает противораковую защиту слизистой. По данным исследований, данная КЖК способна подавлять активность клеток, вызывающих онкологию. Практические выводы на этот счет были сделаны по результатам содержания бутирата в слизистой здоровых людей и у пациентов с новообразованиями данного органа. Противовоспалительные свойстваБолезни кишечника, которые сопровождаются воспалением, могут быть спровоцированы дефицитом короткоцепочечной жирной кислоты. При недостаточной ее выработке микрофлорой повышается активность патогенных микроорганизмов, нарушается слизистая оболочка и легко подвергается пагубному воздействию. Если же количество бутирата находится в норме, снижается секреция провоспалительных медиаторов, а повышается высвобождение противовоспалительного цитокина. Снижение уровня сахаров крови при диабетеТочный механизм влияния короткоцепочечных жирных кислот на механизм выработки глюкозы. Однако опытным путем доказано, что употребление клетчатки в достаточном количестве, которое способствует выработку КЖК, помогает избежать возникновения ожирения и сахарного диабета. Клетки кишечника способны продуцировать глюкозу и этот процесс контролируют полезные кислоты, препятствуя возникновению цепочной реакции, которая провоцирует появление чувства голода и избыточное употребление углеводов, сахаров. Видео:11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать  Как увечить поступление в организм масляной кислотыОдним из самых действенных способов наладить работу кишечника – обеспечить пищу для полезной микрофлоры. Сегодня существует три основных способа увеличить выработку короткоцепочечных ЖК в толстом кишечнике:
Пищей для бактерий являются пищевые волокна, которые не перевариваются тонким кишечником, а расщепляются на КЖК и углеводы в толстой кишке. Полезно употреблять в пищу ферментированные продукты, которые подвергались процессу брожения и резистентные крахмалы. Увеличение количества ферментированных и богатых натуральной клетчаткой, устойчивым крахмалом продуктов в рационе – самый действенный способ увеличить выработку КЖК. К продуктам, содержащим резистентный крахмал, относят:
Важность употребления устойчивого (резистентного) крахмала доказана научно: по данным перекрестных исследований употребление продуктов с таким видом крахмала предотвращает пагубное влияние красного мяса на здоровье слизистой. Красное мясо, перевариваемое без присутствия устойчивого крахмала, провоцирует увеличение количества онкогенных молекул. Результаты данного исследования лишний раз доказывают важность рационального и разнообразного питания для здоровья. Прием биодобавокДля нормальной работы желудочно-кишечного тракта в разных отделах кишечника должны присутствовать бактерии, которые помогают пищеварению на разных этапах. Корректировать их количество возможно путем употребления специальных биодобавок, которые могут иметь в своем составе как сами бактерии, так и пробиотики – пищу для полезной микрофлоры. Пробиотические препараты имеют в своем составе клетчатку, инулин, часто – лактитол и другие непереваримые дисахариды, которые являются пищей для микрофлоры. Препараты масляной кислотыПри лечении таких заболеваний, как дистальный язвенный колит, полипоз толстого кишечника, функциональных нарушений и воспалительных процессов в кишечнике назначают препараты с бутиратом. Концентрация активного вещества в капсулах соответствует суточной норме выработки бутирата микрофлорой у здорового человека. В капсулы с полезной кислотой часто добавляют инулин или другие углеводы для того, чтобы не только обеспечить лечебное воздействие, но и наладить природную выработку бутирата. Применение таких лекарств должно осуществляться после консультации врача. 📸 ВидеоОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать  11.1. Карбоновые кислоты: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать  Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать  Тесты по химии. Хим свойства масляной кислоты. А39 ЦТ 2004 по химииСкачать  Химия. 9 класс. Химические свойства кислот с точки зрения теории электролитической диссоциацииСкачать  ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать  8 класс химические свойства оксидов, оснований, кислот, солей и ионные уравненияСкачать  Хлороводородная кислота. 9 класс.Скачать  Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать  ЛЕКЦИЯ 2. КИСЛОТЫСкачать  СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать  47. Химические свойства кислотСкачать  Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать  Свойства кислот и их применение. 8 класс.Скачать  |