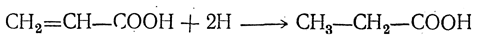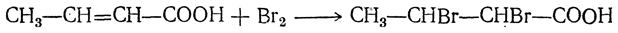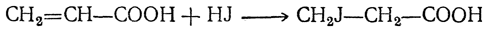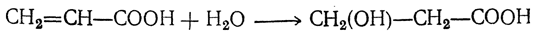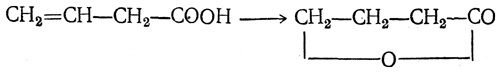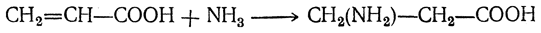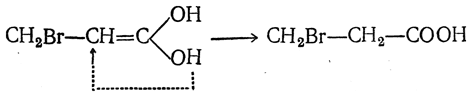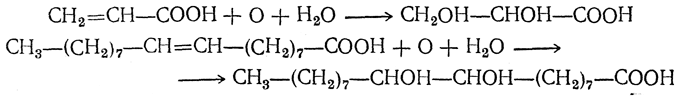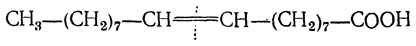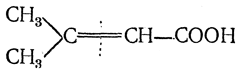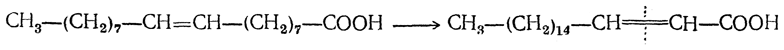Акриловая кислота – это один из простейших представителей карбоновых непредельных одноосновных кислот. Ее формула следующая: СН2=СН-СООН. Это бесцветная жидкость, имеющая резкий и неприятный запах. Растворима в воде, хлороформе, диэтиловом спирте и этаноле, с легкостью полимеризуется с дальнейшим образованием полиакриловой кислоты. У акриловой кислоты есть и другие названия: этенкарбоновая кислота и пропеновая кислота.
Как получают (или синтезируют) акриловую кислоту?
1. В настоящее время акриловую кислоту получают посредством парофазного окисления пропилена кислородом (О2) на молибденовых, кобальтовых или висмутовых катализаторах. Примером может служить следующая реакция:
СН2=СН–СН3 (пропилен) + O2 (кислород) = СН2=СН–СООН (кислота акриловая)
2. В прошлом использовалась реакция, при которой взаимодействовали оксид углерода II (СО), ацетилен (СН≡СН) и вода (H2O). Химическая реакция будет при этом такая:
СН≡СН (ацетилен) + СО (оксид углерода II) + Н2О (вода) → СН2=СН–СООН (акриловая кислота).
Еще использовали реакцию формальдегида с кетеном:
СН2=С=О (кетен) + H2C=O (формальдегид) → СН2=СН–СООН (пропеновая кислота).
3. Сейчас фирмой Rohm and Haas создается особая технология синтеза кислоты этенкарбоновой из пропана.
Химические свойства акриловой кислоты
Рассматриваемая нами кислота может образовывать соли, сложные эфиры, ангидриды, амиды, хлорангидриды и другие соединения. Также она может вступать в реакции присоединения, которые характерны для этиленовых углеродов. Присоединение воды, протонных кислот и NH3 происходит не по правилу Марковникова. При этом образуются замещенные производные. Акриловая кислота участвует в синтезе диенов. Также конденсируется с различными солями арилдиазония. При ультрафиолетовом облучении она образует полиакриловую кислоту.
Применение акриловой килоты
– используется в качестве сырья в производстве широкого ассортимента полимерных продуктов с различными химическими и физическими свойствами (например, пластика и покрытий);
– применяется в производстве дисперсий для акриловых водных лакокрасочных материалов; при этом область применения таких красок будет зависеть от химических свойств сополимера – от окончательной окраски транспортных средств и до покраски потолков;
– акриловая кислота и ее производные используются для создания пропитки для кожи и тканей, эмульсий к лакокрасочным материалам, в качестве сырья для акрилатных каучуков и волокон полиакрилонитрильных, строительных клеев и смесей; сложные эфиры метаакриловой и акриловой кислот (в большинстве случаев используются эфиры метиловые метилметакрилат и метилакрилат) применяются в производстве полимеров;
— часто акриловая кислота используется в создании суперабсорбентов.
Правильное хранение акриловой кислоты
При хранении данного вещества в целях избегания полимеризации добавляют ингибитор – гидрохинон. Перед использованием кислоту необходимо перегонять с осторожностью, так как возможно развитие взрывоподобной полимеризации.
Безопасность при использовании
При работе с акриловой кислотой следует учесть, что данное вещество оказывает раздражающее действие на кожные покровы и слизистые оболочки. Порог раздражающего действия кислоты составляет 0,04 мг/литр. При попадании на слизистую оболочку глазных яблок, как правило, вызывает сильнейшие ожоги роговицы, может привести к необратимым изменениям (повреждениям, не поддающимся лечению). Вдыхание паров акриловой кислоты может вызвать головную боль, раздражение дыхательных путей, а в чрезмерных дозах – развитие отека легких. В помещениях, где проводится работа с акриловой кислотой, необходим постоянный контроль воздуха. ПДК данной кислоты составляет 5 мг/метр³. Меры безопасности надо соблюдать и при работе с другими производными. Как пример можно привести нитрил акриловой кислоты.
Видео:Химические свойства кислот. 7 класс.Скачать

Свойства
Кислоты с удаленными от карбоксильной группы этиленовыми связями, начиная с винилуксусной СН2=СН—СН2—СООН, обладают такой же способностью к реакциям присоединения, как и сами этиленовые углеводороды. Еще легче идут реакции присоединения, если этиленовая связь находится рядом с карбоксильной группой (α,β-ненасыщенные кислоты), как в акриловой кислоте СН2=СН—СООН и ее гомологах.
Из реакций, в которых участвует двойная связь (в первую очередь, реакций присоединения), можно отметить следующие:
1. Присоединение водорода. Кислоты типа акриловой кислоты особенно легко присоединяют водород при действии амальгамы натрия в водном растворе, превращаясь в предельные кислоты:
Гладко идет присоединение водорода при гидрировании в жидкой фазе в присутствии катализаторов (Ni, Pt, Pd). 2. Присоединение галоида, например:
3. Присоединение галоидоводородов. Эта реакция особенно легко идет для α,β-ненасыщенных кислот, причем атом галоида всегда присоединяется к более удаленному от карбоксильной группы атому углерода, например:
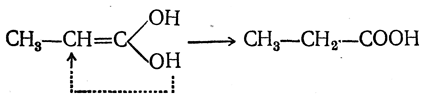
4. Присоединение воды. Акриловая кислота и ее гомологи (α,β-ненасыщенные кислоты) под действием, например, серной кислоты легко присоединяют воду с образованием β-оксикислот:
β,γ-Ненасыщенные кислоты под влиянием серной кислоты дают соединения, называемые лактонами;
5. Присоединение аммиака. Присоединяя молекулу аммиака, α,β-ненасыщенные кислоты дают β-аминокислоты:
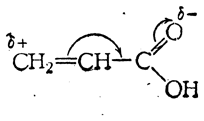
Особенности реакций присоединения в случае α,β-ненасыщенных кислот объясняются наличием в них сопряженных двойных связей, а именно углерод-углеродной и углерод-кислородной:
Благодаря этому присоединение идет прежде всего в положении 1,4, т. е. к крайнему атому углерода этиленовой связи и к атому кислорода карбонильной группы.
Присоединение водорода дает сначала двухатомный спирт, немедленно изомеризующийся (как показано стрелкой) в пропионовую кислоту
Присоединение бромистого водорода сначала дает бромзамещенный двухатомный спирт, а затем β-бромпропионовую кислоту:
Таким образом объясняется особая легкость восстановления кислот этого типа, а также протекание реакции не в согласии с правилом Марковникова, т. е. то, что галоид галоидоводорода (или гидроксил в случае гидратации) присоединяется к более гидрогенизированному атому углерода, всегда образуя β-замещенные производные кислот.
Присоединение же галоидов в положение 1,2 объясняется тем, что кислород не обладает склонностью соединяться с галоидами.
6. Окисление. При окислении перманганатом в щелочной среде образуются диоксикислоты:
Более энергичное окисление приводит к расщеплению молекулы кислоты по месту двойной связи. Благодаря этому по числу атомов углерода в продуктах расщепления можно установить положение двойной связи в исходной молекуле.
В зависимости от строения исходной ненасыщенной кислоты продуктами окисления могут быть одноосновные и двухосновные кислоты, а также кетоны, кетонокислоты и продукты дальнейшего окисления первичных продуктов реакции. Так, олеиновая кислота
При некоторых реакциях окисления может происходить изомеризация, состоящая в перемещении двойной связи, вследствие чего получаются продукты окисления, не отвечающие структуре исходного соединения; это затрудняет суждение о строении ненасыщенной кислоты. Такие ненормальные продукты окисления иногда получаются при окислении в присутствии сильных минеральных кислот, а также при сплавлении ненасыщенных кислот с едкими щелочами. Так, например, при сплавлении олеиновой кислоты с едкими щелочами молекула ее расщепляется, но продуктами окисления являются кислоты пальмитиновая С15Н31СООН и щавелевая НООС—СООН, что объясняется, вероятно, превращением олеиновой кислоты в изомерную ей α,β-ненасыщенную кислоту:
7. Превращение стереоизомерных кислот друг в друга. У стереоизомерных ненасыщенных кислот, изомерия которых определяется наличием двойной связи (цис-транс-изо мерия, стр. 89), наблюдаются чрезвычайно характерные взаимные отношения. Они заключаются в том, что из двух стереоизомерных кислот одна является более устойчивой, чем другая, причем неустойчивый изомер («лабильная» форма) может в определенных условиях превращаться в устойчивый («стабильная» форма):
Превращение иногда происходит при простом нагревании, в других же случаях — при действии химических агентов (концентрированная серная кислота, едкая щелочь при кипячении, следы азотистой кислоты). Быстро и количественно такое превращение идет в присутствии следов иода или брома под действием прямого солнечного света.
Обратное превращение происходит при действии ультрафиолетовых лучей и может быть, кроме того, осуществлено химическим путем.
Видео:8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎬 ВидеоКИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать  47. Химические свойства кислотСкачать  Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать  Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать  ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать  11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать  Азотная кислота. Химические свойства. Взаимодействие с металлами.Скачать  Свойства кислот с точки зрения теории электролитической диссоциации. 9 класс.Скачать  ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать  Химия 8 класс (Урок№20 - Получение и химические свойства кислот.)Скачать  ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать  Кислоты: способы получения и химические свойства | ЕГЭ по химии 2024Скачать  Карбоновые кислоты. Химические свойства. Все 25 реакций ЕГЭ.Скачать  Химия. 9 класс. Химические свойства кислот с точки зрения теории электролитической диссоциацииСкачать  Серная кислота. Химические свойства. Реакции с металлами.Скачать  Оксиды. Химические свойства. 8 класс.Скачать  СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать  Химические свойства соляной кислотыСкачать  |