Ради этого стоит учить химию!
Вокруг нас постоянно протекают различные химические реакции. Химия присутствует каждый раз, когда мы готовим, дышим или жуем. На сковородах и в кастрюлях происходят сложнейшие химические и биохимические процессы. В этой статье вы узнаете, как их использовать в повседневной жизни.
- 1. Анализ веществ с помощью жидкости-индикатора
- 2. Как удалить накипь в чайнике?
- 3. Свежая ли рыба?
- 4. Есть ли в молоке крахмал?
- 5. Свежее ли молоко?
- 6. Готовим лимонад
- 7. Как сварить треснутое яйцо?
- Десятки экспериментов у вас дома
- 30 химических реакций повседневной жизни
- 30 химических реакций, которые вы видите каждый день в своей жизни
- Химия на кухне
- Химия в доме
- Химия в саду
- Химия на улице
- Химия в вашем теле
- 11 лучших примеров химических изменений в повседневной жизни
- 11. Выпечка торта
- 10. Сжигание природного газа
- 9. Взрыв фейерверка
- 8. Созревание плодов
- 7. Переваривание пищи
- 6. Гальваническое покрытие металла
- 5. Прокисание молока
- 4. Смешивание кислоты с основанием
- 3. Ржавое железо
- 2. Варка яйца
- 1. Фотосинтез
- Часто задаваемые вопросы
- В чем разница между химическим изменением и физическим изменением?
- Как определить химическое изменение?
- Какое вещество не может быть изменено обычными химическими реакциями?
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

1. Анализ веществ с помощью жидкости-индикатора
Материалы и инструменты:
- Нарежьте капусту тонкими ломтиками и залейте кипятком.
- Когда вода окрасится в фиолетовый цвет, слейте ее через ситечко в банку. Получилась жидкость-индикатор.
- В один стакан налейте воды и выжмите сок лимона, в другой — воды с пищевой содой, в третий — только воды.
- В каждый стакан добавьте ложку жидкости-индикатора.
Вода с лимоном окрашивается в розовый цвет, вода с содой — в сине-зеленый, чистая вода приобретает цвет жидкости-индикатора.
Отвар красной капусты является индикатором — веществом, способным менять цвет в зависимости от того, взаимодействует ли оно с кислотой (в нашем случае становится розовым) или с основанием (становится синим или зеленым, как во втором стакане). В ходе опыта жидкость-индикатор дала понять, что в первом стакане находится кислое вещество, во втором — основание, а вода в третьем стакане является нейтральным веществом.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

2. Как удалить накипь в чайнике?
Материалы и инструменты:
- Нужно развести в 1 литре воды 1—2 чайные ложки кислоты.
- Залить раствор в чайник и прокипятить.
- Ополоснуть чайник и прокипятить воду «вхолостую».
Накипь исчезнет без следа, легко отслоившись под действием кислоты.
Накипь состоит в основном из карбоната кальция, который образуется при разложении гидрокарбоната кальция, содержащегося в природных водах. В результате реакции под действием лимонной кислоты образуются растворимый в воде цитрат кальция, углекислый газ и вода.
2C₆H₈O₇ + 3CaCO₃ = Ca₃(C₆H₅O₇)₂ + 3CO₂ + 3H₂O
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

3. Свежая ли рыба?
Материалы и инструменты:
жидкость-индикатор (см. п. 1);
- На туловище рыбы делаем глубокий надрез.
- Залейте в надрез ложку жидкости-индикатора.
Если надрез приобрел розовый или сиреневый оттенок, рыба свежая. Синий или зеленый цвет свидетельствует об обратном.
Будучи хорошим индикатором, отвар красной капусты позволил нам определить кислотность среды. Слабо-сиреневая или розовая окраска указывает на нейтральную или слабокислую реакцию — значит, рыба хорошего качества.
Синий или зеленый цвет свидетельствует о щелочной среде, то есть рыба испортилась. Нажмите здесь, чтобы узнать из чего еще можно приготовить природный рН-индикатор в домашних условиях.
Видео:8 класс. Составление уравнений химических реакций.Скачать

4. Есть ли в молоке крахмал?
Самый верный способ определить, есть ли в молоке крахмал, — капнуть туда немного йода. В обезжиренное молоко нередко добавляют крахмал, чтобы придать ему густоты.
Материалы и инструменты:
- Наливаем в стакан немного молока.
- Капаем йод.
- Наблюдаем за реакцией.
Если жидкость приобрела синеватый оттенок, значит, в молоке есть крахмал. Если по ней пошли желтоватые круги, то вам повезло: добавок в таком молоке нет.
Раствор йода сработал как индикатор: при контакте с крахмалом он изменил цвет.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

5. Свежее ли молоко?
Материалы и инструменты:
- Наливаем полстакана молока.
- Всыпаем ½ ч. л. соды.
- Наблюдаем за реакцией.
Если появилась пена, молоко прокисло.
При добавлении бикарбоната натрия (соды) в кислую среду происходит реакция нейтрализации. Кислота и щелочь (сода) нейтрализуют друг друга, выделяя углекислый газ, который вспенивает смесь.
Видео:Химические реакции в природе и жизнедеятельности живых организмов. 8 класс.Скачать

6. Готовим лимонад
Материалы и инструменты:
- Насыпаем в пробирку по одной чайной ложке лимонной кислоты и соды, затем добавляем две чайные ложки сахарного песка.
- Пересыпаем всю смесь в сухую чистую чашку, основательно перемешиваем.
- Разделяем смесь на несколько равных частей. Каждую часть можно упаковать в пакетик.
- Одну такую часть высыпать в стакан и залить водой.
Получится шипучий и газированный напиток, освежающий, как лимонад.
При взаимодействии лимонной кислоты и гидрокарбоната натрия происходит реакция нейтрализации. Получаем натриевую соль лимонной кислоты, углекислый газ и воду.
Н₃С₆Н₅О₇ + 3NaHCO₃ –> Na₃C₆H₅O₇ + 3CO₂ + 3H₂O
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

7. Как сварить треснутое яйцо?
Материалы и инструменты:
В кипящую подсоленную воду кладем яйцо и варим 5 минут.
Яйцо сварится и не вытечет из скорлупы.
Соль действует на белок, как коагулянт на коллоидный раствор. В результате белок свертывается в щели скорлупы.
Больше статей о химии:
- Как вырастить кристаллы соли Получение красивых кристаллов дома
- Эксперимент «Дым без огня» Как сделать, чтобы две жидкости задымились в другой колбе?
Делайте эксперименты дома!
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Десятки экспериментов у вас дома
Один из самых интересных и амбициозных образовательных химических проектов
The Royal Society of Chemistry
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

30 химических реакций повседневной жизни
химические реакции Мы можем найти их в повседневной жизни в целом. Это ответ, который химик мог бы дать вам без ошибок, чтобы преувеличивать.
И это то, что кто-то стремится в этом вопросе будет пытаться увидеть вещи с молекулярной или атомной точки зрения, будет пытаться увидеть реакции повсюду, и молекулы постоянно превращаются.
Люди, разбирающиеся в химии, не могут не видеть вещи с этой точки зрения, точно так же, как физик мог видеть вещи с ядерной точки зрения или биолог с клеточной точки зрения..
Для обоснования комментария ниже я привожу 30 примеров химии, присутствующей в повседневной жизни..
Химические реакции, которые остаются незамеченными дома, на кухне, в саду, на улице или даже внутри нашего тела. Я надеюсь, что это поможет осветить обычную и рутинную химию в повседневной жизни..
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

30 химических реакций, которые вы видите каждый день в своей жизни
Химия на кухне
1- сольватационные реакции: когда соль растворяется в воде, ионные связи разрушаются, что приводит к сольватации катионов и анионов.
Технически готовят раствор хлорида натрия в воде..
2- Фазовые изменения: При кипячении воды во время приготовления или приготовления кофе или чая происходит фазовое изменение между жидкой водой и газированной водой.
3- реакции горения: Газовые плиты используют пропан для производства пламени.
4- ХлорХлор, используемый в качестве моющего средства, на самом деле представляет собой хлорит натрия, который является восстановителем. Пятна от одежды называются хромофорами и имеют ненасыщенность. Хлор атакует эту ненасыщенность, удаляя цвет пятен. Технически это не удаляет пятно, но делает его невидимым.
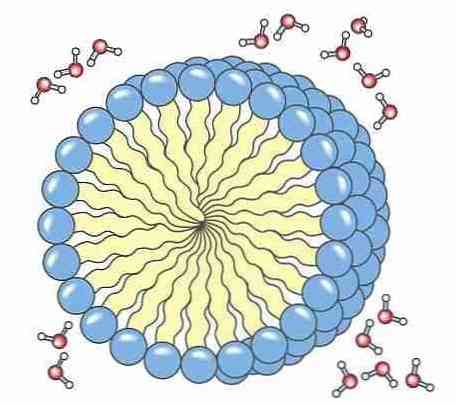
5- мылоМыла и моющие средства имеют полярную часть, обычно карбоновую кислоту, присоединенную к неполярной алифатической цепи, которая дает ей способность образовывать мицеллы. Эти мицеллы обладают способностью окружать грязь, поэтому ее можно удалить с одежды, посуды и нашего тела..
6- Пищевая сода: это слабое основание, которое при взаимодействии с кислотой, такой как уксус или вода (которая является слегка кислой), выделяет углекислый газ.
Это соединение является активным ингредиентом многих антацидов (C., 2015).
7- Среднесрочный: кухня — это химическое изменение, которое меняет пищу, делая ее вкуснее, убивает опасные микроорганизмы и делает их более усвояемыми.
Жар кулинарии может денатурировать белки, стимулировать химические реакции между ингредиентами, карамелизовать сахар и т. Д. (Helmenstine A.M., 10 примеров химических реакций в повседневной жизни, 2017).
8- Искусственный вкус и цвет: многие обработанные пищевые продукты содержат химические вещества, которые придают особый вкус или цвет и способствуют их сохранению.
9- Плачь о луке: лук содержит аминокислотные молекулы сульфоксидов. При разрезании луковых клеточных стенок происходит разрушение, выделяя эти сульфоксиды вместе с ферментами, которые разлагают его до сульфеновых кислот, сероорганического соединения формулы R-SOH, которое раздражает глаза (Reactions, 2016).
Химия в доме
10- АккумуляторыОни используют электродохимические или окислительно-восстановительные реакции для преобразования химической энергии в электрическую. Спонтанные окислительно-восстановительные реакции происходят в гальванических элементах, тогда как не спонтанные химические реакции происходят в электролитических ячейках (Helmenstine, 2017).
11- ЖК-экраны: ЖК-телевизоры содержат спиральные кристаллические молекулы, которые имеют свойство ориентироваться в соответствии с электрическим сигналом и путем изменения тона или цвета, обеспечиваемого светодиодной лампой. Каждая кристаллическая молекула представляет собой пиксель на телевизоре, и чем больше молекул, тем выше разрешение.
12- Старые книги, которые хорошо пахнут: разложение целлюлозы из бумаги книг, придает листьям желтоватый цвет и запах ванили. Если у вас есть старые книги, которые хорошо пахнут в вашей библиотеке, это происходит из-за молекул лигнина или ванилина в нем.
13- Наркотики и наркотикиНекоторые лекарственные средства представляют собой молекулы, которые частично блокируют гормональную активность, вызываемую определенным раздражителем (например, лекарственные средства для снятия напряжения или противоэпилектические средства), в то время как другие являются ферментативными ингибиторами, такими как, например, анальгетики..
14- ШампуньКак шампуни и мыло, шампуни удаляют жир с кожи головы, образуя мицеллы. Ингредиентом, который заботится об этом, обычно являются сульфаты, такие как додецилсульфат или лауриловый эфир сульфата натрия или аммония.
15- Дезодоранты и антиперспиранты: плохой запах подмышек, ног и дыхания вырабатывается бактериями, которые питаются белками и жирами в поте, который выделяет апокринные железы.
У дезодорантов есть химическое соединение, названное триклозаном, который является сильным антибактериальным и фунгицидным средством. С другой стороны, антиперспиранты содержат соли алюминия, которые проникают в поры и предотвращают потоотделение..
16- Косметика и макияжЭто химические вещества и пигменты, которые прилипают к коже. Обычно это неполярные соединения, такие как воски и масла..
Химия в саду
17- Фотосинтез: это процесс, при котором зеленые растения производят свою еду. Это происходит в присутствии солнечного света и другого сырья, а именно углекислого газа и воды. Пигмент хлорофилла собирает световую энергию солнечного света, которая превращается в глюкозу (Crystal, 2017).
18- реакции окисления: на неокрашенных железных поверхностях часто наблюдается оксидное покрытие, которое постепенно приводит к разрушению железа. Это химическое явление, называемое окислением.
В этом случае железо соединяется с кислородом в присутствии воды, что приводит к образованию оксидов железа (химические реакции в повседневной жизни, 2016 г.).
19- Органическое разложениеРазложение органических продуктов питания или даже живых существ — это реакции окисления, вызываемые бактериями, которые разлагают биохимические макромолекулы в простых молекулах, таких как нитриты, нитраты, СО2 и вода (Helmenstine, Примеры химических изменений, 2017).
20- Удобрения: калий, нитраты, фосфаты и сульфаты используются в почвах для обеспечения растений питательными веществами и могут расти.
21- ПестицидыЭто химические вещества, используемые для окуривания сельскохозяйственных культур или садов. Обычно это нейротоксины, которые поражают бактерии или насекомых, которые потребляют зерновые культуры..
Химия на улице
22- Сжигание бензина: автомобили используют бензин в качестве топлива за счет контролируемых взрывов, которые приводят в движение поршни двигателей.
23- Дым машин: вырабатывает свободные радикалы, которые являются очень реактивными соединениями и атакуют кожу или волосы, делая их сухими и ломкими, не говоря уже о том, что они канцерогенные.
24- кислотный дождь: избыток серы и оксидов азота в атмосфере, производимых заводами и автомобилями, растворяется в воде облаков с образованием серной, серной и азотной кислоты, которая выпадает в осадок в виде кислотных дождей.
25- Конструкции: цемент и другие материалы, используемые при строительстве домов, такие как картины, штукатурка и многие другие, являются продуктами химии. В частности, цемент сделан из молекул гидроксида кальция, также называемых негашеной известью.
Химия в вашем теле
26- Пищеварение: пищеварение основано на химических реакциях между пищевыми продуктами и кислотами и ферментами, которые расщепляют молекулы на питательные вещества, которые организм может усваивать и использовать.
27- Аэробное дыхание: основным процессом, который производит энергию в организме, является аэробный гликолиз. Здесь дыхание помогает расщеплять глюкозу (источник энергии) в воде, углекислый газ и энергию в форме АТФ. С6H12О6 + 6O2 → 6CO2 + 6H2O + Энергия (36 АТП)
28- Анаэробное дыхание: из-за перенапряжения, иногда клетки нашего организма истощаются и дышат анаэробно. Это вызывает синтез молочной кислоты. Анаэробное дыхание наблюдается у некоторых бактерий, дрожжей и других организмов. Уравнение анаэробного дыхания:
29- Мускульное движение: напряжение или расслабление мышц происходит из-за конформационных изменений белков скелетных мышц. Эти изменения происходят благодаря фосфокреатину, который при потере фосфата высвобождает энергию для процесса.
30- Мысль: это сложный биохимический процесс, в котором разность ионного потенциала создает электрические импульсы нейронов (Али, 2013).
Видео:Самые удивительные химические реакцииСкачать

11 лучших примеров химических изменений в повседневной жизни
Химическое изменение — это процесс, в котором одно или несколько веществ превращаются в одно или несколько новых и разных веществ. Эти вещества могут быть как химическими элементами, так и соединениями.
Химические изменения происходят в результате химических реакций. В ходе химической реакции происходит перегруппировка атомов, и реакция сопровождается изменением энергии, поскольку образуются новые вещества.
Другими словами, химические изменения — это фундаментальные изменения, которые порождают новые комбинации материи. Эти изменения обычно необратимы или обратимы только при дополнительном химическом изменении.
Хотя существуют сотни тысяч различных химических реакций, большинство из них имеют схожие свойства. Эти сходства позволяют нам разделить химические изменения на три широкие категории.
- Органические изменения включают химические реакции сложных углеродных соединений, в которых один или несколько атомов углерода ковалентно связаны с атомами других элементов, чаще всего водорода, азота или кислорода.
- Неорганические изменения — это химические реакции веществ, в которых, как правило, не участвуют атомы углерода. Эти изменения обычно происходят в лабораториях и тяжелой промышленности.
- Биохимические изменения происходят в живых организмах. Они контролируются или регулируются гормонами и ферментами.
Чтобы объяснить этот процесс более подробно, мы перечислили несколько наиболее распространенных примеров химических изменений, которые вы видите в повседневной жизни.
Видео:Типы химических реакций. 1 часть. 8 класс.Скачать

11. Выпечка торта
Тип: неорганическое изменение
Когда вы печете пирог, его ингредиенты (мука, яйцо, сахар, пекарский порошок и т.д.) претерпевают химические изменения. Это происходит в процессе выпечки:
- Тепло позволяет пекарскому порошку образовывать крошечные пузырьки газа, что делает пирог пушистым.
- Под воздействием тепла яичный белок изменяется и делает пирог твердым.
- Масло не дает теплу высушить пирог.
Поскольку этот процесс выпечки требует тепла, это эндотермическая реакция. Она не может быть обращена вспять, поскольку сахар и дрожжи создали новые вещества. Это означает, что после выпечки пирога вы не сможете разделить его на исходные компоненты (муку, яйца, сахар).
Видео:Химические уравнения. Урок 15. Химия 7 классСкачать

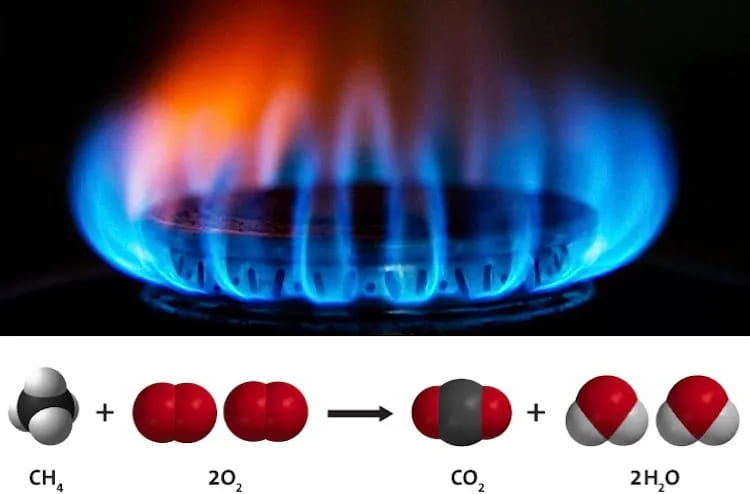
10. Сжигание природного газа
Тип: Органическое изменение
Природный газ — это углеводородная смесь, состоящая из множества различных соединений. Его основной компонент — метан (CH4), соединение с одним атомом углерода и четырьмя атомами водорода. При сгорании метана в присутствии воздуха (кислорода) образуется вода, углекислый газ и тепло (в виде голубого пламени).
Видео:7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ!Скачать

9. Взрыв фейерверка
Тип: Неорганические изменения
Фейерверки — это великолепное сочетание науки и инноваций. Они состоят из высокоэнергетических соединений, которые создают взрывы. При выделении достаточного количества тепла (энергии активации) в них происходит несколько химических реакций в быстрой последовательности.
Точнее, высокоэнергетические соединения, плотно упакованные внутри фейерверка, сгорают с кислородом воздуха и превращаются в другие соединения, выделяя при этом звук, тепло и газы (такие, как угарный газ, углекислый газ и азот).
Различные соединения дают разные цвета и оттенки, которые мы видим в темном ночном небе. Например, барий дает зеленый цвет, медь — синий, натрий — желтовато-оранжевый, а стронций — красный.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

8. Созревание плодов
Тип: Органическое изменение
Созревание связано с изменениями в составе (например, превращение крахмала в сахар). Это процесс, в результате которого плоды приобретают желаемый вкус, цвет, качество и другие характеристики. По характеру созревания фрукты можно разделить на две группы:
- Климактерические плоды могут созревать после снятия с растения. Например, бананы, манго и яблоки продолжают созревать и не выдерживают жестких условий транспортировки и многократного перемещения.
- Неклимактеричные плоды не могут созревать после сбора урожая. Они производят небольшое количество этилена (гораздо меньше, чем климактерические плоды) и не реагируют на обработку этиленом. В качестве примера можно привести апельсин, виноград, ежевику, гранат и арбуз.
Поскольку созревание включает образование новых углеродсодержащих химикатов, которые приводят к изменению цвета и вкуса, можно смело назвать процесс созревания органическим химическим изменением.
Видео:7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ ДЛЯ ДОМА!Скачать

7. Переваривание пищи
Тип: Органическое
В отличие от механического пищеварения, которое начинается во рту с жевания, химическое пищеварение — это сложный процесс, который разбивает пищу на составляющие. Эти строительные блоки в конечном итоге всасываются в плазму крови для питания клеток организма.
Более конкретно, большие молекулы пищи редуцируются до субъединиц, которые достаточно малы для поглощения слизистой оболочкой пищеварительного тракта.
- Белки распадаются на аминокислоты.
- Нуклеиновые кислоты распадаются на нуклеотиды.
- Углеводные сахара распадаются на моносахариды.
- Жиры расщепляются на жирные кислоты и моноглицериды.
Это достигается с помощью различных ферментов (таких, как ферменты слюны, желудка, щеточной каймы и ферменты поджелудочной железы) посредством гидролиза.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

6. Гальваническое покрытие металла
Тип: неорганическое изменение
Гальваника — это процесс осаждения материала на твердую подложку с помощью электрического тока. Он используется для улучшения химических, физических и механических свойств подложки.
В этом процессе раствор, содержащий ионы металлов, помещается в резервуар, а подложка, на которую наносится покрытие, подключается к электрической сети, чтобы сделать ее катодом. Ионы металла в растворе движутся к катоду, где они приобретают электроны и образуют металлическое покрытие.
Распространенная форма гальванического покрытия используется для производства монет. Например, американский пенни сделан из цинка, покрытого слоем гальванической меди.
Видео:Проклятая химическая реакция 😜 #shortsСкачать

5. Прокисание молока
Тип: Органическое изменение
Испорченное молоко кислое, с неприятным запахом и вкусом. Со временем оно становится комковатым и свертывается. В процессе скисания образуются новые молекулы, и этот процесс нельзя обратить вспять.
Сырое молоко содержит сахар лактозу. Если оставить молоко на несколько часов при комнатной температуре, содержащиеся в нем бактерии лактобактерии начинают превращать лактозу в молочную кислоту, которая имеет кислый вкус. Бактерии Lactobacillus часто встречаются в молоке, и они не причиняют никакого вреда.
Кислое молоко также получают путем добавления кислоты (с добавлением или без добавления микробных организмов). Такое молоко называется подкисленным. По вкусу оно отличается от молока, полученного путем бактериальной ферментации, поскольку кислоты, добавляемые в процессе промышленного производства, имеют другой вкус, чем молочная кислота.
Видео:ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

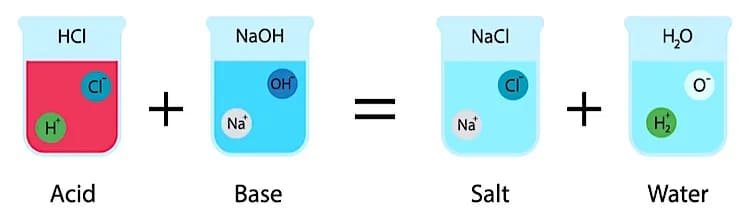
4. Смешивание кислоты с основанием
Тип: Неорганическое изменение
Смешивание кислоты с основанием — одна из самых распространенных химических реакций, проводимых в химических лабораториях. При смешивании в равных пропорциях они уравновешивают друг друга и образуют соль и воду. Это называется реакцией нейтрализации.
Например, в результате реакции между соляной кислотой (сильная кислота) и гидроксидом натрия (сильное основание) образуется хлорид натрия (поваренная соль).
HCl + NaOH → NaCl + H2O + тепло
В таких реакциях катион H(+) кислоты соединяется с анионом OH(-) основания, образуя соль и воду.
В некоторых реакциях образуются газы. Например, если смешать уксус (слабую кислоту) с пищевой содой (слабым основанием), то вместе с ацетатом натрия (солью) образуется углекислый газ.
Видео:Химия за 30 минут. Урок 5. Химические реакции в быту. #ЗНО#ЕГЭ #почему_запотевают_окнаСкачать

3. Ржавое железо
Тип: Неорганическое изменение
Когда железные предметы остаются в воде или влажной атмосфере в течение длительного времени, они покрываются красновато-коричневой чешуйчатой массой, называемой ржавчиной. Ржавление — это непрерывный процесс, который постепенно разрушает предметы и делает их бесполезными. Различные факторы, такие как кислотная среда и соленая вода, могут ускорить процесс ржавления железа.
Ржавчина — это не что иное, как оксид железа, соединение, образующееся при реакции железа с кислородом и водой. Хотя это сложный процесс, его химическое уравнение можно записать как:
Этот процесс также является хорошим примером коррозии, когда металлические поверхности разлагаются на более химически устойчивые оксиды.
2. Варка яйца
Тип: Неорганические изменения
Сырые яйца содержат сложные сети белка и воды. На каждую молекулу белка приходится почти тысяча молекул воды.
Молекулы белка относительно велики и содержат сотни аминокислот, связанных между собой в длинные цепочки. Цепочки складываются в компактные шарики, которые удерживаются вместе слабыми химическими связями (нековалентными).
Когда вы нагреваете яйца, их молекулы движутся быстрее и сталкиваются. При повышении температуры скорость столкновения увеличивается. Слабые связи (которые удерживают цепочки аминокислот) начинают разрываться, и белки яйца разворачиваются. В конце концов, белковые нити запутываются в трехмерную паутину.
В вареном яйце теперь содержится вода, которая диспергируется в белковой паутине, так что она больше не может сливаться воедино. В результате жидкое яйцо превращается в полутвердое.
По сути, вы изменили химические вещества, из которых состоит яйцо, применив тепло. Это необратимое изменение, а значит, вареное яйцо нельзя превратить обратно в сырое.
1. Фотосинтез
Тип: Биохимическое изменение
Фотосинтез — это процесс, используемый растениями и другими организмами для производства пищи. В этом естественном процессе световая энергия (солнечный свет) преобразуется в химическую энергию.
Растения являются основными продуцентами, которые составляют основу нашей экосистемы и подпитывают следующие трофические уровни. Они используют фотосинтез для преобразования солнечного света, воды, углекислого газа в кислород и простой сахар.
Поскольку для фотосинтеза требуется внешняя энергия (солнечный свет), чтобы привести в движение химические изменения, это эндотермическая реакция. Этот процесс не только используется растениями для получения пищи и роста, но и оказывает огромное влияние на нашу атмосферу и океаны, поскольку поглощает углекислый газ и производит кислород.
Без фотосинтеза на Земле было бы слишком мало кислорода — его не хватало бы для выживания людей.
Часто задаваемые вопросы
В чем разница между химическим изменением и физическим изменением?
Физическое изменение влияет на форму вещества. Он включает в себя изменения таких свойств, как прочность, долговечность, температура плавления, форма кристаллов, объем, плотность, форма, размер, цвет и текстура. Хорошим примером может служить закалка стали для изготовления лезвия ножа.
Химическое изменение, с другой стороны, включает в себя изменения в составе вещества. Оно происходит, когда различные вещества соединяются, образуя новые вещества с новыми свойствами. Эти химические реакции необратимы и сопровождаются изменением энергии.
Как определить химическое изменение?
Не всегда легко определить, произошло ли химическое изменение (в отличие от физического). Однако можно обратить внимание на такие признаки, как:
- Изменение цвета или порядка.
- Разложение органических веществ, таких как продукты питания и овощи.
- изменение энергии или температуры, например, потеря (эндотермическая) или выделение (экзотермическая) тепла.
- Образование газов или осадков.
- Изменение состава, например, при сжигании дерева оно превращается в пепел.
- Изменения невозможно обратить вспять.
- Некоторые химические реакции производят свет.
Какое вещество не может быть изменено обычными химическими реакциями?
Элемент — это чистое вещество, которое никогда не может быть уменьшено до более простой формы в результате какой-либо химической реакции. Это означает, что вы не можете превратить элемент в другой элемент или разложить его обычными химическими средствами, такими как электролиз, нагревание или реакция. Кислород, азот, золото и серебро являются примерами чистых веществ.