- Фосфор
- Положение в периодической системе химических элементов
- Электронное строение фосфора
- Физические свойства и нахождение в природе
- Соединения фосфора
- Способы получения фосфора
- Химические свойства фосфора
- Фосфин
- Строение молекулы и физические свойства
- Способы получения фосфина
- Химические свойства фосфина
- Фосфиды
- Способы получения фосфидов
- Химические свойства фосфидов
- Оксиды фосфора
- Оксид фосфора (III)
- Оксид фосфора (V)
- Фосфорная кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Фосфористая кислота
- Соли фосфорной кислоты — фосфаты
- Фосфор
- Содержание
- История
- Происхождение названия
- Получение
- Физические свойства
- Белый фосфор
- Жёлтый фосфор
- Красный фосфор
- Чёрный фосфор
- Металлический фосфор
- Химические свойства
- Взаимодействие с простыми веществами
- Взаимодействие с водой
- Взаимодействие со щелочами
- Восстановительные свойства
- Изотопы
- Применение
- Элементарный фосфор
- Соединения фосфора в сельском хозяйстве
- Соединения фосфора в промышленности
- Фосфатные связующие
- Биологическая роль соединений фосфора
- Токсикология элементарного фосфора
- Токсикология соединений фосфора
- Соединения фосфора
- Фосфин (PH3)
- Фосфиды
- Оксид фосфора (III), триоксид фосфора (P2O3)
- Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р2О5)
- Фосфорные кислоты
- Фосфористая кислота ( H3PO3)
- Соли фосфористой кислоты (Фосфиты)
- Ортофосфорная кислота, фосфорная кислота (Н3РO4)
- Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
- Фосфорные удобрения
Фосфор
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии :
Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Красный фосфор – это модификация с атомной кристаллической решеткой . Формула красного фосфора Pn, это полимер со сложной структурой. Твердое вещество без запаха, красно-бурого цвета, не ядовитое. Это гораздо более устойчивая модификация, чем белый фосфор. В темноте не светится. Образуется из белого фосфора при t=250-300 о С без доступа воздуха.
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор , который очень хорошо проводит электрический ток.
В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Соединения фосфора
Типичные соединения фосфора:
| Степень окисления | Типичные соединения |
| +5 | оксид фосфора (V) P2O5 ортофосфорная кислота H3PO4 метафосфорная кислота HPO3 Галогенангидриды: PОCl3, PCl5 |
| +3 | Оксид фосфора (III) P2O3 Галогенангидриды: PCl3 |
| +1 | Фосфорноватистая кислота H3PO2 Соли фосфорноватистой кислоты — гипофосфиты: MeH2PO2 |
| -3 | Фосфин PH3 Фосфиды металлов MeP |
Способы получения фосфора
1. Белый фосфор получают из природных фосфатов , прокаливая их с коксом и песком в электрической печи:
2. Вместо фосфатов можно использовать другие неорганические соединения фосфора, например , метафосфорную кислоту.
4HPO3 + 10C → P4 + 2H2O + 10 CO
3. Красный и черный фосфор получают из белого фосфора.
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1. Фосфор проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами .
1.1. При взаимодействии с кислородом воздуха образу
ются оксиды – ангидриды соответствующих кислот :
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например , кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
Еще пример : натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Например , азотная кислота окисляет фосфор до фосфорной кислоты:
Серная кислота также окисляет фосфор:
Соединения хлора, например , бертолетова соль , также окисляют фосфор:
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Некоторые металлы-сильные окислители также окисляют фосфор. Например , оксид серебра (I) :
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Например , фосфор реагирует с гидроксидом калия:
Или с гидроксидом кальция:
Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5 о .
У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влияние на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Фосфиды
Фосфиды – это бинарные соединения фосфора и металлов или некоторых неметаллов .
Способы получения фосфидов
Фосфиды получают при взаимодействии фосфора с металлами . При этом фосфор проявляет свойства окислителя.
Например , фосфор взаимодействует с магнием и кальцием:
Фосфор взаимодействует с натрием:
P + 3Na → Na3P
Химические свойства фосфидов
1. Фосфиды легко разлагаются водой или кислотами с образованием фосфина.
Например , фосфид кальция разлагается водой:
Фосфид магния разлагается соляной кислотой:
2. Фосфиды металлов проявляют сильные восстановительные свойства за счет фосфора в степени окисления -3 .
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (III)
Оксид фосфора (III) – это кислотный оксид . Белые кристаллы при обычных условиях. Пары состоят из молекул P4O6.
Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода :
Химические свойства оксида фосфора (III):
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
Например , оксид фосфора (III) диспропорционирует в горячей воде:
2. При взаимодействии с окислителями P2O3 проявляет свойства восстановителя.
Например , N2O окисляется кислородом:
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
а со щелочами – с образованием солей (фосфитов):
Оксид фосфора (V)
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
Химические свойства.
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например , оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
2. Фосфорный ангидрид является типичным кислотным оксидом , взаимодействует с водой с образованием фосфорных кислот:
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями .
Например , оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
Еще пример : оксид фосфора взаимодействует с оксидом бария (при сплавлении):
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет орто-фосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.) .
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например , концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая) .
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , фосфорная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например , фосфорная кислота взаимодействует с гидрокарбонатом натрия:
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , фосфорная кислота реагирует с магнием:
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфористая кислота
Фосфористая кислота H3PO3 — это двухосновная кислородсодержащая кислота. При нормальных условиях бесцветное кристаллическое вещество, хорошо растворимое в воде.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Получение фосфористой кислоты.
Фосфористую кислоту можно получить гидролизом галогенидов фосфора (III).
Например , гидролизом хлорида фосфора (III):
Фосфористую кислоту можно получить также взаимодействием оксида фосфора (III) с водой:
Химические свойства.
1. Фосфористая кислота H3PO3 в водном растворе — двухосновная кислота средней силы. Взаимодействует с основаниями с образованием солей-фосфитов.
Например , при взаимодействии с гидроксидом натрия фосфористая кислота образует фосфит натрия:
2. При нагревании фосфористая кислота разлагается на фосфин (Р -3 ) и фосфорную кислоту (Р +5 ):
3. За счет фосфора в степени окисления +3 фосфористая кислота проявляет восстановительные свойства .
Например , H3PO3 окисляется перманганатом калия в кислой среде:
Еще пример : фосфористая кислота окисляется соединениями ртути (II):
Соли фосфорной кислоты — фосфаты
Фосфорная кислота образует разные типы солей: средние – фосфаты, кислые – гидрофосфаты, дигидрофосфаты.
1. Качественная реакция на фосфаты — взаимодействие с нитратом серебра. При этом образуется желтый осадок фосфата серебра.
2. Нерастворимые фосфаты растворяются под действием сильных кислот, либо под действием фосфорной кислоты.
Например , фосфат кальция реагирует с фосфорной кислотой с образованием дигидрофосфата кальция:
Фосфат кальция растворяется под действием серной кислоты:
3. За счет фосфора со степенью окисления +5 фосфаты проявляют слабые окислительные свойства и могут взаимодействовать с восстановителями.
Например , фосфат кальция при сплавлении реагирует с углеродом с образованием фосфида кальция и угарного газа:
Фосфат кальция также восстанавливается алюминием при сплавлении:
4. Гидрофосфаты могут взаимодействовать и с более сильными кислотами, и с щелочами . Под действием фосфорной кислоты гидрофосфаты переходят в дигидрофосфаты.
Например , гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
Под действием едкого кали гидрофосфат калия образует более среднюю соль — фосфат калия:
5. Дигидрофосфаты могут взаимодействовать с более сильными кислотами и щелочами , но не реагируют с фосфорной кислотой.
Например , дигидрофосфат натрия взаимодействует с избытком гидроксида натрия с образованием фосфата:
Видео:Химия 9 класс (Урок№16 - Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V).)Скачать

Фосфор
(молярная масса)
(первый электрон)
Фосфор (от др.-греч. φῶς — свет и φέρω — несу; φωσφόρος — светоносный; лат. Phosphorus ) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Элемент входит в группу пниктогенов. Фосфор — один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л . В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3 (F,Cl,OH), фосфорит (Сa3(PO4)2) и другие. Фосфор входит в состав важнейших биологических соединений — фосфолипидов. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Видео:Химические свойства фосфора | ХимияСкачать

Содержание
- 1 История
- 2 Происхождение названия
- 3 Получение
- 4 Физические свойства
- 4.1 Белый фосфор
- 4.2 Жёлтый фосфор
- 4.3 Красный фосфор
- 4.4 Чёрный фосфор
- 4.5 Металлический фосфор
- 5 Химические свойства
- 5.1 Взаимодействие с простыми веществами
- 5.2 Взаимодействие с водой
- 5.3 Взаимодействие со щелочами
- 5.4 Восстановительные свойства
- 6 Изотопы
- 7 Применение
- 7.1 Элементарный фосфор
- 7.2 Соединения фосфора в сельском хозяйстве
- 7.3 Соединения фосфора в промышленности
- 7.4 Фосфатные связующие
- 8 Биологическая роль соединений фосфора
- 8.1 Токсикология элементарного фосфора
- 8.2 Токсикология соединений фосфора
- 9 Опасность для здоровья
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

История
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать философский камень, а получил светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая золотистым цветом, может содержать золото или нечто нужное для его добычи. Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не исчезнет неприятный запах, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте. Бранд назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времён античности.
Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году.
Более усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.
Аморфную аллотропную модификацию фосфора — красный фосфор Pn — выделил, нагревая белый фосфор без доступа воздуха, А. Шрёттер в середине XIX в.
Видео:ОГЭ/Характеристика азота и фосфора/9 класс химияСкачать

Происхождение названия
В 1669 году Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём». Вторичное название «фосфор» происходит от греческих слов «φώς» — свет и «φέρω» — несу. В древнегреческой мифологии имя Фосфор (или Эосфор, др.-греч. Φωσφόρος ) носил страж Утренней звезды.
Видео:Фосфор. 9 класс.Скачать

Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
Образующиеся пары фосфора конденсируются в приёмнике под слоем воды в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов для получения элементарного фосфора можно восстанавливать углём и другие неорганические соединения фосфора, например, в том числе, метафосфорную кислоту:
Видео:Фосфор. Химические свойстваСкачать

Физические свойства
Элементарный фосфор при нормальных условиях существует в виде нескольких устойчивых аллотропических модификаций. Все существующие аллотропные модификации фосфора пока (2016 г.) до конца не изучены. Традиционно различают четыре его модификации: зеленовато-белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные описываемые модификации являются смесью этих четырёх. При стандартных условиях устойчивы только три аллотропических модификации фосфора (например, белый фосфор термодинамически неустойчив (квазистационарное состояние) и переходит со временем при нормальных условиях в красный фосфор). В условиях сверхвысоких давлений термодинамически устойчива металлическая форма элемента. Все модификации различаются по цвету, плотности и другим физическим и химическим характеристикам, особенно по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный (металлический).
Белый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
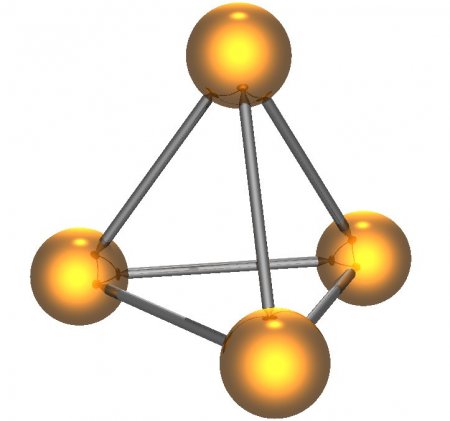
Белый фосфор имеет молекулярную кристаллическую решётку, формула молекулы белого фосфора — P4, причём атомы расположены в вершинах тетраэдра. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах.
Плохо растворяется в воде, но легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). При взаимодействии с кислородом белый фосфор горит даже под водой.
Белый фосфор не только активен химически, но и весьма ядовит: летальная доза белого фосфора для взрослого человека составляет 0,05—0,15 г, а при хроническом отравлении поражает кости, например, вызывает омертвение челюстей. При контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги.
Под действием света, при нагревании до не очень высоких температур в безвоздушной среде, а также под действием ионизирующего излучения белый фосфор превращается в красный фосфор.
Жёлтый фосфор
Неочищенный белый фосфор обычно называют «жёлтый фосфор». Сильно ядовитое (ПДК в атмосферном воздухе 0,0005 мг/м³), огнеопасное кристаллическое вещество от светло-жёлтого до тёмно-бурого цвета. Плотность 1,83 г/см³, плавится при +43,1 °C, кипит при +280 °C. В воде не растворяется, на воздухе легко окисляется и самовоспламеняется. Горит ослепительным ярко-зелёным пламенем с выделением густого белого дыма — мелких частичек декаоксида тетрафосфора P4O10.
Так как фосфор реагирует с водой лишь при температуре свыше 500 °C, то для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твёрдое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).
Красный фосфор
Красный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа). Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других веществах, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Чёрный фосфор
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2⋅10 9 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 1,8⋅10 6 Па.
Металлический фосфор
При 8,3⋅10 10 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25⋅10 11 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Видео:Азот и фосфор VA группа | Химия ЕГЭ, ЦТСкачать

Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
4P + 5O2 → 2P2O5 (с избытком кислорода) 4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
может быть получен аналогичный аммиаку фосфористый водород (фосфин) — PH3
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
Реакция взаимодействия красного фосфора и воды с образованием ортофосфорной кислоты и водорода. Реакция протекает при температуре 700—900 °C. Катализатором могут выступать: платина, медь, титан, цирконий.
Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования:
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
Видео:Химия фосфора | Химия ЕГЭ | УмскулСкачать

Изотопы
Известно более 20 изотопов фосфора (с массовым числом от 24 до 47). Природный изотоп 31 P стабилен. Из радиоактивных изотопов наиболее долгоживущие: 30 P (T1/2 = 2,5 мин), 32 P (T1/2 = 14,26 сут) и 33 P (T1/2 = 25,34 сут)..
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
- в качестве комплексообразователей (средства для умягчения воды),
- в составе пассиваторов поверхности металлов (защита от коррозии, например, т. н. состав «мажеф»).
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Биологическая роль соединений фосфора
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Ca3(PO4)2·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
Суточная потребность в фосфоре составляет:
- для взрослых 1,0—2,0 г
- для беременных и кормящих женщин 3—3,8 г
- для детей и подростков 1,5—2,5 г
При больших физических нагрузках потребность в фосфоре возрастает в 1,5—2 раза.
Усвоение происходит эффективнее при приёме фосфора вместе с кальцием в соотношении 3:2 (P:Ca).
| Продукт | Содержание, мг/100 г |
|---|---|
| Очищенное конопляное семя | 1650 |
| Семена тыквы (ядра) | 1233 |
| Семена подсолнечника (ядра) поджаренные | 1158 |
| Семена мака | 870 |
| Горчичный порошок | 828 |
| Кунжут (очищенный) | 774 |
| Семена дыни (ядра) | 755 |
| Какао-порошок | 734 |
| Твёрдый пармезан | 694 |
| Семена подсолнечника (ядра) сушёные | 660 |
| Сафлора семена (ядра) | 644 |
| Семена льна | 642 |
| Семена лотоса | 626 |
| Сыр швейцарский нежирный | 605 |
| Кешью сырые | 593 |
| Орехи пили | 575 |
| Амарантовая крупа | 557 |
| Сыр гауда | 546 |
| Овёс | 523 |
| Грецкий орех чёрный | 513 |
| Печень говяжья тушёная | 497 |
| Фисташки сырые | 490 |
| Миндаль | 481 |
| Киноа | 457 |
| Люпин, семена | 440 |
| Карп | 415 |
| Фасоль | 407 |
| Арахис | 397 |
| Сыр рокфор | 392 |
| Мука из цельного зерна | 357 |
| Печень куриная | 297 |
| Вырезка свиная | 286 |
| Желтоперый тунец | 278 |
| Сгущённое молоко | 253 |
| Яйцо | 198 |
| Говядина | 188 |
| Курица | 178 |
Токсикология элементарного фосфора
- Красный фосфор практически нетоксичен (токсичность ему придают примеси белого фосфора). Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
- Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50—150 мг. Попадая на кожу, тлеющий белый фосфор даёт тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2—3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать поражённые участки растворами медного купороса или соды. ПДК паров фосфора в воздухе производственных помещений — 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе — 0,0005 мг/м³, ПДК в питьевой воде — 0,0001 мг/дм³.
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Ввиду высокой (ЛД50 15-100 мг/кг) и чрезвычайно высокой ( Опасность для здоровья
Видео:Особенности строения и свойства молекулы азота. 11 класс.Скачать

Соединения фосфора
Видео:Химия 9 класс: ФосфорСкачать

Фосфин (PH3)
Способы получения фосфина
Прямым синтезом PH3 получить нельзя.
- Фосфин получают путем водного или кислотного гидролиза фосфидов:
- Реакция диспропорционирования фосфора в щелочах:
- Разложение солей фосфония (Температура выше 80ºС):
Физические свойства фосфина
При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом. В воде малорастворим, хорошо растворим в органических растворителях
Фосфин — Яд!
Химические свойства фосфина
- PH3не реагирует с водой, щелочами, аммиаком.
PH3 — Проявляет свойства сильного восстановителя.
- Вступает в реакции с кислотами – окислителями:
- С безводными кислотами образует соли:
- Окисляется кислородом. При Т
Практического значения фосфин не имеет.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Фосфиды
Способы получения
Взаимодействие фосфора с металлами:
Физические свойства, строение фосфидов
Фосфиды – представляют собой продукты взаимодействия фосфора с металлами.
Фосфиды щелочных и щелочноземельных металлов имеют ионное строение.
Химические свойства фосфидов
Фосфиды крайне неустойчивы и легко подвергаются необратимому гидролизу с образованием РН3:
Видео:Оксиды фосфора. Строение, способы получения, свойства | ХимияСкачать

Оксид фосфора (III), триоксид фосфора (P2O3)
Способы получения оксида фосфора (III)
- Р2О3 образуется при горении фосфора в недостатке кислорода или его медленном окислении:
Физические свойства оксида фосфора (III)
При комнатной температуре Р2О3 — белая воскообразная масса с неприятным запахом. Легко испаряется, его Тпл = 23,5°С
Пары существует в виде димеров Р4О6.
!Очень ядовит
Химические свойства оксида фосфора (III)
- Р2О3 как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
- Реакция диспропорционирования происходит очень бурно при растворении Р2О3в горячей воде:
- При взаимодействии Р2О3с щелочами образуются соли фосфористой кислоты:
- При взаимодействии с окислителями P2O3 проявляет восстановительные свойства:
Окисление кислородом воздуха:
Окисление галогенами:
Видео:Ортофорфорная кислота. Соли фосфорной кислоты. 9 класс.Скачать

Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р2О5)
Способы получения фосфорного ангидрида
Сжигание фосфора в избытке воздуха:
Физические свойства фосфорного ангидрида
При комнатной температуре Р2О5 — белые стеклообразные хлопья без запаха. Существует в виде димеров Р4О10.
Очень гигроскопична, при соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Химические свойства фосфорного ангидрида
Р2О5 проявляет кислотные свойства.
Как кислотный оксид Р2О5 взаимодействует:
- с водой, с образованием различных кислот:
- с основными оксидами, с образованием фосфатов
- с щелочами, с образованием средних и кислых солей
- Фосфорный ангидрид способен отнимать у других веществ не только гигроскопическую влагу, но и химически связанную воду. Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Видео:Элементы 15 (VA) группы. Азот. 9 класс.Скачать

Фосфорные кислоты
Фосфор образует только 2 устойчивых оксида, в которых он находится в степенях окисления +5 и +3. Однако существует большое число кислот, в которых фосфор имеет валентность равную V (пять ковалентных связей) и степени окисления +5, +4, +3, +1.
Строение наиболее известных кислот выражается следующими формулами:
Наибольшее практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая (фосфористая) кислоты.
Видео:Химия фосфора | Химия ЕГЭ 2022 | УмскулСкачать

Фосфористая кислота ( H3PO3)
Способы получения фосфористой кислоты
- Гидролиз галогенидов фосфора (III):
- Окисление белого фосфора хлором:
Физические свойства, строение фосфористой кислоты
Для молекулы фосфористой кислоты H3PO3 известны 2 таутомерные формы. В одной из них 2 атома водорода молекулы связаны с кислородом, а один атом водорода связан непосредственно с атомом фосфора. Такой атом водорода не может быть замещен атомами металлов, поэтому кислота является двухосновной.
В другой таутомерной форме – все три атома водорода связаны с кислородом.
Формула фосфористой кислоты выглядит следующим образом: Н2[НРО3]
При комнатной температуре H3PO3 – кристаллическое вещество без цвета, хорошо растворимое в воде, Тпл = 74°С.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Химические свойства фосфористой кислоты
Является слабой кислотой.
- Для нее характерны все свойства кислот — взаимодействие с металлами с выделением Н2; с оксидами металлов и с щелочами. При этом образуются одно — или двухзамещенные фосфиты:
- Кислота является и окислителем и восстановителем, при нагревании вступая в реакции диспропорционирования:
Кислота и ее соли являются сильными восстановителями:
- Реагируют с сильными окислителями:
- Реагируют с более слабыми окислителями:
- В реакции с сильными восстановителями, например, с щелочными и щелочно-земельными металлами, цинковой пылью, кислота восстанавливается до фосфина:
- При нагревании водного раствора Н3РO3окисляется до H3PO4 с выделением водорода:
Видео:9 класс § 32 "Фосфор и его соединения".Скачать

Соли фосфористой кислоты (Фосфиты)
Способы получения фосфитов
- Взаимодействие фосфористой кислоты с щелочами:
- взаимодействие фосфористой кислоты с металлами с выделением Н2
- взаимодействие фосфористой кислоты с оксидами металлов
- диспропорционирование фосфора в горячем, концентрированном растворе щелочи:
- Взаимодействие трихлорида фосфора с разбавленным раствором щелочи:
Физические свойства фосфитов
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2РО3, например: NaH2PO3, Са(H2PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2 или 1 анионом HPO3, например: Na2HPO3, СаHPO3.
Хорошо растворимы в воде только фосфиты щелочных металлов и кальция, остальные фосфиты плохо растворимы.
Химические свойства фосфитов
Имеют химические свойства, характерные для солей
Видео:Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Ортофосфорная кислота, фосфорная кислота (Н3РO4)
Способы получения фосфорной кислоты
В промышленности Н3РO4 получают двумя способами:
- Разложением природного соединения – фосфата кальция Са3(РO4)2 серной кислотой:
- Доменный (термический) 3х-стадийный способ:
1 стадия — восстановление природных фосфоритов коксом
2 стадия – окисление получающихся паров свободного фосфора кислородом воздуха
3 стадия – орошение водой получающейся окиси фосфора:
Лабораторный способ
- Н3РO4 получают окислением фосфора азотной кислотой:
- Взаимодействием фосфорного ангидрида с водой:
Физические свойства, строение фосфорной кислоты
При обычной температуре безводная Н3РO4 – прозрачное, легкоплавкое (Тпл = 42°С) кристаллическое вещество. Н3РO4 -очень гигроскопичное вещество и смешивается с водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует сиропообразную, вязкую жидкость.
Степень окисления фосфора в фосфорной кислоте равна +5, валентность равна V.
При нагревании орто-фосфорной кислоты выше +213 °C, она переходит в пирофосфорную H4P2O7.
При нагревании выше 700°С переходит в метафосфорную кислоту HPO3:
Качественные реакции для обнаружения фосфат-иона
Для обнаружения анионов фосфорной кислоты используют раствор AgNO3, при помощи которого также можно различить мета-, пиро- и ортофосфорные кислоты друг от друга.
При добавлении AgNO3 к кислотам образуются осадки различного цвета:
- метафосфат серебра AgPO3— белый
- пирофосфат серебра Ag4P2O7 – также белый, но он не свертывает яичного белка
- ортофосфат серебра Ag3PO4— желтый:
Химические свойства фосфорной кислоты
Фосфорная кислота H3PO4 – это электролит средней силы и представляет собой трехосновную кислоту.
Диссоциация протекает в основном по 1-й ступени:
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
- Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами:
- с основными оксидами:
- с основаниями образует три ряда солей – одно-, двух- и трехзамещенные (кислые и средние соли):
- с аммиаком образует соли аммония:
- Вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также вступает в обменные реакции с солями:
- При нагревании H3PO4 выше 200°С происходит отщепление молекулы воды с образованием пирофосфорной кислотыH2P2O7:
В отличие от аниона NO3 — в азотной кислоте, анион РO4 3- окисляющим действием не обладает.
Видео:Фосфин. Состав, строение, свойства, получениеСкачать

Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
Способы получения фосфатов
Получают кислоты с металлами, оксидами металлов, гидроксидами (см. Химические свойства ортофосфорной кислоты)
Физические свойства фосфатов
Н3РO4 является 3х-основной кислотой, поэтому образует 3 типа солей:
| Анион соли | Название | Растворимость в воде | Примеры солей |
| PO4 3- | Фосфат (ортофосфат) | большинство нерастворимы (кроме фосфатов щелочных металлов и аммония) | Na3РO4; Са3(РO4)2 |
| HPO4 2- | Гидрофосфат | растворимы | Na2НРO4; СаНРО4 |
| Н2РO4 — | Дигидрофосфат | очень хорошо растворимы | NaH2PO4; Са(Н2РO4)2 |
Химические свойства фосфатов
- Имеют свойства, характерные для солей.
- Соли щелочных металлов подвержены гидролизу:
- Характерная особенность ортофосфатов – отношение к прокаливанию: однозамещенные соли переходят в метафосфаты, двухзамещенные – в пирофосфаты, из трехзамещенных изменяются только соли аммония:
Фосфорные удобрения
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
При достаточном количестве фосфора растения быстро растут и хорошо плодоносят. Внесение фосфорных удобрений благоприятствует росту корневой системы растения и повышению урожайности. В связи с этим такие удобрения важны при выращивании овощных, зерновых и плодово-ягодных культур.
В таблице ниже приведены основные виды фосфорных удобрений.
Категории V группа (азот, фосфор), НЕОРГАНИЧЕСКАЯ ХИМИЯ